Слайд 1Основы
ферментативного катализа
Особенности кинетики неаллостерических ферментов
ЛЕКЦИЯ 4
Слайд 2 Главная функция белков - ферментативная (каталитическая).
«Все ферменты –
белки, но не все белки
ферменты»
Фундаментальное положение о том, что ферментами (биокатализаторами) могут быть исключительно белки, просуществовало до 1967 года, когда впервые заговорили о рибозимах.
Слайд 3Рибозимы (ribonucleic acid enzyme) = РНК фермент или каталитическая РНК
В 1967 г. Карл Везе, Френсис Крик и Лесли Оргел
высказали гипотезу о том, что РНК может выполнять
роль биокатализатора, поскольку её молекула спо-
собна формировать вторичную структуру.
В 1980 г. Томас Чек и Сидней Альтман выделили
рибозимный комплекс из клеток простейших и бакте-
рий (Нобелевские лауреаты 1989 г. – «Исследование
каталитических свойств РНК»).
Термин рибозимы был введен в 1982 году
Келли Крюгером.
Слайд 4Реакции, катализируемые рибозимами:
гидролиз фосфодиэфирных связей внутри самой молекулы РНК;
гидролиз
химических связей в других
молекулах РНК;
обеспечивают аминотрансферазную активность в
рибосомах.
В качестве кофакторов для рибозимов
выступают ионы двухвалентных металлов
(часто Mg2+).
Слайд 5Избранные факты из истории энзимологии
В 17 веке Ван Гельмонт ввел
термин «фермент» - от fermentum
(лат.) – закваска.
К
концу 19 века «фермент» и «энзим» стали синонимами.
1890 г. Эмиль Фишер сформулировал идею о субстратной спе-
цифичности ферментов. Гипотеза «ключ – замок».
В самом начале ХХ века И.Павлов впервые указал на возмож-
ность существования пищеварительных ферментов в неактив-
ной форме (профермент, зимоген).
1913 г. Леонор Михаэлис и Мод Ментен (Германия) – вывели
уравнение, описывающее кинетику ферментативной реакции.
С 1922 г. начались систематические работы по выделению и
очистке ферментов.
1926 г. Семнер – первым в мире получил в кристаллическом
виде фермент уреазу. Поставлена точка в дискуссии: «Суще-
ствуют ли ферменты, имеющие небелковую природу?»
ХХ век для биохимии – век энзимологии
биологические катализаторы,
способные многократно изменять скорость метабо-
лических реакций.
Отличия ферментов от небиологических катализа-
торов:
Ферменты обладают субстратной специфично-стью. Это универсальное свойство ферментов.
Специфичность превращений с участием фермен-тов: не только определенный субстрат, но и определенный продукт.
Ферментативный катализ чрезвычайно эффекти-вен: ускоряет превращения в 106 – 1011 раз.
Ферментативный катализ тонко регулируется.
Фермент никогда не расходуется в ходе катализи-руемой реакции.
Слайд 76. Скорость ферментативной реакции пропорцио-
нальна количеству фермента.
7. Ферментативный
катализ происходит в особых
условиях: температура +37о С, оптимальное
значе-
ние рН, давление – 1 атмосфера.
Ферментативный катализ подчиняется законам
термодинамики:
Фермент может катализировать только термо-
динамически вероятную реакцию (т.е. спонтан-
ные или самопроизвольно протекающие в дан-
ных условиях реакции).
Фермент не изменяет направление биохимичес-
кой реакции и не сдвигает ее равновесие. При учас-
тии фермента равновесие достигается во много раз
быстрее (секунды), чем в его отсутствие (часы).
Фермент в одинаковой степени ускоряет как пря-
мую, так и обратную реакции.
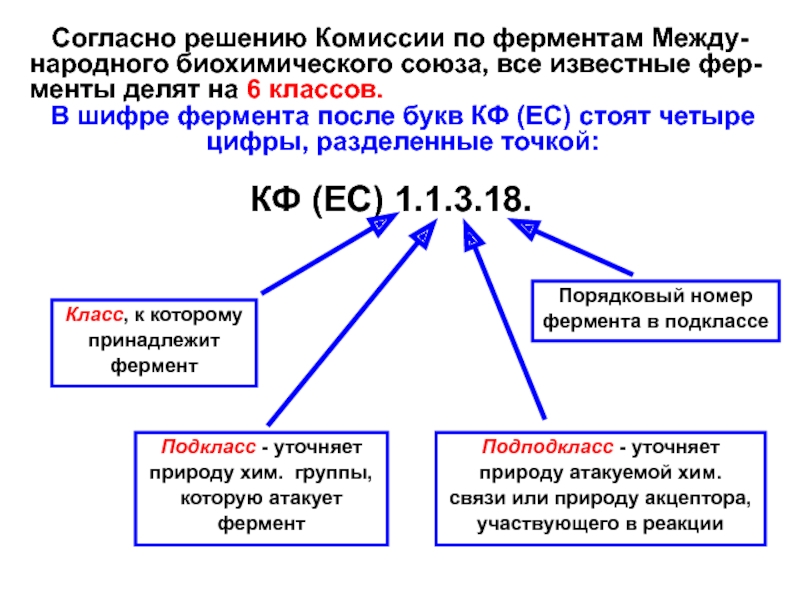
Слайд 8 Согласно решению Комиссии по ферментам Между-народного биохимического союза,
все известные фер-менты делят на 6 классов.
В шифре фермента после
букв КФ (EC) стоят четыре цифры, разделенные точкой:
КФ (EC) 1.1.3.18.
Класс, к которому
принадлежит
фермент
Подкласс - уточняет
природу хим. группы,
которую атакует
фермент
Подподкласс - уточняет
природу атакуемой хим.
связи или природу акцептора,
участвующего в реакции
Порядковый номер
фермента в подклассе
1 класс: ОКСИДОРЕДУКТАЗЫ
Катализируют окислительно-восстановительные реакции. Содержит
17 подклассов (самый многочис-ленный класс ферментов):
S1(red.) + S2(ox) S1(ox) + S2 (red.)
Дегидрогеназы – если субстрат является донором Н+
Оксидазы – если акцептором электрона является
молекулярный кислород.
Оксигеназы – если молекулярный кислород непосред-
ственно включается в молекулу
субстрата.
E
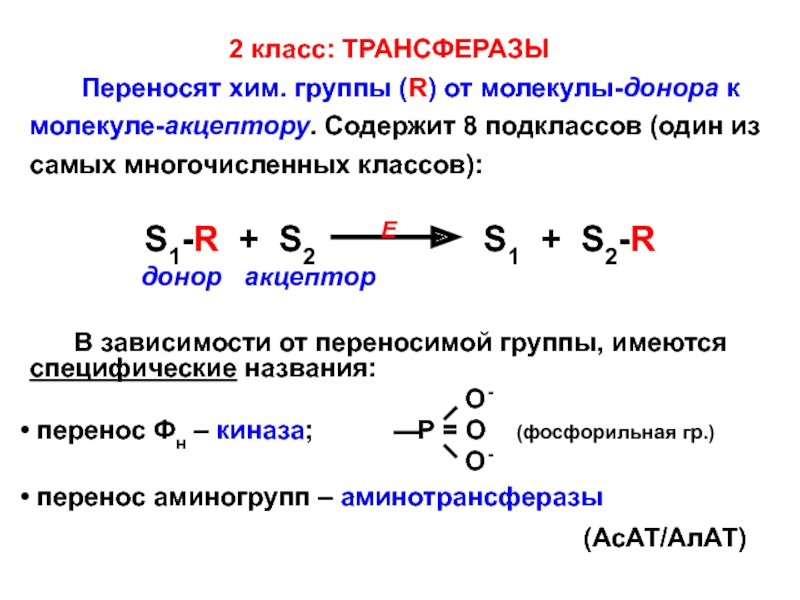
2 класс: ТРАНСФЕРАЗЫ
Переносят хим. группы (R) от молекулы-донора к молекуле-акцептору. Содержит 8 подклассов (один из самых многочисленных классов):
S1-R + S2 S1 + S2-R
донор акцептор
В зависимости от переносимой группы, имеются специфические названия:
О-
перенос Фн – киназа; Р = О (фосфорильная гр.)
О-
перенос аминогрупп – аминотрансферазы
(АсАТ/АлАТ)
Е
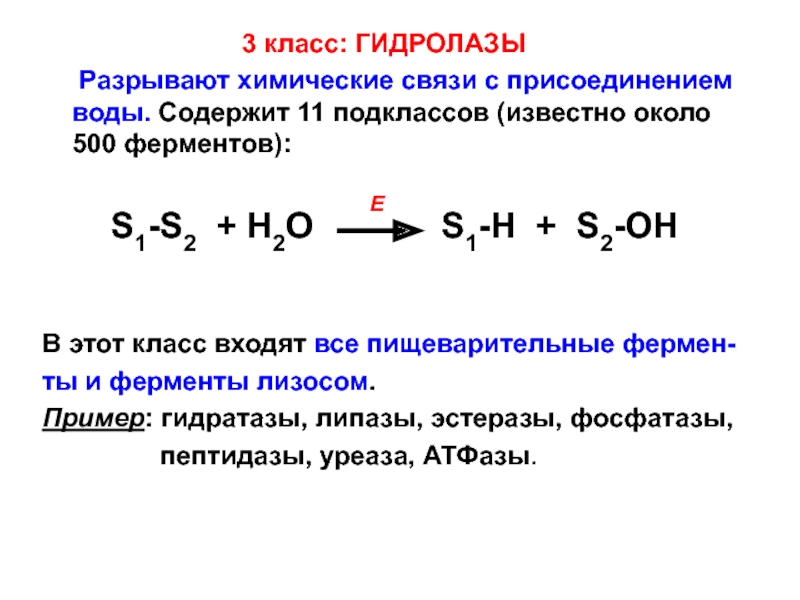
3 класс: ГИДРОЛАЗЫ
Разрывают
химические связи с присоединением воды. Содержит 11 подклассов (известно около 500 ферментов):
S1-S2 + H2O S1-H + S2-OH
В этот класс входят все пищеварительные фермен-
ты и ферменты лизосом.
Пример: гидратазы, липазы, эстеразы, фосфатазы,
пептидазы, уреаза, АТФазы.
Е
Слайд 124 класс: ЛИАЗЫ
Отщепляют (не гидролитически) от субстрата хим. группу, или
присоединяют воду по двойной связи.
Содержат 4 подкласса (известно около 230
фермен-тов):
S-R S + R
S1= S2 + H2O S1-H + S2- OH
В основном это ферменты, работающие при син-тезе или расщеплении промежуточных продуктов обмена.
Пример: декарбоксилазы, гидратазы.
E
E
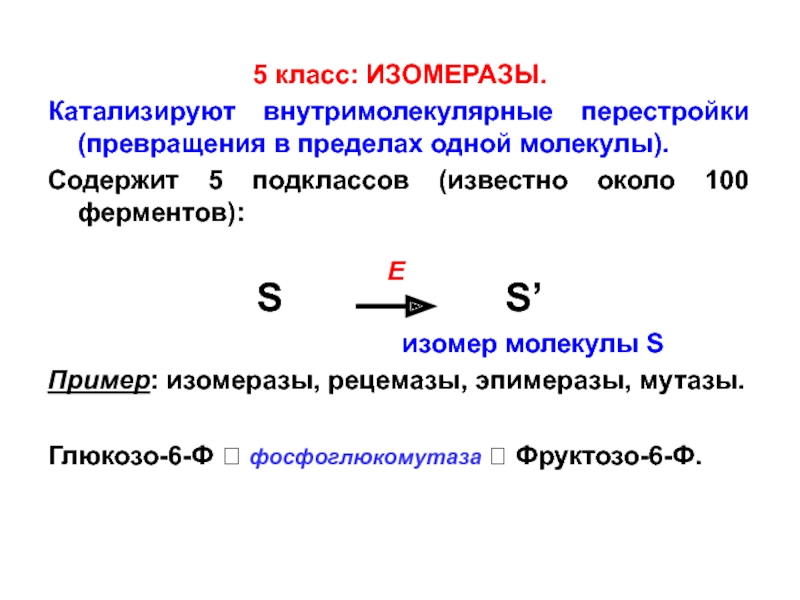
Слайд 135 класс: ИЗОМЕРАЗЫ.
Катализируют внутримолекулярные перестройки (превращения в пределах одной молекулы).
Содержит
5 подклассов (известно около 100 ферментов):
S
S’
изомер молекулы S
Пример: изомеразы, рецемазы, эпимеразы, мутазы.
Глюкозо-6-Ф ? фосфоглюкомутаза ? Фруктозо-6-Ф.
E
Слайд 146 класс: ЛИГАЗЫ
Катализируют присоединение друг к другу двух разных
молекул с образованием ковалентной связи. Процесс идет с потреблением энергии.
Если источниками являются АТФ или другие нуклеозидТФ, то СИНТЕТАЗА:
S1 + S2 + ATP S1-S2 + ADP
Если источниками являются высокоэнергетические фосфаты (ФЕП, креатин-Ф и др.), то СИНТАЗА:
S1 + S2 + X~Y S1-S2 + X
Содержит 5 подклассов (известно менее 100 фермен-тов).
E
E
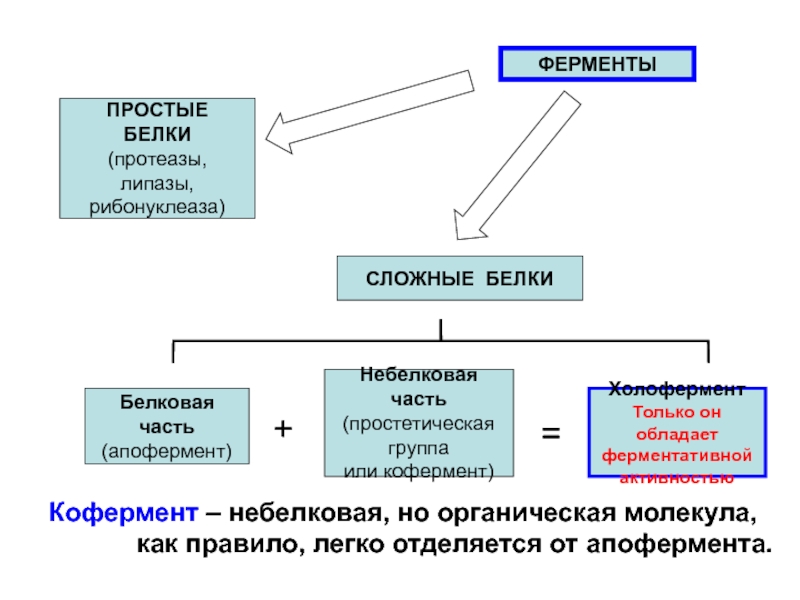
Слайд 15ФЕРМЕНТЫ
ПРОСТЫЕ БЕЛКИ
(протеазы,
липазы,
рибонуклеаза)
СЛОЖНЫЕ БЕЛКИ
Белковая часть
(апофермент)
Небелковая часть
(простетическая
группа
или кофермент)
Холофермент
Только он
обладает
ферментативной
активностью
+
=
Кофермент – небелковая, но органическая молекула,
как правило, легко отделяется от апофермента.
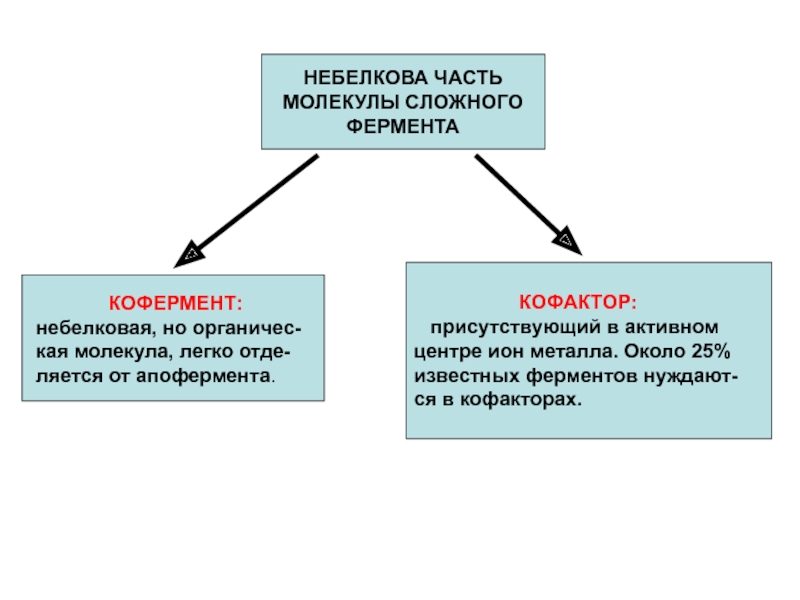
Слайд 16НЕБЕЛКОВА ЧАСТЬ
МОЛЕКУЛЫ СЛОЖНОГО
ФЕРМЕНТА
КОФЕРМЕНТ:
небелковая, но органичес-кая молекула, легко отде-ляется от апофермента.
КОФАКТОР:
присутствующий в активном
центре ион металла. Около 25%
известных ферментов нуждают-
ся в кофакторах.
Слайд 17Классификация коферментов:
Витаминные коферменты
НАД, НАДФ, ФМН, КоА и др.,
Их предшественниками
явля-ются витамины.
Невитаминные коферменты
Нуклеотидные коферменты.
Металлопорфириновые коферменты.
Пептидные коферменты.
Ионы металлов.
Роль металлов в ферментативном катализе:
1. Металлы образуют электрофильные группы в составе активного
центра: они связываются с «-» зарядами в молекуле субстрата.
2. Металлы с переменной валентностью сами участвуют в переносе
электронов (прямое участие в катализе).
3. Металлы участвуют в формировании и стабилизации пространствен-
ной конфигурации молекулы фермента, включая четвертичную струк-
туру.
4. Металлы формируют «мостик», соединяющий апо- и ко-фермент.
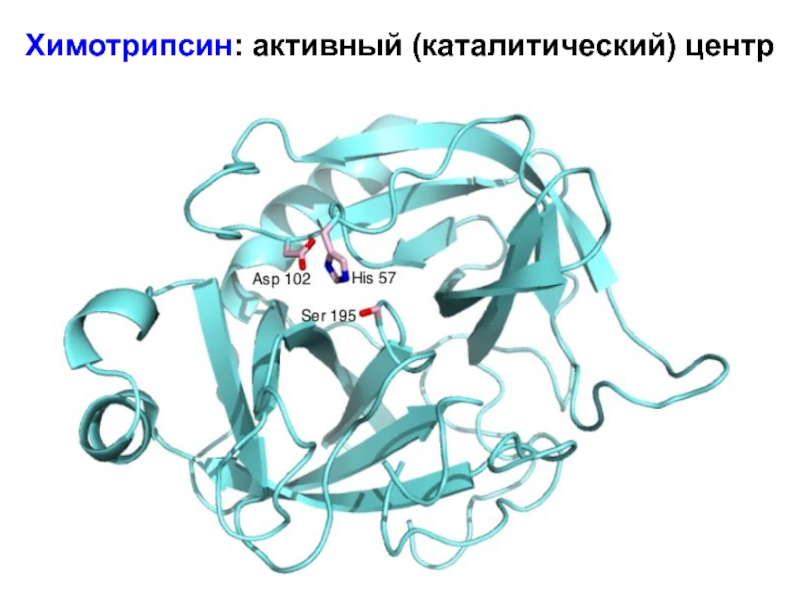
Слайд 18Активный (каталитический) центр фермента
В нём происходят два важнейших
события:
связывание молекулы субстрата
превращение субстрата(ов) в продукт(ы).
В сложных ферментах,
неотъемлемой частью актив-
ного (каталитического) центра является кофактор.
Активный (каталитический) центр, чаще всего, формируется 12 - 16
аминокислотами, которые в первичной структуре полипептидной цепи
расположены на значительном расстоянии друг от друга.
После того, как полипептидная цепь фермента образует нативную
пространственную конфигурацию (конформацию), аминокислоты
сближаются и занимают в пространстве определенное (уникальное)
положение.
Слайд 19Химотрипсин: активный (каталитический) центр
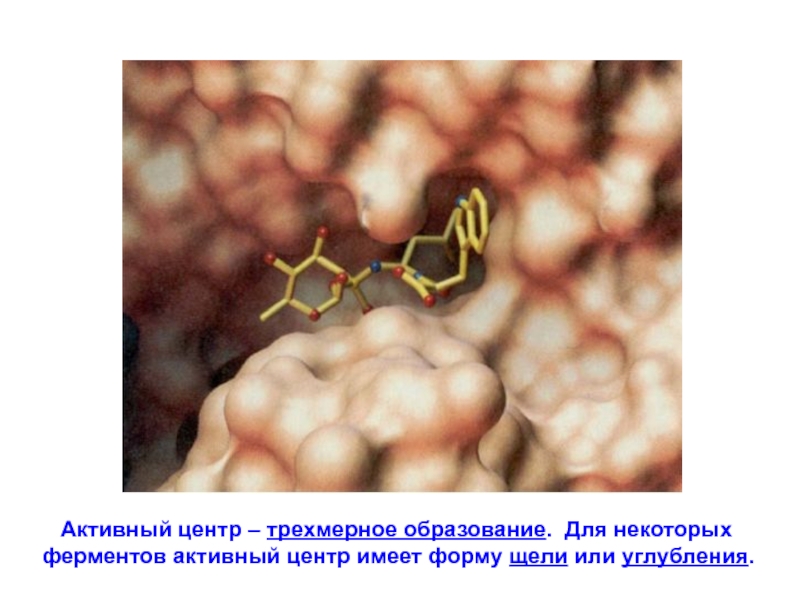
Слайд 20 Активный центр – трехмерное образование. Для некоторых
ферментов
активный центр имеет форму щели или углубления.
Слайд 21Структура активного центра фермента:
Контактный (якорный) участок – служит
для связывания молекулы субстрата, размещения её в строго определенной позиции
и определяет субстратную специфичность фермента. Образующаяся связь примерно в 50-100 раз слабее ковалентной. Каталитического превращения в этом участке не происходит.
Каталитический участок – служит для превращения субстрата в продукт. Этот участок определяет путь превращения субстрата.
Примеры функциональных групп аминокислотных остатков, участвующих в катализе:
карбоксильная гр. (АСП, ГЛИЦ)
аминогруппа (ЛИЗ)
имидазольная гр. (ТРИПТ)
индольна гр. (ТИР)
ароматическое кольцо (ф-АЛА)
сульфгидрильна гр. (ЦИС)
тиоэфирная гр. (МЕТ) и др.
Гидрофобные функц. группы
аминокислот в составе активного
центра фермента проявляют
сродство к неполярным группам
в молекуле субстрата.
Полярные функц. группы – со-
общают кислотно-основные свой-
ства.
Слайд 22Функции аминокислотных остатков, которые не входят в состав активного центра
Вспомогательные
аминокислоты. Расположены в непосредственной близости от активного центра и влияют
на конформацию этого центра.
2. Способствующие аминокислоты. Расположены сравнительно далеко от активного центра и способствуют формированию нативной конорма-ции всей молекулы фермента.
Слайд 23Механизмы ферментативного катализа
Кислотно-основной катализ.
В состав активного центра
входят аминокислотные остатки, содержащие функциональные группы, которые проявляют кислотно/основные свойства:
доноры/акцепторы Н+.
Молекула субстрата, связавшись в активном центре, индуцирует перераспределение плотности электронного облака групп активного центра. Это приводит к разрыву химических связей в молекуле субстрата и его превращение в продукт.
Кислотно/основные свойства особо выражены у минокислот:
цис, гис, тир, сер, лиз, глу.
Ферменты, для которых характерен этот механизм катализа:
Гидролазы (3 класс)
Изомеразы (5 класс)
Лиазы (4 класс)
Слайд 24Механизмы ферментативного катализа
2. Ковалентный катализ.
В активном центре
между молекулой субстрата (S) и каталитическими функциональными группами аминокислот образуется
ковалентная связь. В результате этого образуется промежуточный фермент-субстратный комплекс (ES).
Этот комплекс высокоактивен и неустойчив, он быстро распадается с освобождением продукта ферментативного катализа (P) и свободную молекулу фермента:
E + S ? ? ES ? ? E + P
Ферменты, для которых характерен этот механизм катализа:
трипсин
эластаза
ЩФ
Слайд 25Помимо вышеупомянутых механизмов ферментативного катализа, важная роль принадлежит следующим явлениям,
которые способствуют снижению энергии активации:
1. Эффект ориентации
реагентов и их сближение:
Молекулы субстрата, связавшись с контактными группами в активном центре, сближаются с каталитическими группами. Такое сближение способствует активации взаимодействия субстрата и активного центра.
2. Эффект деформации молекулы субстрата:
После связывания молекулы субстрата с активным центром, молекула субстрата приобретает «деформированную» или «напряженную» конформацию. В результате этого в молекуле субстрата увеличиваются межатомные расстояния, что существенно облегчает их разрыв и стимулирует образование продукта.
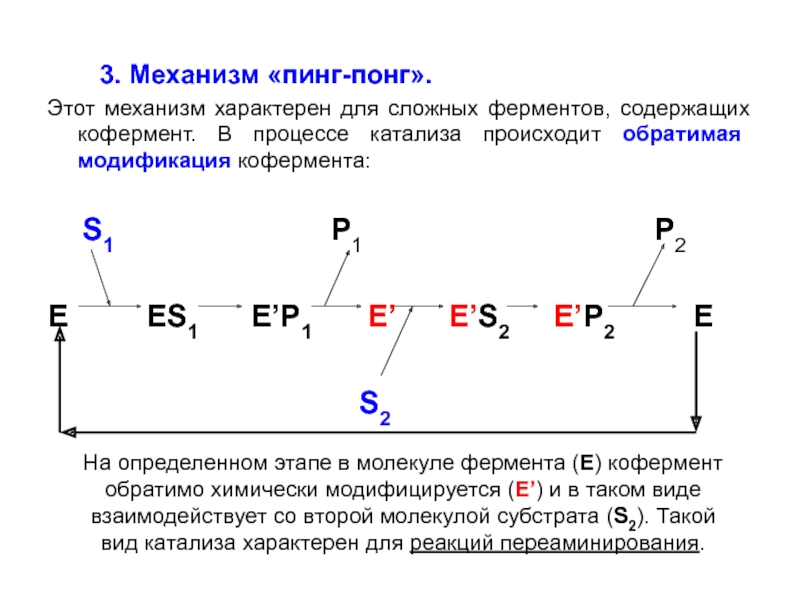
Слайд 26 3. Механизм «пинг-понг».
Этот механизм характерен для
сложных ферментов, содержащих кофермент. В процессе катализа происходит обратимая модификация
кофермента:
S1 P1 P2
E ES1 E’P1 E’ E’S2 E’P2 E
S2
На определенном этапе в молекуле фермента (Е) кофермент
обратимо химически модифицируется (E’) и в таком виде
взаимодействует со второй молекулой субстрата (S2). Такой
вид катализа характерен для реакций переаминирования.
Слайд 27Двухсубстратные-двухпродуктные ферментативные реакции
Такие ферментативные реакции - самый распространённый тип
биохимических реакций.
Почти все двухсубстратные-двухпродуктные реак-
ции представляют собой реакции
переноса группы R.
При этом R переносится от одной молекулы субстра-
та (X), к другой молекуле (Y):
E
XR + Y ?---? X + YR
Слайд 28 Двухсубстратные-двухпродуктные реакции протека-
ют с образованием двух видов промежуточных
комп-
лексов. Причина - субстраты связываются с фермен-
том в произвольном порядке.
Тройной
комплекс: E-XR-Y - содержит фермент (E) и оба субстрата (XR и Y);
Замещенная форма фермента: E-R.
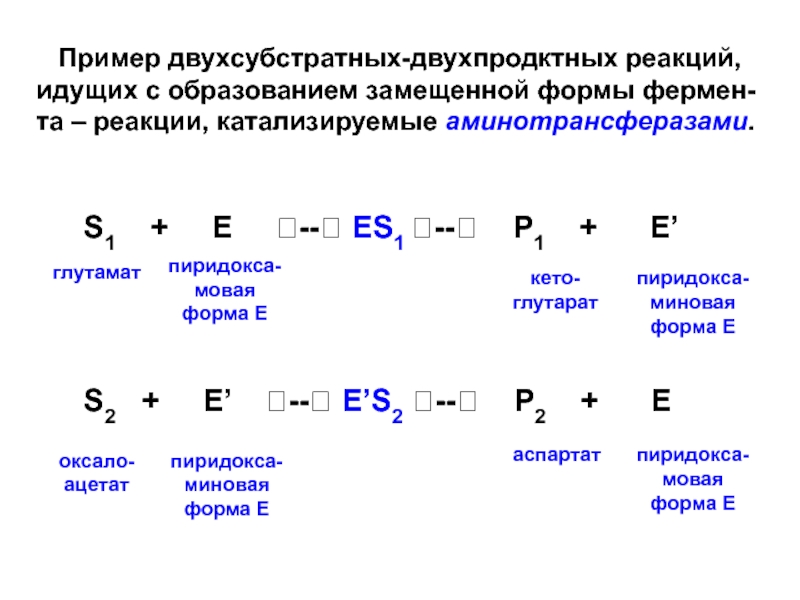
Слайд 29 Пример двухсубстратных-двухпродктных реакций, идущих с образованием замещенной формы
фермен-та – реакции, катализируемые аминотрансферазами.
S1 + E ?--? ES1 ?--? P1 + E’
S2 + E’ ?--? E’S2 ?--? P2 + E
глутамат
пиридокса-
мовая
форма Е
кето-
глутарат
пиридокса-
миновая
форма Е
оксало-
ацетат
пиридокса-
миновая
форма Е
аспартат
пиридокса-
мовая
форма Е
Слайд 30 Особенность двухсубстратных реакций – кинетика
может отклоняться от кинетики
Михаэлис-Ментен:
график зависимости V от [S] представляет не класси-
ческую параболическую кривую,
а принимает черты
сигмовидной (S-образной) кривой.
E ?? ES1 ?? ES1S2 ? E + P1 + P2
[S2] = consta, невариабельный субстрат;
S1 – его концентрация нарастает, начиная от малых значений
E
ES1
ES2
ES1S2
P1 + P2
1
2
3
4
путь 1 – 3 кинетически
предпочтителен
cродство E к S1 > S2
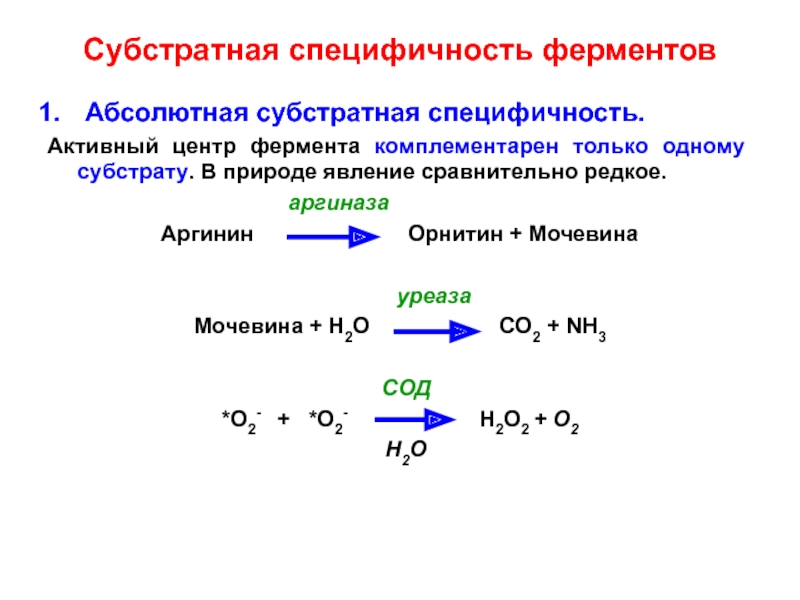
Слайд 31Субстратная специфичность ферментов
Абсолютная субстратная специфичность.
Активный центр фермента комплементарен только
одному субстрату. В природе явление сравнительно редкое.
аргиназа
Аргинин Орнитин + Мочевина
уреаза
Мочевина + Н2О СО2 + NH3
СОД
*О2- + *О2- Н2О2 + О2
Н2О
Слайд 322. Групповая субстратная специфичность.
Этот вид специфичности характерен для большей части
ферментов. Фермент катализирует однотипные реакции в группе структурно сходных субстратов.
панкреатическая липаза
ТАГ ------------------------------------? Моноацилглицерол + 2 СЖК
Протеазы – гидролиз пептидной связи:
O
II
- С-Х-N -
I
H
Слайд 333. Стереоспецифичность.
Субстрат может иметь несколько стереоизомеров, но фермент взаимодействует только
с каким-то одним определенным стереоизомером.
D- и L- сахара. Гексокиназа активна
только по отношению к D-глюкозе.
α- и β-гликозидные связи. Амилаза активна только по отношению к α-1,4-гликозидной связи (крахмал, гликоген), но не клетчатки.
D- и L- аминокислоты.
Цис / Транс – изомеры.
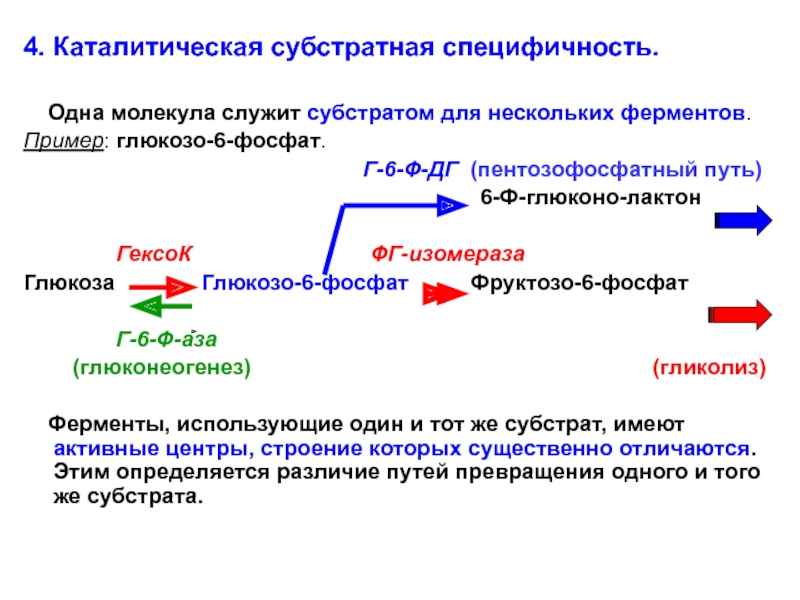
Слайд 344. Каталитическая субстратная специфичность.
Одна молекула служит субстратом для
нескольких ферментов.
Пример: глюкозо-6-фосфат.
Г-6-Ф-ДГ (пентозофосфатный путь)
6-Ф-глюконо-лактон
ГексоК ФГ-изомераза
Глюкоза Глюкозо-6-фосфат Фруктозо-6-фосфат
Г-6-Ф-аза
(глюконеогенез) (гликолиз)
Ферменты, использующие один и тот же субстрат, имеют активные центры, строение которых существенно отличаются. Этим определяется различие путей превращения одного и того же субстрата.
Слайд 35Гипотезы, объясняющие механизм субстратной специфичности ферментативного катализа
Гипотеза Э.Фишера «Ключ
– замок» (1890 г.)
Структура активного центра фермента – жесткая. Силуэт
активного центра - «слепок» силуэта молекулы субстрата. Молекула субстрата – «ключ», активный центр фермента – «замок». Гипотеза может объяснить только феномен абсолютной субстратной специфичности ферментативного катализа.
Слайд 36 2. Гипотеза Кошланда «Вынужденное соответ-ствие»
Структура активного
центра не жесткая (способна деформи-роваться). Когда молекула субстрата присоединяется к
активному центру фермента, то он деформируется.
Происходит «подстраивание» конформации активного центра под силуэт молекулы субстрата. Субстрат «вынужда-ет» активный центр менять свою конформацию для того, чтобы «соответствовать» структуре субстрата.
Таким образом, «замок» (активный центр) меняет свою кон-формацию, сообразно форме «ключа» (молекулы субстрата).
Слайд 37В зависимости от рН среды, различные функциональные группы аминокислот фермента
будут ионизированы в разной степени.
Пути влияния на каталитические свойства фермента:
изменение ионизации функц. групп аминокислот в активном
центре, ответственных за катализ.
изменение ионизации функц. групп аминокислот в активном
центре, ответственных за связывание молекулы субстрата.
изменение конформации части или большей части молекулы
фермента.
Влияние на сродство субстрата к ферменту:
изменение ионизации молекулы субстрата
Зависимость V ферментативной реакции от рН
Слайд 38Зависимость V ферментативной реакции от рН
А
B
C
рН-оптимум фермента
лежит вблизи рI.
«Колоколообразная
кривая»
Активность
фермента
максимальна, когда
молекула имеет +q
Активность фермента
максимальна, когда
молекула
имеет -q
Слайд 39Зависимость V ферментативной реакции от рН
Для работы подавляющего большинства ферментов
существует рН-оптимум. Даже незначительные отклонения от него в любую сторону
– приводит к существенному снижению V реакции.
Исключение составляет фермент инвертаза:
инвертаза
Сахароза -----------------? Глюкоза + Фруктоза
V ферментативной реакции не зависит от рН в диапазоне 3,0 – 7,5
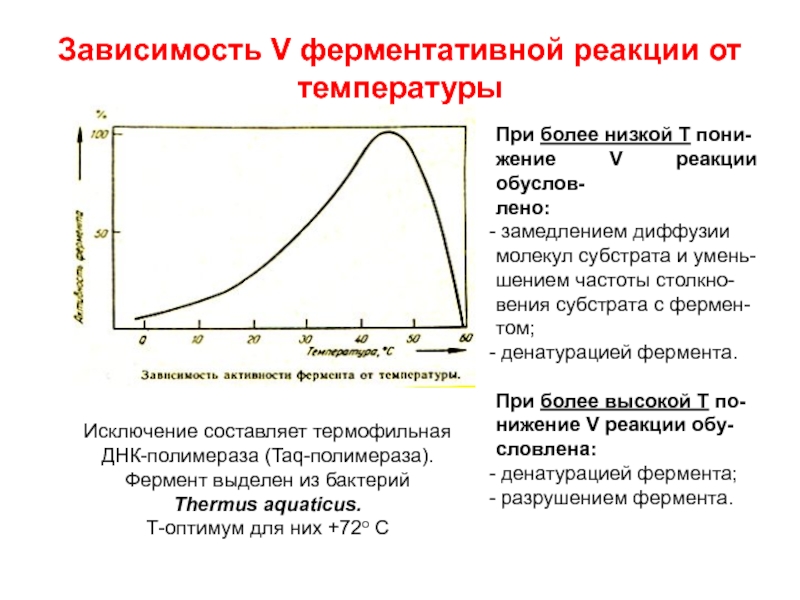
Слайд 40Зависимость V ферментативной реакции от температуры
При более низкой Т пони-
жение
V реакции обуслов-
лено:
замедлением диффузии
молекул субстрата и умень-
шением частоты столкно-
вения
субстрата с фермен-
том;
денатурацией фермента.
При более высокой Т по-
нижение V реакции обу-
словлена:
денатурацией фермента;
разрушением фермента.
Исключение составляет термофильная
ДНК-полимераза (Taq-полимераза).
Фермент выделен из бактерий
Thermus aquaticus.
Т-оптимум для них +72о С
Слайд 41Энергетика биохимических реакций
Для протекания химической реакции требуется
выполнение, по меньшей мере, трех условий:
1. Реакция
должна быть термодинамически возможной: проис-ходить спонтанно (самопроизвольно). При этом энергия продукта (Р) будет меньше энергии субстрата (S). Изменение свободной энергии Гиббса имеет значение –ΔG, то есть химическое превра-щение идет с отдачей энергии (экзэргонический процесс) в форме химической работы: разрыв одних хим.связей и образование других хим. связей.
Свободная энергия Гиббса (ΔG) – часть общей энергии системы, которая доступна для выполнения работы.
2. Достаточная частота взаимостолкновений атомов и молекул.
3. Сталкивающиеся атомы и молекулы должны обладать повы-шенной кинетической энергией (энергия активации).
Слайд 42Энергетика биохимических реакций
Энергия активации (Еа) – дополнительное коли-
чество
кинетической энергии, которое необходимо
передать молекуле, чтобы она оказалась в переход-
ном
состоянии и получила возможность вступать в
химические реакции.
Переходное состояние обозначает максимальную
способность молекулы к химическому превращению.
Чем большая часть молекул в 1 моле вещества
находится в переходном состоянии, тем выше V хи-
мической реакции.
Слайд 43Энергетика биохимических реакций
Взаимодействующие молекулы должны преода-леть
энергетический барьер. Именно для этого им необходимо получить дополнительное количество
энергии = энергию активации (Еа).
Передать взаимодействующим молекулам допол-нительное количество кинетической энергии можно путем нагревания. Для биологических объектах нагревание свыше +40о С губительно.
В ходе эволюции сформировался механизм ускорения метаболических превращений с участием ферментов. Ферменты уменьшают величину энергии активации, при этом не повышая температуру, кото-рая способна разрушить биомолекулы.
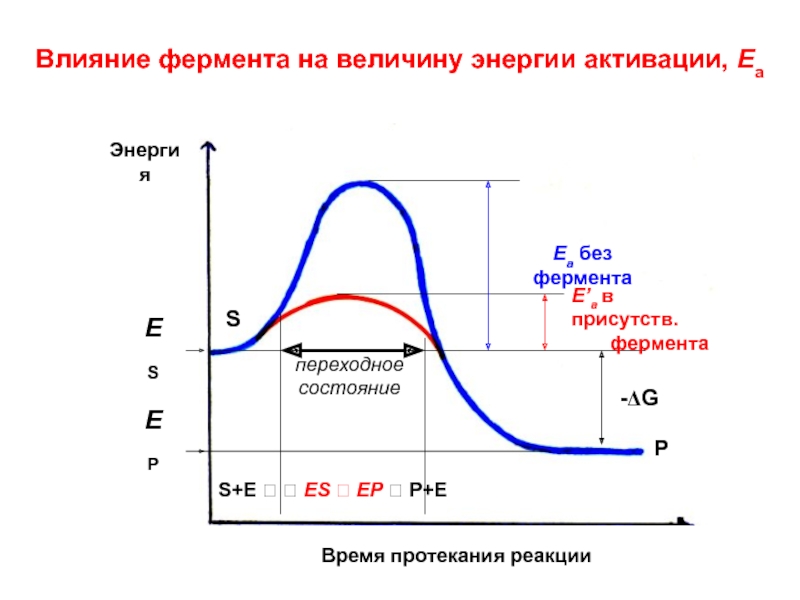
Слайд 44Влияние фермента на величину энергии активации, Еа
Время протекания реакции
Энергия
S+E ?
? ES ? EP ? P+E
переходное
состояние
ES
EP
S
P
Ea без фермента
E’a в присутств.
фермента
-ΔG
Слайд 45Переходное состояние и фермент- субстратный комплекс (ES)
S(субстрат) + Е(фермент) ??
ES ? EP ? E + P(продукт)
Время существования
ES совпадает с временем продолжи-тельности переходного состояния.
Образование ES – способ уменьшения Ea, в условиях, при которых нельзя повышать Т более +37о С.
Стадия образования «первичного» ЕS комплекса протекает сравнительно быстро (завист от [S]).
Стадия превращения «первичного» ЕS комплекса в «активированный» ES комплекс – лимитирующая. На этой стадии происходит превращение S?P.
Стадия диссоциации ЕР-комплекса: выход Р и освобожде-ние Е, протекает сравнительно быстро.
Слайд 46Зависимость V реакции от Т
Коэффициент Ван-Гоффа (Q10):
VT+10
Q10 =
VT
Коэффициент показывает: во сколько раз возрастет скорость хим. реакции при увеличении температуры на 10оС.
Для химических реакций Q10 = 2,0
Для ферментативных реакций, протекающих в организме, Q10 = 1,7
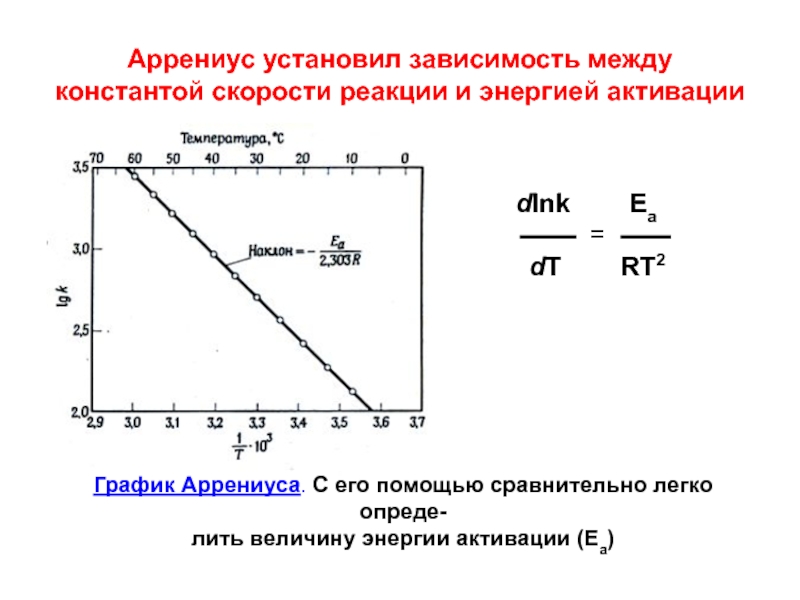
Слайд 47Аррениус установил зависимость между константой скорости реакции и энергией активации
dlnk Ea
=
dT
RT2
График Аррениуса. С его помощью сравнительно легко опреде-
лить величину энергии активации (Еа)
P
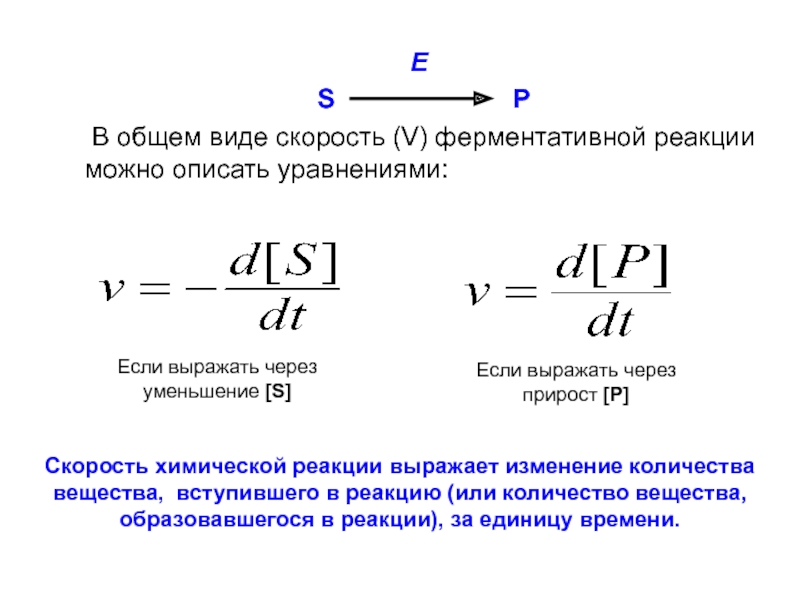
В общем
виде скорость (V) ферментативной реакции можно описать уравнениями:
Если выражать через
уменьшение [S]
Если выражать через
прирост [Р]
Скорость химической реакции выражает изменение количества
вещества, вступившего в реакцию (или количество вещества,
образовавшегося в реакции), за единицу времени.
Слайд 50Одна из характеристик ферментативной реакции:
Порядок реакции
Порядок реакции определяется
числом участников реакции, концентрации которых перемножаются в уравнении скорости реакции.
Реакция первого порядка:
k
А ? P
Если [A] обозначить a, то:
k – константа реакции первого порядка, размерность: с-1
V = ka = (моль * л-1) * с-1 = k * (моль * л-1), тогда:
k = V / a = (моль * л-1) * с-1 / моль * л-1 = с-1
Слайд 51 Константа скорости (био)химической реакции k чис-ленно равна скорости реакции при
концентрации
каждого из реагирующих веществ - 1 моль/л.
Константа
скорости (k) реакции зависит от темпера-туры, от природы реагирующих веществ, от катализа-тора, от рН и др. факторов, но не зависит от концентра-ции реагирующих веществ.
Иными словами, k – коэффициент пропорциональ-ности (поправочный коэффициент), позволяющий с максимальной точностью рассчитать скорость фер-ментативной реакции в данных конкретных условиях её протекания.
Слайд 52 Реакция второго порядка:
k
A + B ? P
k – константа реакции второго
порядка,
размерность: моль-1 x с-1
Частный случай: k
2A ? P
В случае, когда [B] >> [A], следует записать:
Это реакция второго порядка, но в силу избытка [B] уравнение выглядит как для реакции первого поряд-ка - псевдо унимолекулярная реакция.
Слайд 53В случае тримолекулярных реакций:
A + В + С ? P
Такие
реакции нельзя относить к реакциям третьего порядка. Они протекают в
две стадии:
A + B ? X
X + C ? P
Какая-то из двух реакций будет лимитирующей, то есть определять скорость всего процесса.
Реакции нулевого порядка:
Скорость таких реакций не зависит от концентрации субстрата:
V = const. = Vmax.
Ферментативные реакции, как правило, реакции нулевого порядка, поскольку протекают в присутствие избытка субстрата. Это позволяет ферменту обеспечивать максимально высокую скорость метаболических превращений.
Корректно определить активность фермента in vitro можно только в условиях проявления им максимальной скорости (разумный избыток субстрата).
Слайд 54Единицы активности фермента:
Международная единица (МЕ, Е, U):
Аактивность, при которой происходит
утилизация
1 микромоля S (или наработка 1 микромоля Р) в
мин.:
1 МЕ = мкмоль/мин (мкмоль * мин-1)
Активность фермента в системе СИ:
Активность, при которой происходит утилизация
1 моля S (или наработка 1 моля Р) в секунду:
1 катал (кат.) = моль * (л * с)-1
1МЕ = 16,67 х кат. 1 кат. = 6 х 107 х МЕ
Удельная активность фермента:
Активность фермента в любых единицах активности,
но приведенная к 1 мг белка, присутствующего в пробе.
Слайд 55Законы ферментативной кинетики. Первые попытки.
Первые попытки описания
законов ферментативной кинетики были сделаны Брауном и Анри (период 1892-1903гг.).
Эти работы не достигли цели. Не была осознана принципиальная важность измерения начальной скорости ферментативной реакции: в течение первых 3 - 4 минут от начала, что позволяло пренебрегать скоростью обратной реакции, которая оказывает все больший вклад на поздних стадиях реакции.
В итоге, уравнение, которое было предложено Анри, не позволяло удовлетворительно описать все эмпирически полученные данные.
Слайд 56 Исследоания Л. Михаэлис и М. Ментен
Leonor Michaelis
1875-1949
Maud Leonora Menten
1879-1960
Слайд 57В 1913 году Л. Михаэлис и М. Ментен вывели уравнение
кинетики ферментативной реакции (уравнение Михаэлис - Ментен)
Исходные положения теории Михаэлиса
и Ментен:
k1 k3
E + S ES EP E + P
k2
Первая стадия ферментативной реакции (с константами k1 и k2) – равновесный процесс, следовательно:
V образования комплекса ES = V диссоциации комплекса ES
Константа диссоциации комплекса ES (субстратная константа), КS = k2 / k1
Стадия реакции ES ? EP (с константой k3) определяет скорость процесса в целом.
Судьба комплекса ES принципиальна, поскольку V всего процесса будет
пропорциональна [ES].
Слайд 58V образования комплекса ES = k1[E][S]
V диссоциации комплекса ES =
k2+k3 [ES]
k1[E][S] = k2+k3 [ES] отсюда:
[E][S]
[ES] =
(k2+k3) / k1
k2+k3
= KM - константа Михаэлиса, размерность:
k1 моль* л-1
Михаэлис – Ментен:
[S]
v = Vmax.
[S] + Km
Реакция первого порядка
Реакция смешанного порядка
Реакция нулевого порядка
=
Vmax
0,5 Vmax
Слайд 60
V
[S]
- Свободный фермент, Е
Фермент-субстратный
комплекс, ES
Доля молекул фермента,
образовавших фермент-субстратный комплекс
Слайд 61 Из графика, построенного на основе уравнения
Михаэлис
– Ментен, следует:
Eсли [S] << Km , то наблюдаемая скорость (v) будет прямо пропорциональна [S]. Уравнение примет вид:
[S]
V = Vmax поскольку [S] + Km = Km
Km
Если [S] >> Km, то наблюдаемая скорость v = Vmax. Уравнение примет вид:
V = Vmax поскольку [S]/[S] = 1, а величиной Km можно
пренебречь.
Слайд 62При достижении определенной [S], скорость ферментативной реакции перестает зависить от
[S] – достигается состояние «насыщения». При этом все молекулы Е
входят в состав комплекса ES.
Km нельзя путать с Ks (константой диссоциации комплек-
са ES или субстратной константой).
k1 k2
E + S ?? ES тогда: Ks =
k2 k1
Только в случае, когда k2 >> k3, Km = Ks
Слайд 63
Практика показала, что in vitro даже при [S]
= 10Km,
наблюдаемая скорость реакции может составлять
0,92 от максимальной. Это затрудняет
точное опреде-
ление величины Vmax и Кm с помощью графика
Михаэлис – Ментен.
График Михаэлис – Ментен имеет вид параболической кривой
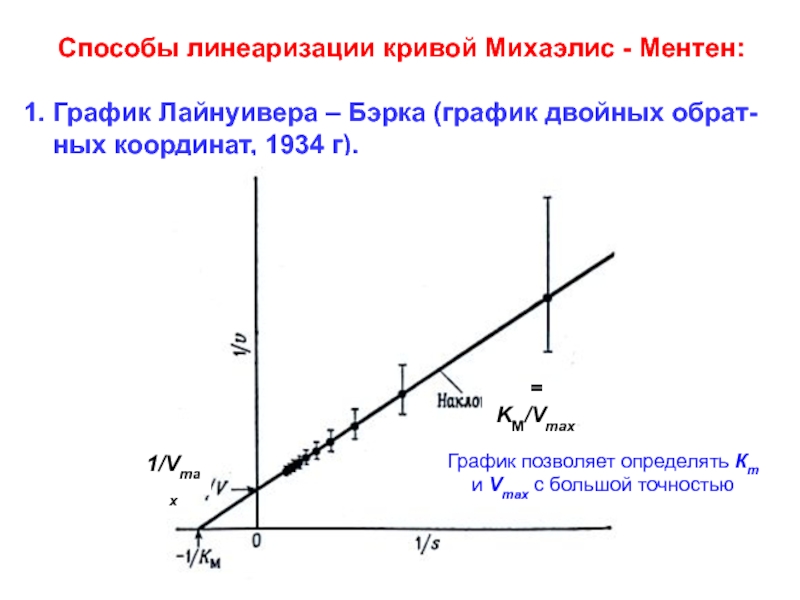
Слайд 64 Способы линеаризации кривой Михаэлис - Ментен:
1. График
Лайнуивера – Бэрка (график двойных обрат-
ных координат, 1934
г).
1/Vmax
= KM/Vmax
График позволяет определять Кm
и Vmax с большой точностью
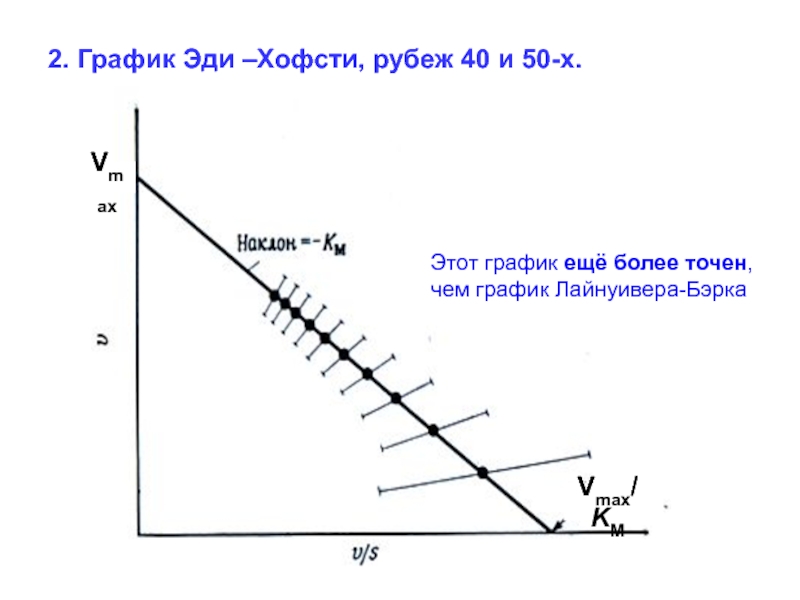
Слайд 652. График Эди –Хофсти, рубеж 40 и 50-х.
Vmax
Vmax/KM
Этот график
ещё более точен,
чем график Лайнуивера-Бэрка
Слайд 663. График Эйзенталя и Корниш-Боудена, 1974 г.
Vmax
v10
-S10
S
V
Слайд 67Для чего необходимо знать величины
Km и Vmax
Km
Зависит от То; если фермент проявляет относительную субстратную специфичность, для
каждого субстрата существует свое значение Кm.
Не зависит от концентрации фермента.
Знание Кm, позволяет корректно оценить активность фермента (определить Vmax, дефицит субстрата не позволит ошибочно занизить активность).
Кm – мера сродства субстрата к ферменту, мера прочности связывания субстрата с активным центром фермента. Чем выше сродство, тем меньше величина Кm.
Слайд 68 Vmax
Зависит от концентрации фермента: чем больше фер-
мента,
тем выше скорость.
Vmax – отражает важную характеристику фермента:
число оборотов фермента.
Число оборотов фермента – количество молекул преобразованного субстрата на 1 молекулу фермен-та за единицу времени (при условии насыщения фермента субстратом).
Большинство ферментов имею число оборотов около 1 х 104 с-1.
Абсолютный рекорд принадлежит карбоангидразе:
6 х 105 с-1
Слайд 69Регуляция
неаллостерических
ферментов
Неаллостерические ферменты активируются с
участием кофакторов
и коферментов, а снижают активность под влиянием различных ингибиторов.
Слайд 70ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
Ингибирование Инактивация
Ингибитор –
соединение, специфи-чески снижающее активность Е, путём прямого или косвенного влияния
на его активный центр.
Под влиянием ингибитора активность Е может существенно уменьшаться, но никогда не становится равно нулю.
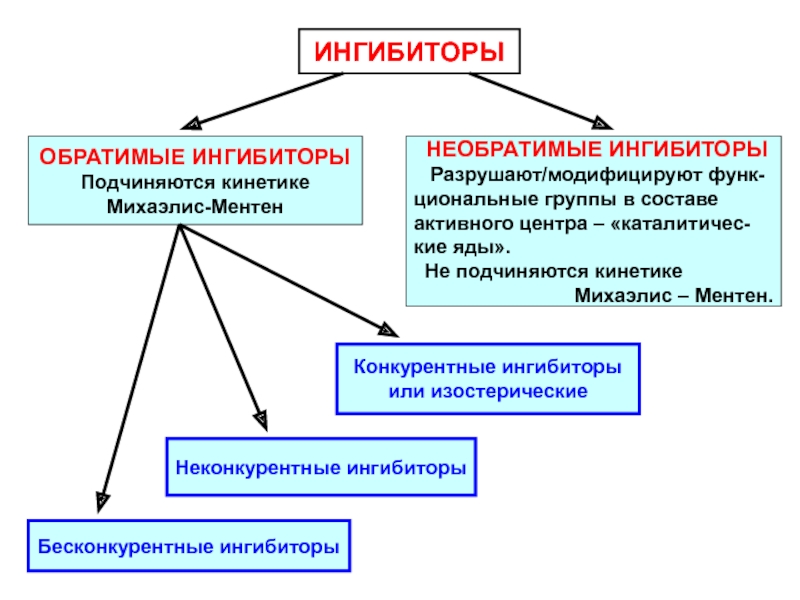
Слайд 71ИНГИБИТОРЫ
НЕОБРАТИМЫЕ ИНГИБИТОРЫ
Разрушают/модифицируют функ-
циональные группы в составе
активного
центра – «каталитичес-
кие яды».
Не подчиняются кинетике
Михаэлис – Ментен.
ОБРАТИМЫЕ ИНГИБИТОРЫ
Подчиняются кинетике
Михаэлис-Ментен
Бесконкурентные ингибиторы
Неконкурентные ингибиторы
Конкурентные ингибиторы
или изостерические
Слайд 72 Инактиваторы – комплекс химических, биологических, физических
факторов, которые способны деструктурировать молекулу фермента. Под влиянием инактиваторов активность
фермента становится равна нулю.
Экстремальные температуры
жёсткое УФ излучение
УЗ высокой мощности
Экстремальные рН
Протеолитические ферменты
Ионизирующая радиация
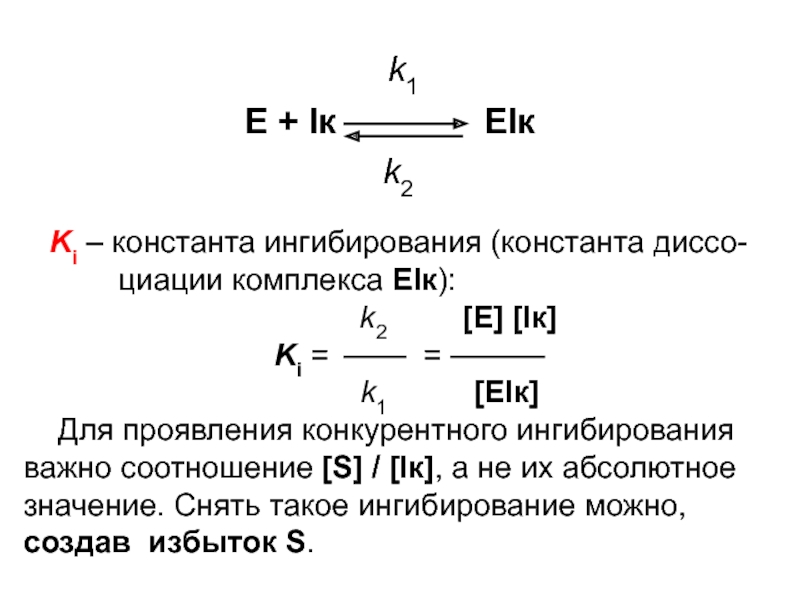
Слайд 73Конкурентные (изостерические) ингибиторы, Iк
Связываются с активным центром фермента, конкурируя за
активный центр с субстратом (S), вследствие высокого структурного сход-ства Iк
с S.
Такой вид ингибирования широко распространен.
Связывание происходит только со свободной формой фермента:
E + Iк ?? EIк (комплекс фермент-ингибитор, непро-дуктивный)
Если комплекс ES уже сформировался, то Iк присоединиться к Е не может.
+ Iк EIк
k2
Ki – константа ингибирования (константа диссо-
циации комплекса EIк):
k2 [E] [Iк]
Ki = =
k1 [EIк]
Для проявления конкурентного ингибирования
важно соотношение [S] / [Iк], а не их абсолютное
значение. Снять такое ингибирование можно,
создав избыток S.
Слайд 75 Физический смысл константы ингибирования Ki:
это концентрация конкурентного
ингибитора, при которой он связывается с половиной активных цент-ров присутствующих
ферментов, вызывая 50%-тормо-жение скорости ферментативной реакции.
Размерность Ki – моль/л
Чем выше концентрация конкурентного ингибитора (при неизменной концентрации субстрата), тем в большей мере проявляется его эффект, поскольку отношение [ I ]:[S] рас-тёт. По мере увеличения [ I ] значение Ki будет уменьшать-ся.
При каждой концентрации ингибитора, он занимает часть активных центров. Для субстрата остается всё меньше свободных центров. Таким образом, для того, чтобы вызвать 50%-ингибирование остав-шихся «работающих» центров, понадобится добавить меньшее коли-чество ингибитора (его концентрация также будет меньше).
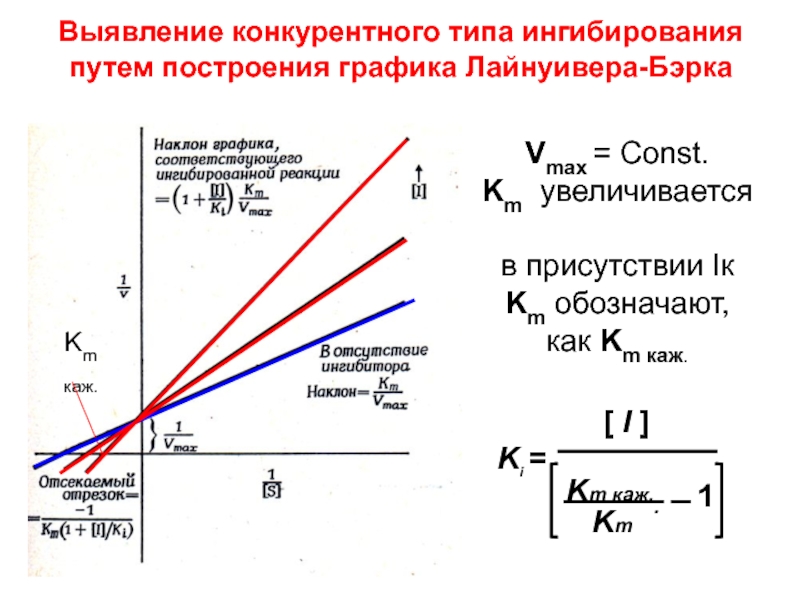
Слайд 76Выявление конкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
Vmax = Const.
Km
увеличивается
в присутствии Iк
Km обозначают,
как Km каж.
Km каж.
[ I ]
Ki =
Km каж..
Km
1
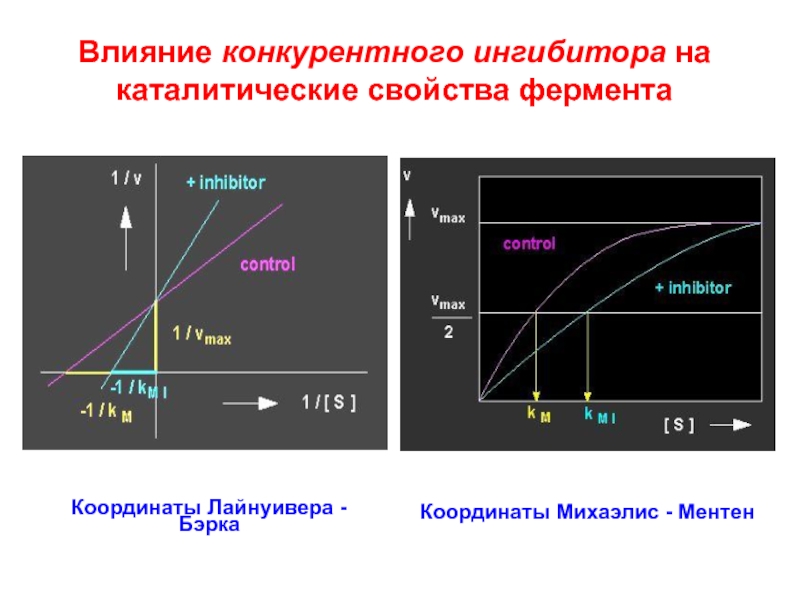
Слайд 77Влияние конкурентного ингибитора на каталитические свойства фермента
Координаты Лайнуивера - Бэрка
Координаты
Михаэлис - Ментен
Слайд 78Неконкурентные ингибиторы, Iнк
Связываются не с активным центром фермента, а с
другим участком молекулы фермента (за пределами активного центра).
Опосредованно меняется конформация
активно-го центра и скорость реакции уменьшается.
E + S + Iнк ?? ESIнк (тройной комплекс,
непродуктивный)
Iнк не влияет на связывание S c E.
Слайд 79 Iнк не уменьшает доли Е, связавшегося с S,
но снижает число оборотов фермента.
Этот вид ингибирования невозможно снять избытком
S. Но Iнк можно отмыть от E, поскольку ингибитор связывается с Е обратимо.
Примеры неконкурентных ингибиторов:
ЭДТА
окислители SH-групп
редокс переходы Ме с переменной валентностью
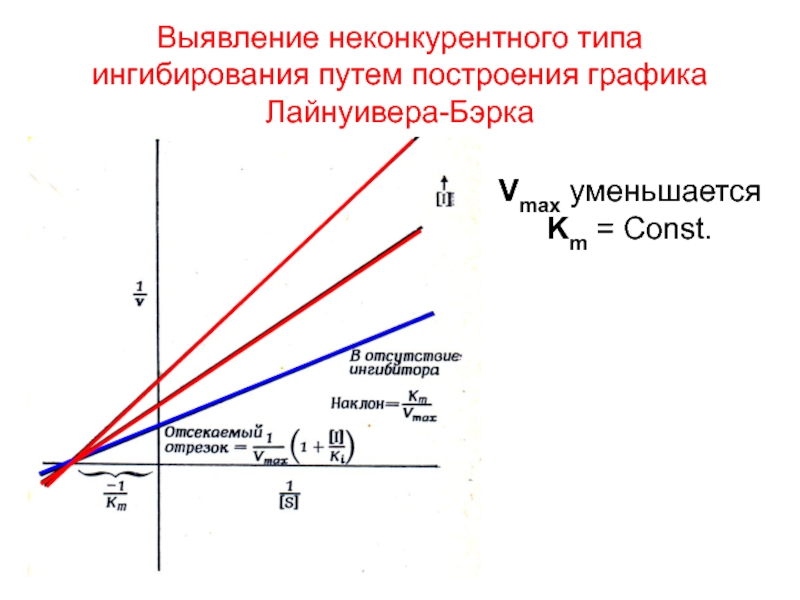
Слайд 80Выявление неконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
Vmax уменьшается
Km =
Const.
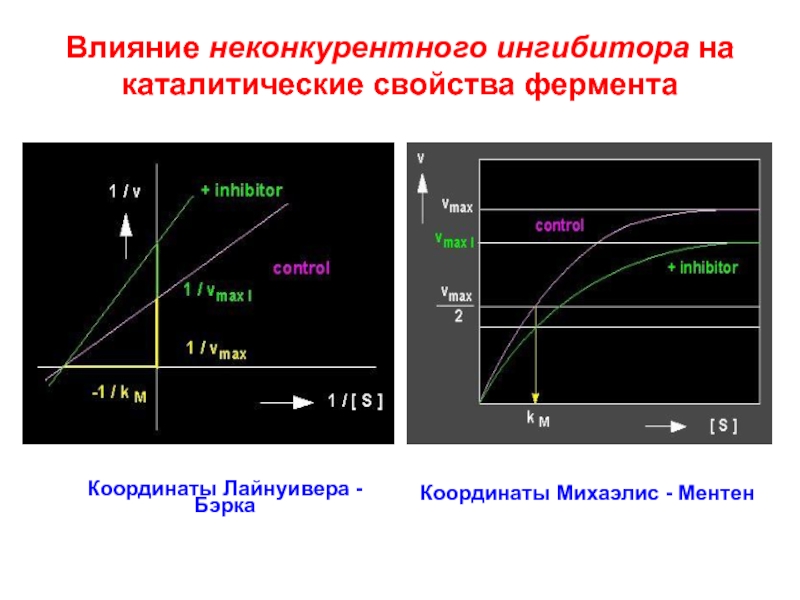
Слайд 81Влияние неконкурентного ингибитора на каталитические свойства фермента
Координаты Лайнуивера - Бэрка
Координаты
Михаэлис - Ментен
Слайд 82Выявление смешанного типа ингибирования путем построения графика Лайнуивера-Бэрка
1/ V
1/ S
[I]
-1/Km
Слайд 83Бесконкурентные ингибиторы, Iбк
Такой ингибитор присоединяется только к уже
существующему комплексу ES. В отсутствие S, ингибитор не взаимодейст-вует с
E.
Это означает, что участок для связывания Iбк в молекуле Е «открывается», (становится доступен для Iбк) только после образования комплекса ES.
Слайд 84Выявление бесконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка
1/ V
1/S
[I]
Значения Кm и Vmax
изменяются в одинаковой
степени.
Km V
= = Const.
V Km
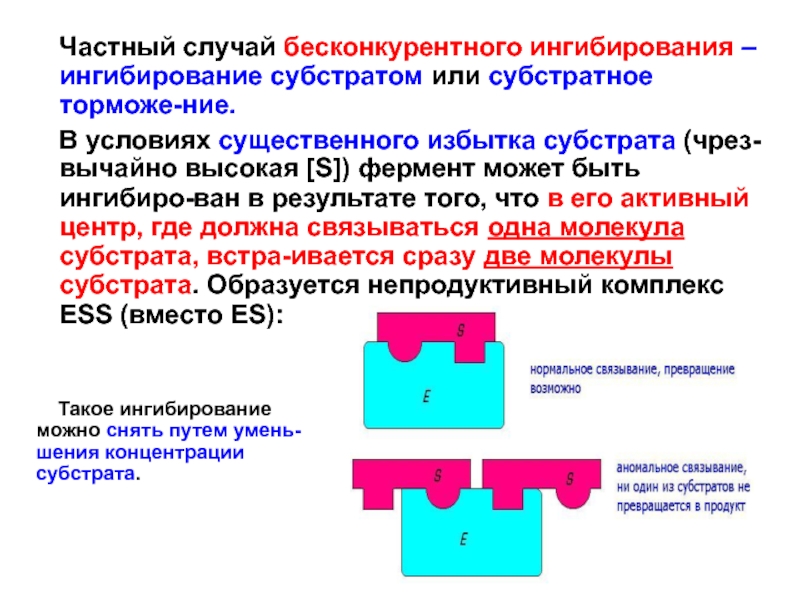
Слайд 85 Частный случай бесконкурентного ингибирования – ингибирование субстратом или
субстратное торможе-ние.
В условиях существенного избытка субстрата (чрез-вычайно высокая
[S]) фермент может быть ингибиро-ван в результате того, что в его активный центр, где должна связываться одна молекула субстрата, встра-ивается сразу две молекулы субстрата. Образуется непродуктивный комплекс ESS (вместо ES):
Такое ингибирование можно снять путем умень-шения концентрации субстрата.
Слайд 86Графические методы определения величины Ki
1/ V
1/ V
S/ V
[I]
[I]
[I]
-Ki
-Ki
-Ki
[S1][S2]
[S1]
зависимости от [I] при двух постоянных [S].
Конкурентное
Неконкурентное
Бесконкурентное
Метод Диксона
Метод Диксона
Метод Корниш-Боудена



















![Основы ферментативного катализа Особенность двухсубстратных реакций – кинетика может отклоняться от кинетики Михаэлис-Ментен:график Особенность двухсубстратных реакций – кинетика может отклоняться от кинетики Михаэлис-Ментен:график зависимости V от [S] представляет не](/img/thumbs/7ea348b249aa58fddd45d664b336f526-800x.jpg)





















![Основы ферментативного катализа V образования комплекса ES = k1[E][S]V диссоциации комплекса ES = k2+k3 V образования комплекса ES = k1[E][S]V диссоциации комплекса ES = k2+k3 [ES] k1[E][S] = k2+k3 [ES] отсюда:](/img/thumbs/3574b0ff7c177d155fb547d52b32d0ba-800x.jpg)

![Основы ферментативного катализа V[S] - Свободный фермент, Е Фермент-субстратный комплекс, ESДоля молекул фермента, образовавших фермент-субстратный комплекс V[S] - Свободный фермент, Е Фермент-субстратный комплекс, ESДоля молекул фермента, образовавших фермент-субстратный комплекс](/img/thumbs/7bb52dba92ff05407163a5a7408dd2a5-800x.jpg)

![Основы ферментативного катализа При достижении определенной [S], скорость ферментативной реакции перестает зависить от [S] При достижении определенной [S], скорость ферментативной реакции перестает зависить от [S] – достигается состояние «насыщения». При этом](/img/thumbs/aa45c89c9f6d799492d5b92dba9d9ded-800x.jpg)
![Основы ферментативного катализа Практика показала, что in vitro даже при [S] = 10Km,наблюдаемая Практика показала, что in vitro даже при [S] = 10Km,наблюдаемая скорость реакции может составлять0,92 от](/img/thumbs/f8b5b6ffe4314d0439c54df6769e5bd3-800x.jpg)










![Основы ферментативного катализа Выявление смешанного типа ингибирования путем построения графика Лайнуивера-Бэрка1/ V1/ S[I]-1/Km Выявление смешанного типа ингибирования путем построения графика Лайнуивера-Бэрка1/ V1/ S[I]-1/Km](/img/thumbs/395c4c99c70c7dda5b8da84216d284e7-800x.jpg)

![Основы ферментативного катализа Выявление бесконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка1/ V1/S[I] Значения Выявление бесконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка1/ V1/S[I] Значения Кm и Vmaxизменяются в](/img/thumbs/b523148ba5fdfeb2d2e6093c1f0bc362-800x.jpg)
![Основы ферментативного катализа Графические методы определения величины Ki1/ V1/ VS/ V[I][I][I]-Ki-Ki-Ki[S1][S2][S1] Графические методы определения величины Ki1/ V1/ VS/ V[I][I][I]-Ki-Ki-Ki[S1][S2][S1]](/img/thumbs/3e2421b8b4b45e1327ea3cc5ec59e9a1-800x.jpg)



















