Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы химической термодинамики и термохимии Лекция 5
Содержание
- 1. Основы химической термодинамики и термохимии Лекция 5
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХимическая термодинамика изучает взаимные переходы
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПервый закон термодинамикиЭнергия не исчезает
- 4. Интенсивные параметры – это параметры, которые не
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПервый закон ТД для закрытой
- 6. Современные формулировки ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИКоличество теплоты, полученное
- 7. Энтальпия – это термодинамическая функция, характеризующая энергетическое
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКоличество теплоты, которое выделяется или
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтандартные условия: n-количество вещества –
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример: Стандартная энтальпия сложного вещества
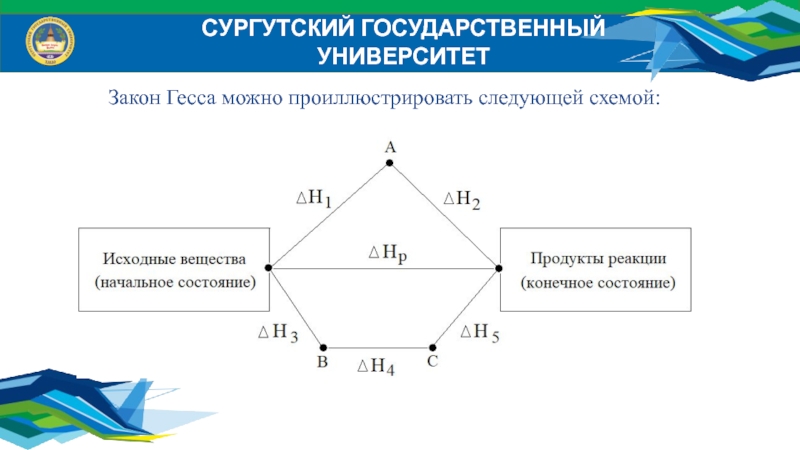
- 11. Закон Гесса (1840 г.)Тепловой эффект химической реакции
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗакон Гесса можно проиллюстрировать следующей схемой:
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСледствия из закона ГессаСледствие 1.
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример, рассчитаем энтальпию реакции получения мочевины в организмеиз аммиака и оксида углерода(IV):
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСледствие 2. Стандартная энтальпия химической
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗакон Лавуазье-Лапласа(является следствием закона сохранения
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСамопроизвольным (спонтанным) является процесс, который
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИзменение стандартной энтропии химической реакции
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТΔG = ΔH - TΔSстандартные
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТФормулировки второго закона термодинамики Формулировка
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТгде a, b, c, d
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТгде a, b, c, d
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИзохорный процессФункция Гельмгольца:Если процесс протекает
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКалориметрия(лат. Color – тепло и
- 27. Спасибо за внимание!Вопросы?СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химическая термодинамика изучает взаимные переходы различных видов энергии
Слайд 3СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Первый закон термодинамики
Энергия не исчезает и не возникает
из ничего, а только превращается из
одного вида в другой
в строго эквивалентных соотношениях.Слайд 4Интенсивные параметры – это параметры, которые не зависят от массы
и размеров системы.
Это температура, плотность, мольная доля, магнитная индукция,
давление и т.п.Экстенсивные параметры обладают свойством аддитивности (слагаимости), то есть зависящие от массы или числа частиц системы.
К экстенсивным параметрам относятся объем, масса, энергия, теплоемкость, энтальпия, энтропия.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 5СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Первый закон ТД для закрытой системы:
В изобарно-изотермических условиях,
в которых функционируют живые организмы, совершаемая работа определяется изменением объема:
Тогда
Сумма внутренней энергии системы и произведения объема на давление называют энтальпией (Н).
Слайд 6Современные формулировки
ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
Количество теплоты, полученное системой, идет на
изменение ее внутренней энергии и совершение работы против внешних сил.
Теплота,
сообщенная системе извне, расходуется на увеличение внутренней энергии и на работу, совершаемую системой.Изменение внутренней энергии изолированной системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними телами.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 7Энтальпия – это термодинамическая функция, характеризующая энергетическое состояние системы при
изобарно-изотермических условиях.
Теплота, полученная системой при Р,Т=const, равна приращению энтальпии системы:
СУРГУТСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСлайд 8СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Количество теплоты, которое выделяется или поглощается при проведении
химических реакций в изобарно-изотермических условиях, характеризуется изменением энтальпии системы и
называется энтальпией реакции ΔНР.Химические реакции и физико-химические процессы подразделяются на экзотермические и эндотермические:
Экзотермические процессы сопровождаются выделением энергии из системы в окружающую среду, т.е. .
Эндотермические процессы сопровождаются поглощением энергии системой из окружающей среды , т.е.
Слайд 9СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Стандартные условия:
n-количество вещества – 1 моль;
P-давление –
760 мм рт.ст.=101325 Па;
T-температура – 25°C = 298 К
Энтальпию
химической реакции при стандартных условиях обозначают:Например:
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Слайд 10СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Например:
Стандартная энтальпия сложного вещества равна энтальпии реакции
получения 1 моль этого вещества из простых веществ при стандартных
условиях.Например: стандартная энтальпия образования этанола равна стандартной энтальпии гипотетической реакции:
H2(г) = 2H; ΔH° = +436 кДж
ΔH°(H(г)) = +436 кДж ÷ 2 моль = 218 кДж/моль
Слайд 11Закон Гесса (1840 г.)
Тепловой эффект химической реакции при постоянном объеме
или постоянном давлении не зависит от пути, по которому протекает
реакция, а определяется только состоянием реагентов и продуктов реакции.Практическое значение закона Гесса:
1. Позволяет, не прибегая к эксперименту, определить тепловой эффект реакции, при известных тепловых эффектах промежуточных стадий;
2. Позволяет определить тепловой эффект любого процесса.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 13СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Следствия из закона Гесса
Следствие 1. Стандартная энтальпия химической
реакции (тепловой эффект
химической реакции) равен разности стандартных энтальпий (теплот) обра-
зования
продуктов реакции и исходных реагентов с учетом стехиометрических коэффициентов:Теплоты образования простых веществ считаются равными нулю.
Слайд 14СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Например, рассчитаем энтальпию реакции получения мочевины в организме
из
аммиака и оксида углерода(IV):
Слайд 15СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Следствие 2. Стандартная энтальпия химической реакции (тепловой
эффект химической
реакции) равна разности стандартных энтальпий
(теплот) сгорания исходных веществ и
продуктов реакции (с учетом стехиометрических коэффициентов:
Данное следствие используется для расчета тепловых эффектов
органических реакций.
Слайд 16СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Закон Лавуазье-Лапласа
(является следствием закона сохранения энергии)
Тепловой эффект прямой
реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
Это
означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества.Например: горение водорода в кислороде
Разложение воды электрическим током:
Слайд 17СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
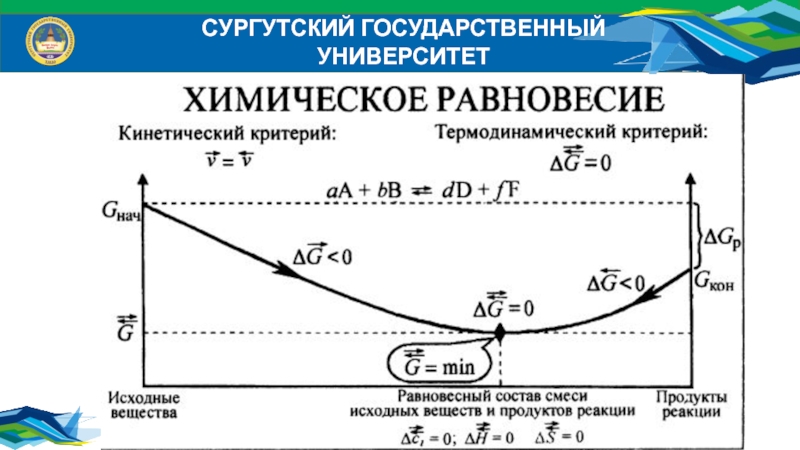
Самопроизвольным (спонтанным) является процесс, который совершается без затраты
работы извне и который уменьшает работоспособность системы после своего завершения.
Существует экстенсивная функция состояния термодинамической системы, называется энтропией (S).
Слайд 18СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Изменение стандартной энтропии химической реакции определяется разностью алгебраических
сумм стандартных энтропий продуктов реакции и исходных веществ с учетом
соответствующих стехиометрических коэффициентов:Слайд 19СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ΔG = ΔH - TΔS
стандартные энергии Гиббса
исходных
веществ и продуктов реакции;
- стехиометрические коэффициенты в уравнении химической реакции.
Слайд 20СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Формулировки второго закона термодинамики
Формулировка Клаузиуса (1850 г):
теплота сама по себе не может перейти от более холодного
тела к более теплому, тогда как передача теплоты от теплого тела к холодному может быть единственным результатом процесса.Формулировка Томсона (1851 г): никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса.
Формулировка Оствальда: невозможно создание вечного двигателя второго рода, т.е. такой машины, которая производила бы работу только за счет поглощения теплоты из окружающей среды без передачи части теплоты холодильнику (невозможно всю внутреннюю энергию системы превратить в работу).
Формулировка Больцмана: изолированная система эволюционирует преимущественно в направлении большей термодинамической вероятности.
Слайд 22СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
где a, b, c, d – стехиометрические коэффициенты.
Тогда
энергия Гиббса химической реакции для газообразных веществ
при данной температуре:
Для газообразных веществ:
Слайд 23СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
где a, b, c, d – стехиометрические коэффициенты.
Тогда
энергия Гиббса химической реакции, для веществ находящихся
в растворе при
данной температуре: Для процесса, протекающего в растворе:
Слайд 24СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Изохорный процесс
Функция Гельмгольца:
Если процесс протекает в растворе, то
свободную энергию Гельмгольца
Можно определить по выражению:
где
.Слайд 26СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Калориметрия
(лат. Color – тепло и metro – измеряю)
– это сово-
купность методов измерения количества тепло-
ты, выделяющейся или поглощаемой
при протека-нии различных физических, химических или био-
логических процессов.