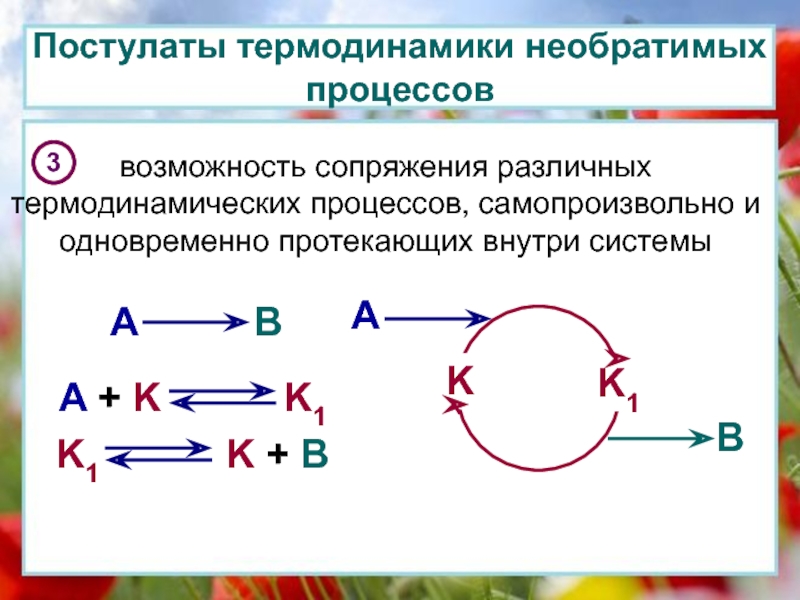
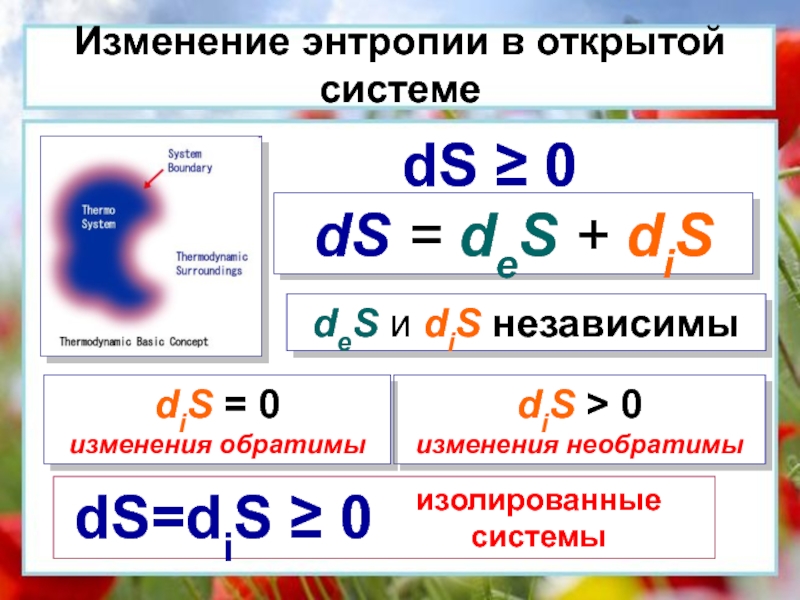
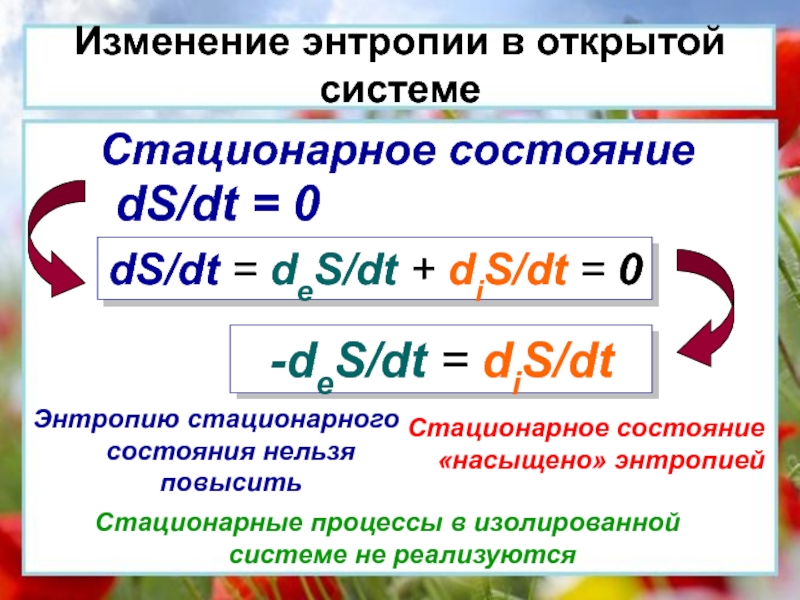
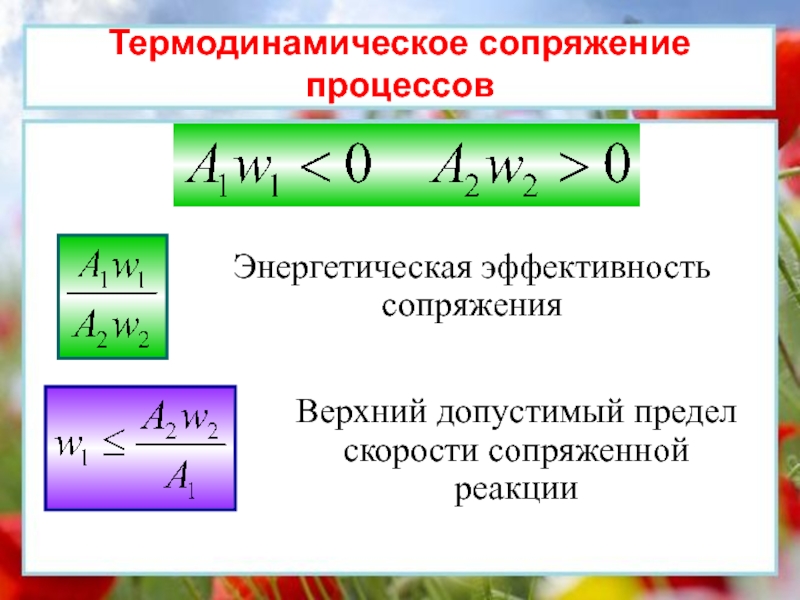
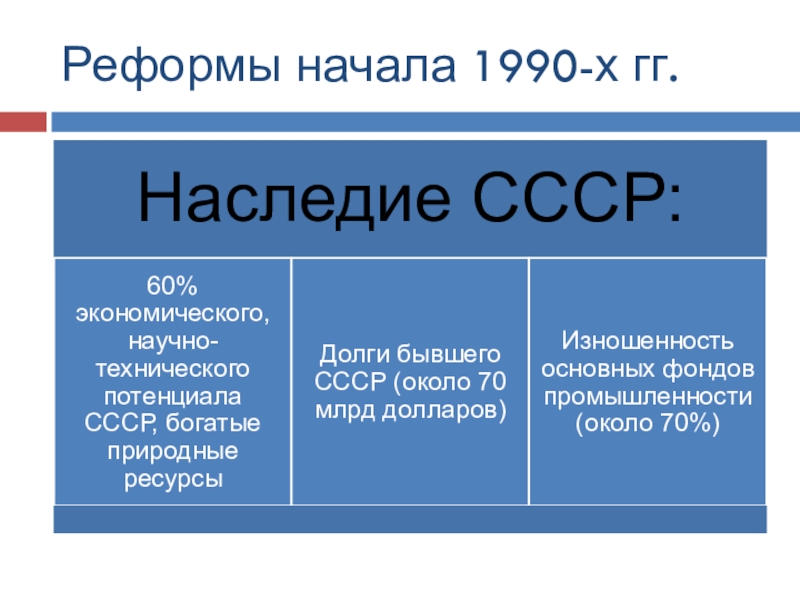
окружающей средой ни энергией, ни массой.
Закрытые системы - системы,
которые обмениваются с окружающей средой энергией, но не обмениваются массой. Открытые системы – системы, которые обмениваются с внешней средой и энергией, и массой.
Адиабатные (адиабатические) системы - системы, которые не обмениваются с окружающей средой энергией.
Термодинамические системы