Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Патология белкового и липидного обменов
Содержание
- 1. Патология белкового и липидного обменов
- 2. Цель : Изложить современные представления о причинах
- 3. Виды голодания По происхождению
- 4. Экзогенное голоданиеЭкзогенное голодание — это следствие полного
- 5. Эндогенное голоданиеИмеет место у тяжелых больных. Оно
- 6. Клинические периоды полного голоданиябезразличия;возбуждения, нарастающего по мере
- 7. Периоды развития экзогенного голоданиянеэкономного расходования энергии (2–4
- 8. Стрессорное голодание Это патологическое
- 9. Отличия механизмов адаптации при стрессорном голоданииПри неспецифической
- 10. Алиментарная дистрофия — это болезнь несостоявшейся компенсации
- 11. Клинические синдромы, в основе которых лежит
- 12. Клинические синдромы, в основе которых лежит алиментарная
- 13. Клинические синдромы, в основе которых лежит алиментарная
- 14. Гипералиментация
- 15. Доказано, что
- 16. Подагратиповая форма патологии пуринового обмена,характеризующаяся хроническим повышением
- 17. Проявления подагрыПостоянно повышенная концентрация мочевой кислоты в
- 18. Типовые нарушения липидного обмена
- 19. Типовые нарушения липидного обмена По критерию содержания
- 20. Нарушения всасывания жиров
- 21. Жировая инфильтрация и дистрофия Жировая инфильтрация →
- 22. Факторы, влияющие на обмен жира в
- 23. Ожирение - это
- 24. Критерии патологических сдвигов массы телаИндекс массы тела
- 25. Большую роль в генезе ожирения играет наследственный
- 26. Типы ожиренияАндроидный тип, чаще у мужчин, жир
- 27. В зависимости от механизма развития
- 28. Повреждение вентромедиального гипоталамуса ведет к развитию синдрома
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Нарушения эндокринной регуляции обмена веществ при ожиренииНаиболее
- 34. Нарушения эндокринной регуляции обмена веществ при ожиренииГиперинсулинемия
- 35. Гиперлипидемия и гиперлипопротеинемия — патологическое
- 36. Типы гиперлипидемийСемейная гиперлипидемия первого типа — врожденное
- 37. Типы гиперлипидемийГиперлипидемия третьего типа — это наследуемая
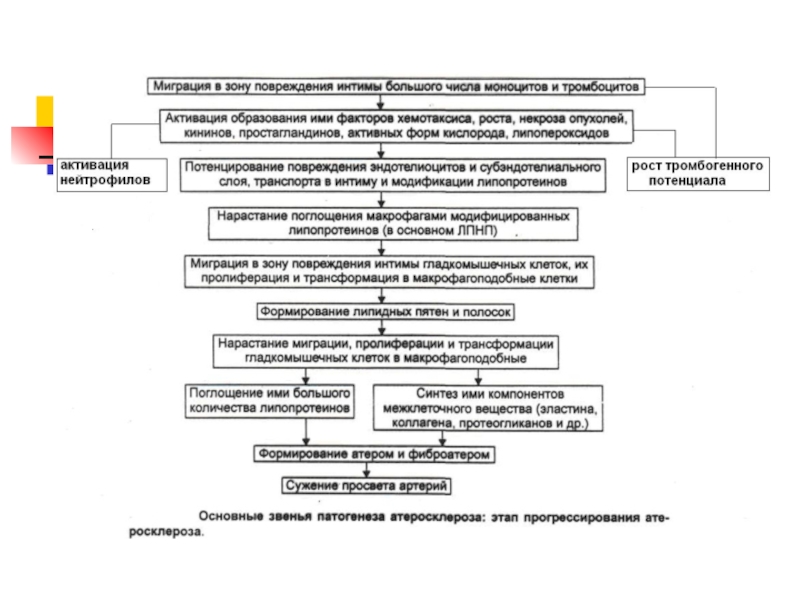
- 38. Атеросклероз — это отложение в интиме сосудов
- 39. В основе этиопатогенеза атеросклероза
- 40. Поверхность макрофагов содержит рецепторы к окисленным липопротеинам
- 41. Слайд 41
- 42. Атеросклеротические изменения в артерии, а —
- 43. Атеросклероз во многом представляет собой
- 44. Все больше данных, свидетельствующих о генетической обусловленности
- 45. Наследуемая недостаточность ЛПНП-рецепторов ведет к ↓ пиноцитоза
- 46. Гиперхолестеринемия алиментарного генеза также повышает риск атеросклероза
- 47. СПАСИБО ЗА ВНИМАНИЕ!
- 48. Скачать презентанцию
Цель : Изложить современные представления о причинах и механизмах основных проявлений нарушений липидного обмена, атеросклероза и ожирения. Содержание лекции:Голодание, виды голодания;Подагра, этиология,
Слайды и текст этой презентации
Слайд 1Патология белкового и липидного обменов Лекция для студентов 2-го курса Специальность «стоматология» Кафедра
патофизиологии КрасГМА
Слайд 2Цель : Изложить современные представления о причинах и механизмах основных
проявлений нарушений липидного обмена, атеросклероза и ожирения.
Содержание лекции:Голодание, виды голодания;
Подагра, этиология, патогенез;
Типовые нарушения липидного обмена;
Факторы, влияющие на обмен жира в жировой ткани;
Жировая инфильтрация и дистрофия;
Типы ожирения и его степени тяжести;
Патогенетические механизмы развития ожирения;
Типы гиперлипидемий;
Патогенез атеросклероза.
Слайд 3Виды голодания
По происхождению может быть физиологическим
и патологическим.
Физиологическое голодание периодически повторяется у некоторых
видов животных в связи с особыми условиями их обитания или развития (сурки, суслики и др.). Патологическое голодание: экзогенное и эндогенное голодание.Слайд 4Экзогенное голодание
Экзогенное голодание — это следствие полного отсутствия или недостаточного
потребления пищи или результат сниженного поступления в организм отдельных питательных
веществ, витаминов и микроэлементов. В этом случае говорят о частичном или качественном (белковом, углеводном, витаминном) экзогенном голодании.Абсолютное голодание — это экзогенное голодание при полном отсутствии пищи и воды.
Полное голодание — это голодание при отсутствии пищи, но с сохранением питья.
При неполном голодании питание недостаточно для удовлетворения потребностей организма в нутриентах.
Слайд 5Эндогенное голодание
Имеет место у тяжелых больных. Оно чаще всего обусловлено
одновременными нарушениями мембранного, полостного пищеварения, моторики кишечника и всасывания из
его просвета.Эндогенное голодание может быть следствием роста потребности в нутриентах из-за повышенной утилизации свободной энергии и потребления субстратов анаболизма. Рост же энергозатрат и усиление анаболизма являются метаболической основой реакций саногенеза, направленных на устойчивую компенсацию нарушений и выздоровление.
Ускоренным голоданием называют голодание в результате повышенного потребления нутриентов и низкой относительно потребления доставки нутриентов в клетки.
Слайд 6Клинические периоды полного голодания
безразличия;
возбуждения, нарастающего по мере усиления чувства голода;
угнетения (самый длительный);
параличей и гибели.
Ощущение
голода при полном голодании может исчезнуть через несколько дней после начала голодания, причем угнетение пищевого центра в дальнейшем может быть настолько глубоким, что для его возбуждения необходимы специальные мероприятия. При неполном голодании возбуждение пищевого центра все время поддерживается и чувство голода периодически возобновляется. Слайд 7Периоды развития экзогенного голодания
неэкономного расходования энергии (2–4 дня);
максимального приспособления (40–50
дней);
терминальный (3–5 дней).
Интенсивность падения
массы тела в эти периоды различна. Вначале она снижается значительно, во втором периоде темп снижения уменьшается и составляет ежедневно 0,5–1 % (зная исходную массу тела и ежедневную потерю, можно рассчитать возможную предельную продолжительность голодания). В терминальный период снижение массы вновь усиливается. Слайд 8Стрессорное голодание
Это патологическое состояние системного дефицита
массы и резервов энергии вследствие потерявшей биологический смысл и защитное
значение катаболической стрессорной реакции. Развивается быстро, несмотря на сохраненное поступление в клетку нутриентов из внешней среды, что обусловлено полным угнетением анаболизма.Превращение стресс-реакции в звено патогенеза происходит в соответствии с известным в физиологии принципом: защитные реакции в ответ на нарушения функций относительно самих нарушений выражены значительно сильнее, и поэтому сами часто приводят к дисфункциям, патологическим состояниям.
Слайд 9Отличия механизмов адаптации при стрессорном голодании
При неспецифической стрессорной реакции у
тяжелых больных через активацию всей вегетативной нервной системы усиливается как
секреция инсулина, так и выброс в кровь его антагонистов — катаболических гормонов. Биологический смысл реакции — увеличение массы нутриентов, доступных для биологического окисления и анаболических процессов в клетке. Инсулин обеспечивает транспорт в клетки нутриентов, поступающих во внутреннюю среду из внешней в количестве, недостаточном относительно высокой интенсивности биологического окисления и анаболизма.Итак, при адаптации к стрессорному и ускоренному голоданию секреция инсулина растет, а при физиологических процессах — падает.
При стрессорном и ускоренном голодании (в отличии от адаптации к экзогенному полному голоданию) нет адаптивной реакции снижения потребления свободной энергии, а наоборот, происходит увеличение потребления кислорода и выделения углекислого газа из организма.
Слайд 10
Алиментарная дистрофия — это болезнь несостоявшейся компенсации несоответствия между поступлением
нутриентов во внутреннюю среду из внешней и потребностью в них
организма.Основное звено патогенеза — это блокада вследствие системного гипоэргоза и недостатка субстратов белкового синтеза генома клеток, обеспечивающего синтез белковых носителей функций.
Слайд 11 Клинические синдромы, в основе которых лежит алиментарная дистрофия (1)
Квашиоркор — это алиментарная дистрофия у
детей вследствие качественного белкового голодания (несбалансированная алиментарная недостаточность белка). Заболевание впервые описано у африканских детей, которые после полноценного питания материнским молоком переходили на богатую углеводами, но бедную белком диету. В результате наступала задержка роста и умственного развития. Частый симптом квашиоркора — это сплено-гепатомегалия как реакция на бактеремию вследствие нарушений защитных функций энтероцитов и на дистрофию селезенки и печени. Поджелудочная железа подвергается гиалинозу и фиброзу, снижается образование пищеварительных ферментов, иногда развивается сахарный диабет. Дистрофические изменения распространяются на почки, сердце.О квашиоркоре («красный мальчик») свидетельствуют характерная сыпь и интенсивная десквамация эпидермиса (шелушение кожи), незаживающие язвы любой локализации на коже и видимых слизистых оболочках.
Слайд 12Клинические синдромы, в основе которых лежит алиментарная дистрофия (2)
Алиментарный маразм или алиментарная дистрофия (лат. marasmus
— истощение) — это сбалансированная белково-калорийная недостаточность у детей вследствие неполного голодания. Дети при белково-калорийной недостаточности отстают в росте и психическом развитии, у них обнаруживается депигментация волос, кожи, мышечное истощение, гепатомегалия, отеки, иммунодефицит, гипогликемия, гиперкортицизм.Отягощают развитие заболевания гиповитаминозы (А, Д, В). Это опасное следствие энтеритов и диспепсий раннего детского возраста.
Слайд 13Клинические синдромы, в основе которых лежит алиментарная дистрофия (3)
Anorexia nervosa (первичное угнетение чувства голода) —
алиментарная дистрофия как результат полного или неполного голодания, которое развивается в силу внутренних причин.В основе данной патологии лежит циркуляция возбуждения внутри гипоталамо-лимбико-ретикулярных структур, приводящая к формированию очагов «застойного» возбуждения при эмоциональном стрессе, захватывающих и вентромедиальное ядро гипоталамуса. Одно из следствий появления таких очагов возбуждения в вентромедиальном ядре гипоталамуса — повышенный уровень катаболизма и почти полное отсутствие аппетита. Это обусловливает ускоренное голодание вплоть до алиментарной дистрофии. Обычно страдают женщины в возрасте до 30 лет, находящиеся в состоянии эмоционального стресса.
Слайд 14Гипералиментация
Это парентеральное питание, при котором тяжелому больному в состоянии
гиподинамии внутривенно в организм вводят углеводы, аминокислоты и жиры в дозах, превышающих потребности здорового человека того же возраста, пола и с аналогичным ростом и нормальной массой тела в условиях относительного покоя.Общая доза нутриентов, вводимая с целью гипералиментации и измеряемая килокалориями, составляет обычно 40 ккал/кг. Доза белка находится в пределах 1–1,5 г/кг. Оставшуюся часть общей энергетической ценности, за вычетом белков, покрывают на 2/3 введением углеводов, плюс — адекватная доза витаминов и микроэлементов.
Энергетический эквивалент дозы глюкозы при парентеральном питании должен составлять 4 ккал/кг/мин. Утилизация глюкозы оптимальна при ее вливании со скоростью 4–5 мг/кг/мин.
Слайд 15
Доказано, что полное парентеральное питание
при устойчивом торможении анаболических процессов у больных в состоянии стрессорного
голодания вызывает ряд патологических сдвигов метаболизма и служит фактором приобретенного иммунодефицита.Слайд 16Подагра
типовая форма патологии пуринового обмена,
характеризующаяся хроническим повышением содержанием в крови
мочевой кислоты (N 176-476 мкмоль/л),
отложением избытка ее солей в органах,
тканях, суставах,уратной нефропатией, нефро- и уролитиазом.
Слайд 17Проявления подагры
Постоянно повышенная концентрация мочевой кислоты в плазме крови и
моче.
Воспаление различных суставов (чаще моноартриты).
Сильная боль в зоне накопления уратов
(может иметь характер длительных эпизодов: до 2-3 сут).Повторное появление тофусов.
Признаки почечной недостаточности.
Нефро- и уролитиаз, рецидивирующие пиелонефриты.
Изменения в почках завершаются нефросклерозом, почечной недостаточностью, уремией.
Слайд 18Типовые нарушения липидного обмена
По этиологии:
Первичные:
Моногенные (напр. дефицит липопротеинлипазы);
Полигенные (сахарный диабет, алкоголизм).
Вторичные:
1. Алиментарные (жир в сутки →70 г)
2. Эндогенные:
Нарушения переваривания и всасывания липидов (при ахолии, панкреатической ахилии, мальабсорбции);
Увеличение перемещения жира из депо в печень – «транспортная форма» (при голодании, гиперкортицизме, сахарном диабете, гипертиреозе).
Задержка липидов в крови – «ретенционная форма» (при нефротическом синдроме, холемии → блок липопротеинлипазы).
Слайд 19Типовые нарушения липидного обмена
По критерию содержания липопротеинов в крови:
Гиперлипидемии
(↑ общее содержание липидов в плазме > 8 г/л);
Гиполипидемии (↓
общее сод. липидов в плазме < 4 г/л);Дислипопротеидемии (изменения соотношения между отдельными классами липопротеинов, появление их аномальных форм).
По характеру расстройств:
Ожирение (избыточное накопление липидов в жировой ткани,↑ массы тела);
Липидозы – избыточное накопление липидов в различных клетках, кроме адипоцитов.
Слайд 20Нарушения всасывания жиров
Причины:
Недостаток липазы, который возникает при заболеваниях поджелудочной железы, а также дефицит желчных кислот (обтурационная желтуха, цирроз) → содержание жира в кале резко ↑, наблюдается стеаторея.
Использование некоторых антибиотиков (неомицинового и тетрациклинового ряда), которые подавляют липолиз → стеаторея.
Избыток в пище кальция и магния → при этом образуются нерастворимые в воде соли жирных кислот (мыла), которые выводятся через кишечник.
Нарушение фосфорилирования (при отравлении ядами) и недостаточность коркового вещества надпочечников.
Поражение эпителия тонких кишок инфекционными и токсическими агентами.
Авитаминозы А и В.
Слайд 21Жировая инфильтрация и дистрофия
Жировая инфильтрация → накапливание липидов происходит
вне клеток жировой ткани.
Жировая дистрофия → сочетание инфильтрации с
нарушением структуры протоплазмы жировых клеток.Чаще всего жировая инфильтрация наблюдается в печени.
Причины:
↑ печеночный липогенез;
↓ процессов окисления жирных кислот;
↑ липолиз жировой ткани;
замедление выделения липопротеинов очень низкой и низкой плотности.
Продукция ЛПОНП в печени требует сочетания процессов липидного и белкового синтеза. Нарушение любого из этих процессов приводит к аккумуляции жира в печени.
Слайд 22 Факторы, влияющие на обмен жира в жировой ткани
Жировая ткань
характеризуется интенсивным метаболизмом, обильным кровоснабжением и является саморегулирующимся «энергетическим аккумулятором».
Накопление энергии в виде нейтральных жиров происходит в ней после каждого приема пищи, а мобилизация энергии — в любое время под влиянием импульсов, освобождающих жирные кислоты.
Липолиз активируется адреналином, кортикотропином и глюкагоном. Жиромобилизующим эффектом обладают СТГ,ТТГ и тироксин.
Роль ЦНС в регуляции жирового обмена → длительное эмоциональное напряжение (и активация симпатической НС) приводит к мобилизации жира из жировых депо и похуданию. Активация парасимпатических нервов, напротив, сопровождается усиленным отложением жира.
Если в течение длительного времени накопление жира в жировой ткани превышает расход энергии — развивается ожирение.
Слайд 23
Ожирение - это патологическое состояние ,
которое характеризует аномальное увеличение массы тела за счет избыточного отложения
жира в жировой ткани и является следствием расстройств гомеостаза энергетического обмена.Слайд 24Критерии патологических сдвигов массы тела
Индекс массы тела — отношение массы
тела к росту тела в квадрате. Нормальный показатель→ около 21
кг/м2 (18,5–24,9).Показатель Брока — рост в сантиметрах минус 100 → нормальный вес обследуемого в килограммах. Пользуются в пределах роста 155–165 см. При росте 165–175 вес умножают на 1,05, при росте 176–186 — на 1,1.
Степень ожирения → отношение должной к измеренной массе и умноженной на 100 %:
1-я степень —15–29 %; 2-я — 30–49 %; 3-я — 50–99 %; 4-я — 100 % и выше.
Слайд 25
Большую роль в генезе ожирения играет наследственный фактор.
Ожирение — это
не жестко детерминированный фенотипический признак. Доказано, что избыточное питание в
первые три месяца жизни через усиление дифференциации адипобластов до адипоцитов вызывает ожирение, от которого человек страдает на всех этапах онтогенеза.Рациональное питание и двигательный режим могут предотвратить реализацию наследственной предрасположенности к ожирению.
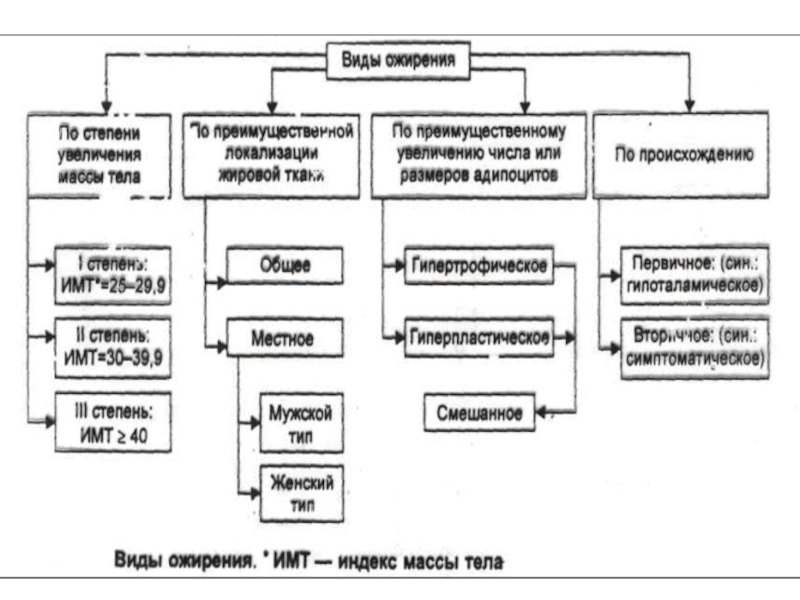
Слайд 26Типы ожирения
Андроидный тип, чаще у мужчин, жир аккумулируется в основном
в жировых клетках туловища (жировые подушки в области живота, в
подмышечной области и т.д.) и сальника. У женщин с андроидным типом ожирения существует прямая связь между массой тела и концентрацией андрогенов в крови. Показатель накопления жира в адипоцитах туловища и висцеральных жировых клетках → отношение длины окружности талии к длине окружности нижней конечности в области верхней трети бедра. При андроидном ожирении оно растет. Велика вероятность сахарного диабета, гиперлипидемии, АГ.При гиноидном ожирении (чаще свойственно женщинам) жир откладывается в нижней части живота и на бедрах. Риск атеросклероза меньше, чем при андроидном.
Висцеральное ожирение это фактор риска наиболее частых болезней человека. Мобилизация свободных жирных кислот при патогенном стрессе происходит в основном через липолиз в висцеральных адипоцитах. Это патогенно действует на печень. Возникают гипергликемия, дислипидемия и гиперинсулинемия.
Слайд 27
В зависимости от механизма развития ожирения на уровне
жировой ткани выделяют два вида:
Гиперплазический → за счет роста числа
адипоцитов;Гипртрофический → за счет увеличения размеров адипоцитов и содержания в них жира.
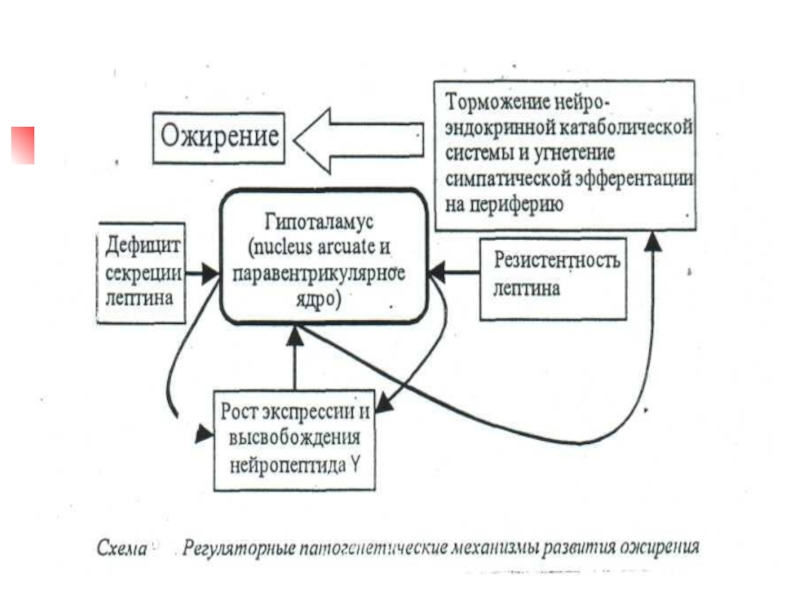
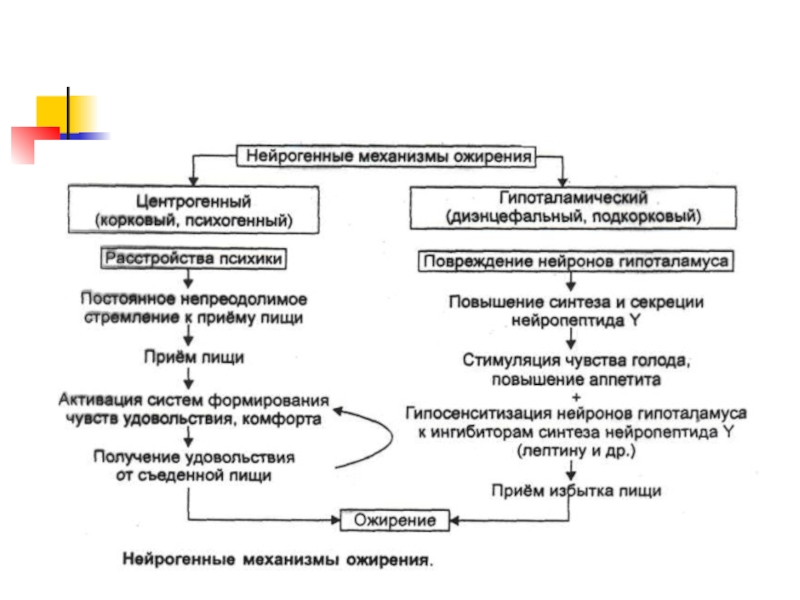
Слайд 28
Повреждение вентромедиального гипоталамуса ведет к развитию синдрома гипоталамического ожирения. Он
характеризуется: усиленным потреблением пищи, ростом секреции инсулина, снижением двигательной активности,
эмоциональной неустойчивостью.Ожирение может быть результатом расстройств нейроэндокринной регуляции. Установлено, что мутация гена ожирения обусловливает дефицит фактора анорексии, циркулирующего с кровью.
Этот ген кодирует полипептидный гормон, названный лептином. Он синтезируется в жировых клетках и секретируется в кровь. Лептин — это гуморальный переносчик обратной афферентации в системе удержания массы жира в организме на одном уровне.
Ожирение может быть следствием или дефицита экспрессии гена лептина, или резистентности лептина (недостаточной реакции клеток-мишеней).
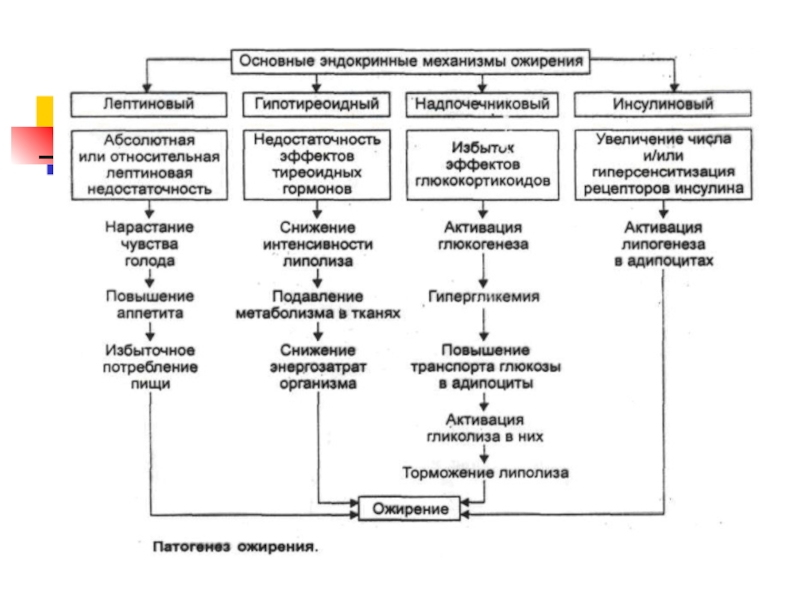
Слайд 33Нарушения эндокринной регуляции обмена веществ при ожирении
Наиболее частое из нарушений
→ повышенная активность в крови инсулина — гиперинсулинемия (в основе
избыточное поступление с пищей нутриентов). Чем ↑ ожирение, тем ↑ концентрация инсулина в крови утром и натощак. Гиперинсулинемия при ожирении приводит к большей суммарной длительности действия гипогликемии как внутреннего стимула к потреблению пищи.Гиперинсулинемия вызывает резистентность клеток к эффекту инсулина на рецепторном и пострецепторном уровнях. Кроме того, гиперинсулинемия связана с гиперплазией инсулинобразующих клеток, которая может обусловить недостаточность внешнесекреторной функции поджелудочной железы.
Слайд 34Нарушения эндокринной регуляции обмена веществ при ожирении
Гиперинсулинемия повышает утилизацию аминокислот
для белкового синтеза. Это вызывает гиперплазию гладкомышечных элементов стенки сосудов
сопротивления, их просвет сужается, ↑ОПСС и возникает артериальная гипертензия.Избыточное потребление нутриентов активирует симпатический отдел НС и повышает секрецию щитовидной железой ее гормонов → рост потребления кислорода организмом. Вслед за этим растет МОК, что также способствует развитию артериальной гипертензии.
Гиперлипидемия и накопление триглицеридов в жировой ткани требуют повышения интенсивности обмена холестерина. В результате ↑экскреция холестерина с желчью → создаются условия для образования камней в просвете желчного пузыря.
Слайд 35
Гиперлипидемия и гиперлипопротеинемия — патологическое состояние предболезни или
заболевание, связанное с ростом содержания в плазме крови свободных жирных
кислот, триглицеридов, холестерина, хиломикронов и липопротеинов.Слайд 36Типы гиперлипидемий
Семейная гиперлипидемия первого типа — врожденное нарушение липидного обмена,
обусловленное недостаточным расщеплением хиломикронов и ЛПОНП (при низкой активности липопротеинлипазы
или недостатка активатора этого фермента). В плазме растет концентрация неатерогенных липопротеинов очень низкой плотности и хиломикронов, атеросклероз у таких больных обычно не развивается.Гиперлипидемия второго типа — наследственное нарушение, при котором у родственников выявляют патологически высокое содержание холестерина в крови (семейная гиперхолестеринемия). Характерно раннее и быстрое развитие атеросклероза, ИБС и инфаркта миокарда. Ведущим звеном патогенеза гиперхолестеринемии при гиперлипидемии этого типа является или полное отсутствие рецепторов к ЛПНП на наружной клеточной поверхности, или нарушения их строения и функции вследствие мутации определенных генов.
Слайд 37Типы гиперлипидемий
Гиперлипидемия третьего типа — это наследуемая недостаточность катаболизма атерогенных
липопротеинов промежуточной плотности. Характеризуется ускоренным развитием атеросклероза, тромбоэмболиями из системы
венечной артерии, сахарным диабетом, ожирением, гипотиреозом и сильно выраженный ксантоматозом.Гиперлипидемия четвертого типа — это наследуемое нарушение липидного обмена, характеризующееся ростом содержания в плазме крови триглицеридов и ЛПОНП.
Гиперлипидемия пятого типа — это полиэтиологичное нарушение липидного обмена, из-за которого у части больных возникают ксантоматоз и панкреатит как следствие очень высоких концентраций в плазме крови ЛПОНП и хиломикронов.
Слайд 38
Атеросклероз — это отложение в интиме сосудов атерогенных липопротеинов низкой
плотности вследствие взаимодействия гладкомышечных клеток стенок сосудов с атерогенными липопротеинами
при их высокой концентрации в циркулирующей крови.Атеросклеротическую бляшку формируют липиды, лейкоциты, гладкомышечные клетки и межклеточное вещество интимы артерий.
!!!Часто связывают атеросклероз с пропитыванием холестерином сосудистой стенки, что не совсем правильно. Холестерин и триглицериды переносятся во внеклеточном пространстве липопротеинами.
К атеросклерозу ведет не гиперхолестеринемия, а аккумуляция в сосудистой стенке определенных липопротеинов. Поэтому одни из них считают атерогенными, а другие неатерогенными.
Атерогенные липопротеины → проникают в сосудистую стенку, где происходит их эндоцитоз макрофагами, которые в результате эндоцитоза превращаются в «пенистые клетки».
Слайд 39
В основе этиопатогенеза атеросклероза лежит липидная гипотеза.
Она основана на таких фактах:
атеросклеротическая бляшка содержит липиды, поступающие в нее прямо из липопротеинов плазмы крови;
атеросклеротические поражения сосудов воспроизводятся в эксперименте при кормлении животных пищей с высоким содержанием холестерина;
гиперлипидемию всегда выявляют у больных с диагнозом атеросклероз;
установлена параллель между высоким риском возникновения ИБС и ростом в плазме крови концентрации ЛПНП и снижении в ней содержания ЛПВП.
Слайд 40
Поверхность макрофагов содержит рецепторы к окисленным липопротеинам низкой плотности («рецепторы-мусорщики»).
Эти рецепторы обладают высоким сродством к «мусору» в виде окисленных
ЛПНП.Активация мононуклеаров осуществляется как раз через связывание этих рецепторов окисленными атерогенными липопротеинами.
Начальным этапом патогенеза атеросклероза является адгезия моноцита циркулирующей крови к эндотелиальным клеткам, с их последующей миграцией в интиму. При этом индукторы атеросклероза, окисленные ЛПНП, воздействуя на лейкоциты циркулирующей крови и эндотелиальные клетки, вызывают экспрессию на их поверхности адгезивных молекул (ЭЛАМ).
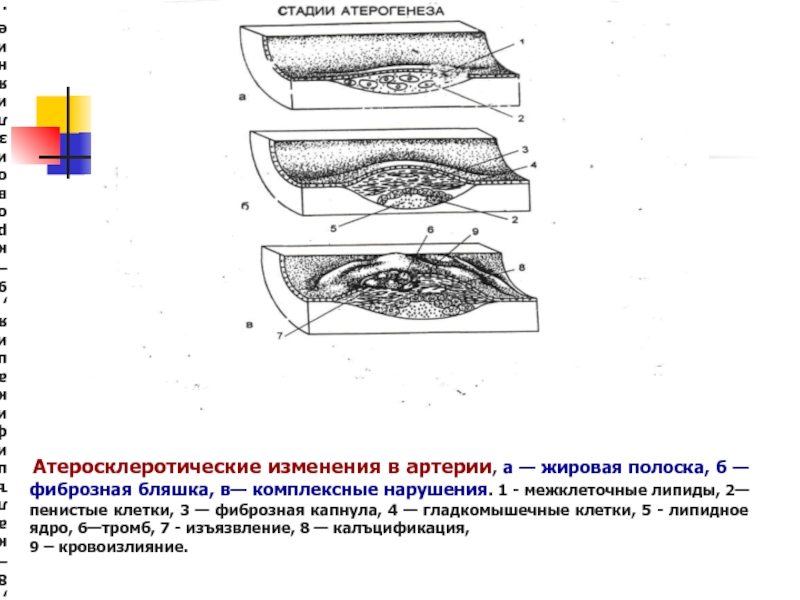
Слайд 42 Атеросклеротические изменения в артерии, а — жировая полоска, б
— фиброзная бляшка, в— комплексные нарушения. 1 - межклеточные липиды,
2— пенистые клетки, 3 — фиброзная капнула, 4 — гладкомышечные клетки, 5 - липидное ядро, 6—тромб, 7 - изъязвление, 8 — калъцификация,9 – кровоизлияние.
Слайд 43
Атеросклероз во многом представляет собой хроническое воспаление сосудистой
стенки, протекающее с преобладанием пролиферативного компонента, основными клеточными эффекторами которого
являются моноциты циркулирующей крови, мононуклеарные фагоциты субинтимального слоя, гладкомышечные сосудистые клетки, активированные атерогенными липопротеинами или в результате межклеточных взаимодействийСлайд 44
Все больше данных, свидетельствующих о генетической обусловленности высокой концентрации в
крови ЛПНП и атеросклероза;
В нормальных условиях взаимодействие молекулярного комплекса
холестерин-ЛПНП и ЛПНП-рецептора на поверхности клеток ведет к пиноцитозу молекулярного комплекса. Далее комплекс инкорпорируется в лизосомы, где и происходит высвобождение свободного холестерина. Рост концентрации свободного холестерина в клетке снижает активность ключевого фермента внутриклеточного синтеза холестерина (гидроксиметилглютарил-коэнзим А-редуктазы).
Слайд 45
Наследуемая недостаточность ЛПНП-рецепторов ведет к ↓ пиноцитоза комплекса холестерин-ЛПНП и
к ↓ концентрации свободного холестерина в клетках.
В клетках ↑
активность ключевого фермента синтеза холестерина. Последствие → интенсивное образование холестерина клетками, его высвобождение во внеклеточное пространство и рост в нем содержания атерогенных липопротеинов переносчиков холестерина.!! Гиперхолестеринемия вызывает атеросклероз не через пропитывание стенки сосудов холестерином, а через повышение интенсивности образования (печенью) и высвобождения в кровь атерогенных липопротеинов.
Слайд 46
Гиперхолестеринемия алиментарного генеза также повышает риск атеросклероза через ↑ в
крови концентрации ЛПНП и других атерогенных липопротеинов, переносящих холестерин во
внеклеточном пространстве.Рост концентрации ЛПНП повышает массу циркулирующих с кровью продуктов их окисления, вступающих во взаимодействие с рецепторами-мусорщиками наружных клеточных мембран макрофагов →повышается вероятность реализации инициирующего момента атеросклероза.