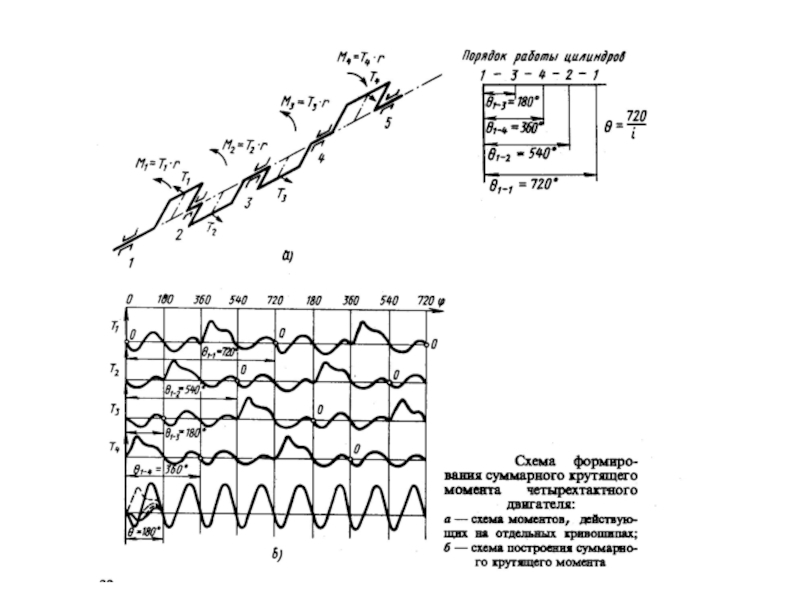
По мере открытия новых химических элементов, изучения состава и свойств
их соединений появлялись первые попытки классифицировать элементы по каким-либо признакам. В общей сложности до Д.И. Менделеева было предпринято более 50 попыток классификации химических элементов. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов, выявляющей природу их сходства и различия, имеющей предсказательный характер.Открытие Периодического закона