Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон и периодическая таблица Д.И.Менделеева. Виды аналогии
Содержание
- 1. Периодический закон и периодическая таблица Д.И.Менделеева. Виды аналогии
- 2. Современная формулировка периодического законаСвойства химических элементов, а
- 3. Причина периодичности свойств элементов объясняется электронным строением
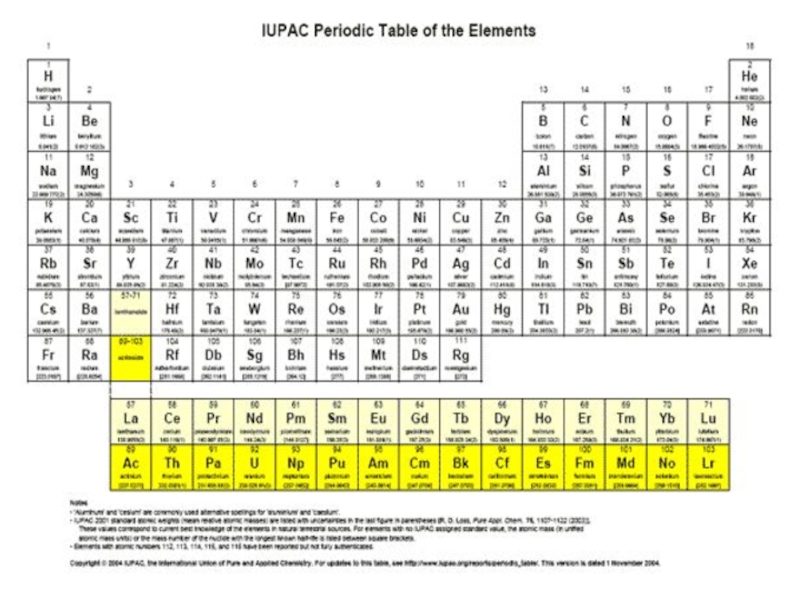
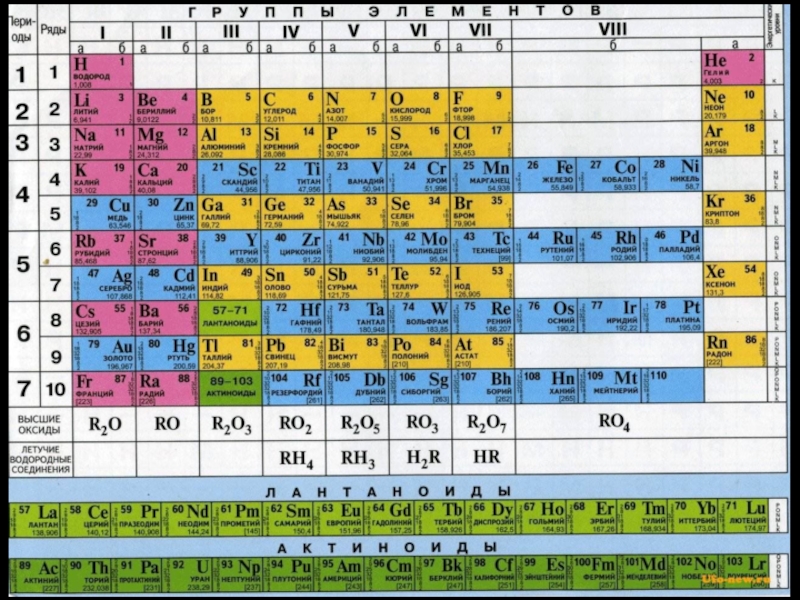
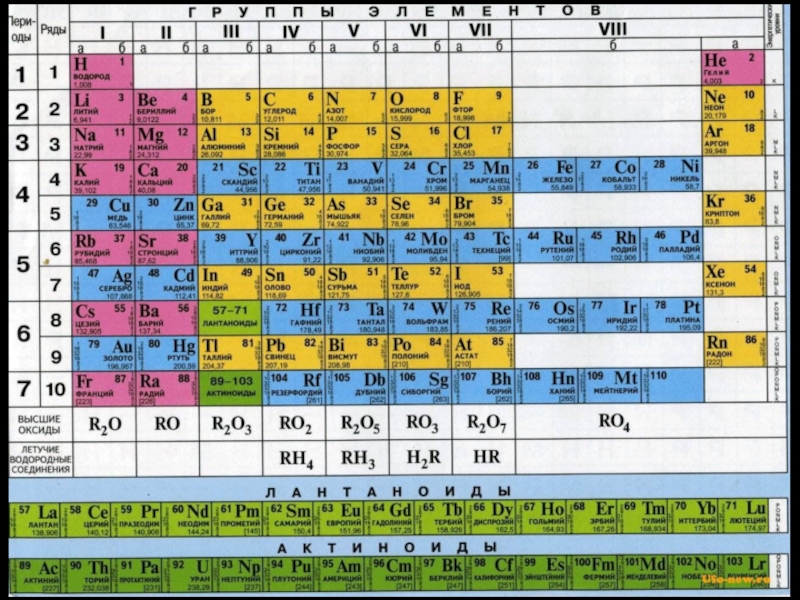
- 4. Периодическая таблица элементовВсе элементы периодической системы пронумерованы
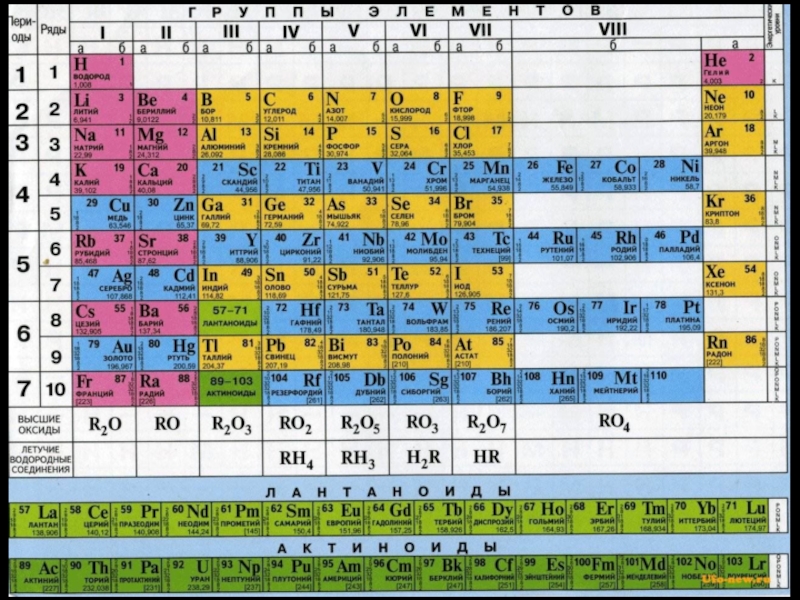
- 5. Периодическую систему графически можно изобразить в виде
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. В периодической системе по горизонтали имеется 7
- 10. В первом периоде находится 2 элемента (H
- 11. Элементы II и III периодов Д.И.Менделеев назвал
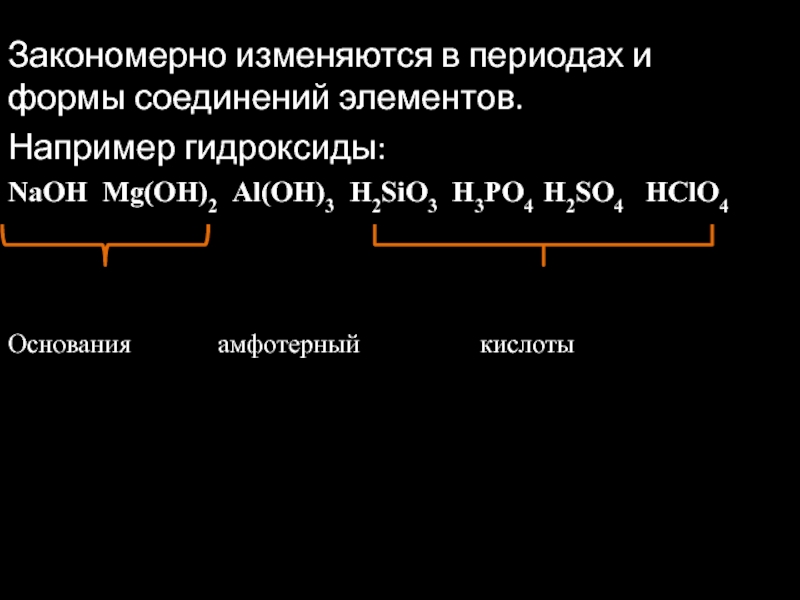
- 12. Закономерно изменяются в периодах и формы соединений
- 13. В системе 10 рядов (обозначены арабскими цифрами).
- 14. В нечетных рядах больших периодов (пятого, седьмого
- 15. Горизонтальные ряды Периодической таблицы называются группами. Группы
- 16. Слайд 16
- 17. В главных (или А) подгруппах расположены
- 18. В побочных подгруппах (В) располагаются элементы, у
- 19. В VIII группе в главной подгруппе располагаются
- 20. Слайд 20
- 21. В побочной подгруппе III группы в 6
- 22. В длинном варианте таблицы группы не делят на подгруппы, а d- элементы выносят отдельно
- 23. Периодичность изменения свойств элементовК числу важнейших характеристик
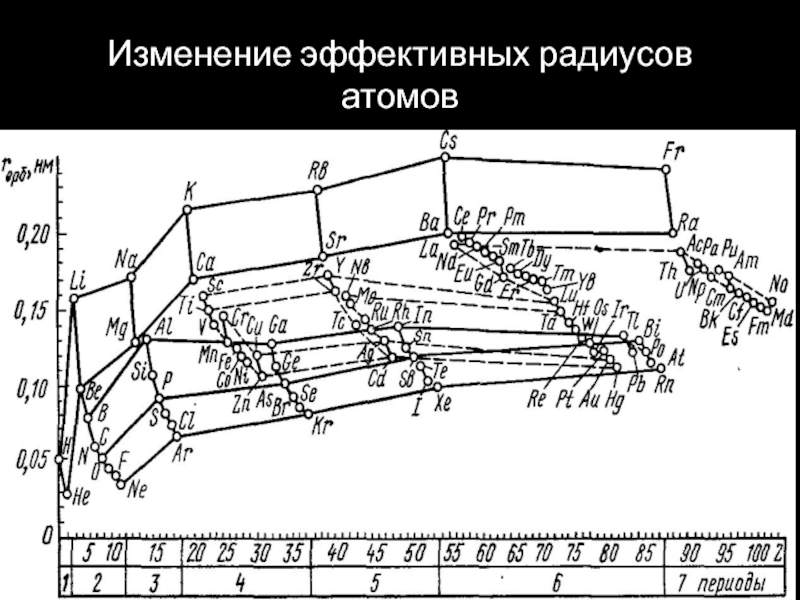
- 24. Изменение эффективных радиусов атомов
- 25. основные закономерности: В периодах радиусы атомов уменьшаютсяЭто
- 26. Радиусы ионовРадиус катиона меньше радиуса атомаРадиус аниона больше радиуса атома
- 27. 4. С ростом порядкового номера элементов радиусы
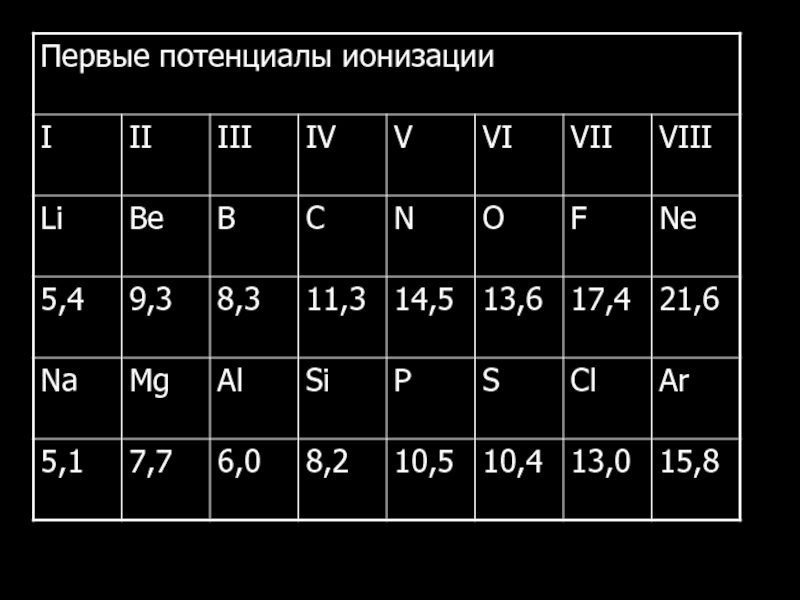
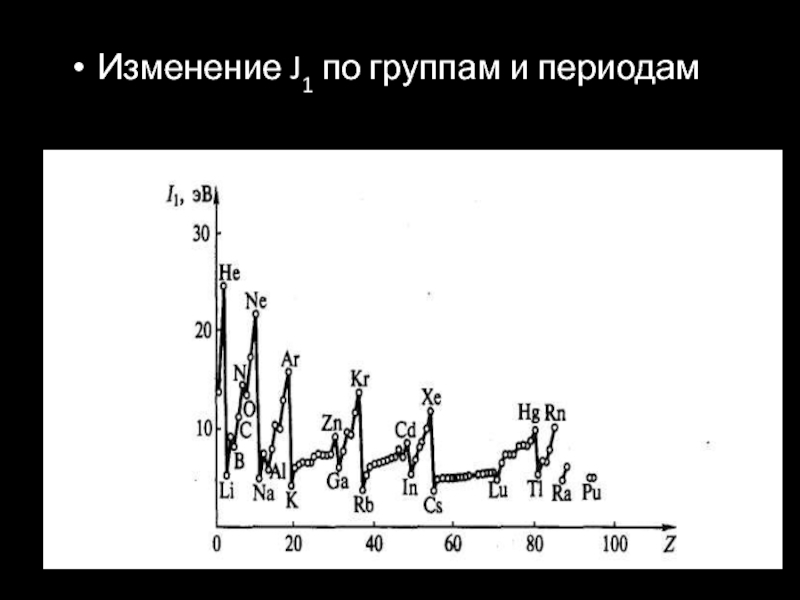
- 28. Энергия (потенциал) ионизации (J)Минимальная энергия, которую необходимо
- 29. Чем больше значение J, тем больше неметаллические свойства элемента.
- 30. Слайд 30
- 31. Изменение J1 по группам и периодам
- 32. Сродство к электрону (СЭ)изменение энергии в
- 33. Чем больше сродство к электрону данного атома,
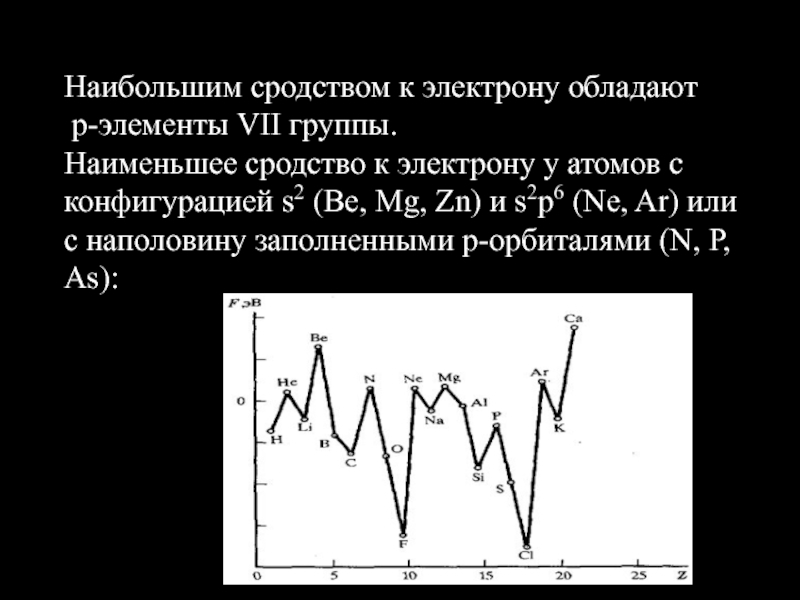
- 34. Наибольшим
- 35. Электроотрицательность Электроотрицательность (χ) характеризует способность атомов
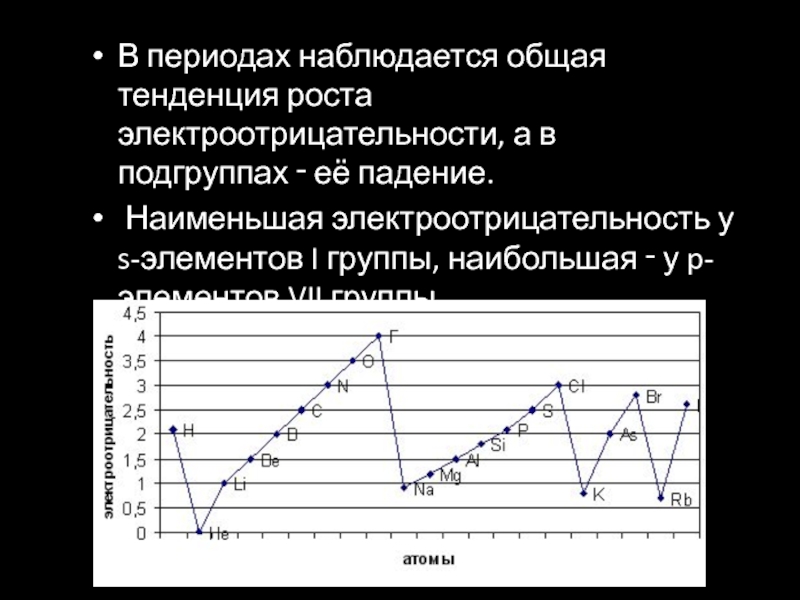
- 36. В периодах наблюдается общая тенденция роста электроотрицательности,
- 37. Степень окисления элементов Максимальная положительная степень окисления
- 38. Исключения: кислород – высшая степень окисления +2
- 39. элементы VIIIA подгруппы (благородные газы) – только
- 40. Минимальная степень окисления для элементов IV –
- 41. Типы аналогии элементовЗная закономерности изменений свойств, в
- 42. групповые аналогиЭто элементы одной группы . Одинаковое
- 43. Например, Сl2O5 и Mn2O5 – кислотные оксиды,
- 44. типовые аналогиЭто элементы одной подгруппы . Их
- 45. Слоевые аналогиСлоевыми аналогами называются элементы, которые являются
- 46. Свойства слоевых аналогов во всех степенях окисления
- 47. горизонтальная аналогия. Горизонтальная аналогия присуща триадам Fe-Co-Ni,
- 48. Из-за близости радиуса атома и электроотрицательности среди
- 49. Таким образом, зная закономерности изменения основных свойств
- 50. Скачать презентанцию
Современная формулировка периодического законаСвойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
Слайды и текст этой презентации
Слайд 3Причина периодичности свойств элементов объясняется электронным строением атомов.
Периодично структуры
электронных оболочек приводит к периодичности свойств элементов, а поэтому и
свойств простых и сложных веществ.Слайд 4Периодическая таблица элементов
Все элементы периодической системы пронумерованы в том порядке,
в каком они следуют друг за другом.
Номера элементов называются
порядковыми или атомными номерами и соответствуют заряду ядра атома. Слайд 5Периодическую систему графически можно изобразить в виде таблицы.
Существует около
20 вариантов Периодической таблицы химических элементов.
Наиболее распространены клеточные варианты
– короткопериодный и длиннопериодный .Слайд 9В периодической системе по горизонтали имеется 7 периодов , из
них 1, 2 и 3 называются малыми, а 4, 5,
6 и 7 ‑ большими.Период объединяет элементы, в атомах которых происходит последовательное заполнение электронами одинаковых электронных уровней.
Номер периода совпадает с главным квантовым числом внешнего электронного уровня.
Слайд 10В первом периоде находится 2 элемента
(H 1s1 и He
1s2),
во втором и третьем ‑ по 8,
в четвертом
и пятом ‑ по 18 [от ns1
до ns2(n-1)d10np6] , в шестом – 32 [от 6s1 до 6s24f145d106p6],
в седьмом (незавершенном) ‑ 24 элемента.
Каждый период, за исключением первого и седьмого (незавершенного), начинается щелочным металлом и заканчивается благородным газом (ns2np6 ).
Слайд 11Элементы II и III периодов Д.И.Менделеев назвал типическими.
Свойства их
закономерно изменяются от типичного металла до благородного газа.
Na
Mg Al Si P S Cl NeМет. Мет. Мет. Неметаллы
Слайд 12Закономерно изменяются в периодах и формы соединений элементов.
Например гидроксиды:
NaOH Mg(OH)2
Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4
Основания
амфотерный кислотыСлайд 13В системе 10 рядов (обозначены арабскими цифрами).
Каждый малый период
состоит из одного ряда, каждый большой период ‑ из двух
рядов: четного (верхнего) и нечетного (нижнего).В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо.
Слайд 14В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства
элементов в ряду слева направо изменяются, как у типических элементов.
Слайд 15Горизонтальные ряды Периодической таблицы называются группами.
Группы объединяют атомы элементов,
имеющих одинаковое количество электронов на внешнем уровне.
В коротком варианте Периодической
таблицы по вертикали расположены восемь групп. Группы разбиты на подгруппы.
Слайд 17В главных (или А) подгруппах расположены
s- и p-элементы.
Например,
IV A – подгруппа:
С 2s22p2
Si 3s23p2
Ge 4s23d104p2
Sn 5s24d105p2
Pb 6s24f145d106p2
Слайд 18В побочных подгруппах (В) располагаются элементы, у которых идет заполнение
электронами предвнешнего d-подуровня.
Для элементов побочных подгрупп номер группы равен
общему числу электронов на
(n-1)d и ns- подуровне. Например, IV B-подгруппа:
Ti 4s23d2
Zr 5s24d2
Hf 6s24f145d2
Слайд 19В VIII группе в главной подгруппе располагаются инертные газы, а
побочную подгруппу составляют триады d-элементов: триада железа (Fe, Co, Ni),
триада рутения (Ru,Rh,Pd) и триада осмия (Os, Ir, Pt).Количество электронов на (n-1)d и ns- подуровнях для двух последних элементов триад больше номера группы.
Триады рутения и осмия называются ПЛАТИНОВЫЕ металлы
Слайд 21В побочной подгруппе III группы в 6 и 7 периоде
вместе с лантаном (La 6s25d1) и актинием (Ac 7s26d1) находятся
семейства f-элементов – лантаноиды (от 4f1 до 4f14) и актиноиды (от 5f1 до 5f14).Эти элементы как в коротком, так и в длинном вариантах вынесены вниз таблицы.
Слайд 23Периодичность изменения свойств элементов
К числу важнейших характеристик элементов, определяемых электронным
строением атома, относятся:
радиусы атомов (r),
энергия ионизации (J),
энергия
сродства к электрону (Э.С.)электроотрицательность (χ)
степени окисления элементов.
Все эти свойства, а также формы и свойства типичных соединений закономерно меняются по группам и периодам.
Слайд 25основные закономерности:
В периодах радиусы атомов уменьшаются
Это уменьшение более резкое
в малых периодах и плавное в больших периодах, при появлении
между щелочным металлом и благородным газом семейств d-элементов и лантаноидов или актиноидов.В группах элементов радиусы атомов в общем увеличиваются,
В побочных подгруппах рост радиуса менее выражен
Слайд 274. С ростом порядкового номера элементов радиусы ионов, образуемых лантаноидами
(радиус иона Се3+ равен 1,07 A, a Lu3+ - 0,85
А) уменьшаются.Эта закономерность называется лантаноидным сжатием.
Слайд 28Энергия (потенциал) ионизации (J)
Минимальная энергия, которую необходимо затратить для удаления
электрона из атома, находящегося в основном состоянии.
А -
е → А-Потенциал ионизации (J) измеряют в вольтах
Слайд 32Сродство к электрону (СЭ)
изменение энергии в процессе присоединения электрона
к нейтральному атому, находящемуся в основном состоянии
А + e → A-
Слайд 33Чем больше сродство к электрону данного атома, тем более устойчив
образующийся ион.
Чем труднее нейтральный атом отдает электрон, тем больше
его способность к присоединению дополнительного электрона с образованием отрицательно заряженного иона, тем ярче выражены неметаллические свойства.Слайд 34 Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство
к электрону у атомов с конфигурацией s2 (Be, Mg, Zn)
и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):Слайд 35Электроотрицательность
Электроотрицательность (χ) характеризует способность атомов притягивать к себе электроны,
связывающие их с другими атомами в гетероатомной молекуле.
Слайд 36В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах
‑ её падение.
Наименьшая электроотрицательность у s-элементов I группы, наибольшая
‑ у p-элементов VII группыСлайд 37Степень окисления элементов
Максимальная положительная степень окисления элементов в подавляющем большинстве
случаев равна номеру группы в короткопериодном варианте периодической таблицы.
Например,
Cr и S – высшая степень окисления равна +6,
формы высших оксидов СrO3 и SO3,
им соответствуют кислоты H2CrO4 и H2SO4.
Слайд 38Исключения:
кислород – высшая степень окисления +2 (только в соединениях со
фтором);
фтор ‑ его степень окисления равна -1;
медь, серебро,
золото проявляют степень окисления больше, чем номер группы (+1, +2 и +3); элементы VIII В подгруппы ‑ степень окисления +8 известна только для Os, Ru.
Слайд 39элементы VIIIA подгруппы (благородные газы) – только Xe может проявлять
степень окисления +8, например в соединении XeО4, максимальная степень окисления
Kr равна +6, Ar +4, а Ne и He не образуют соединенийСлайд 40Минимальная степень окисления для элементов IV – VII групп равна
8 минус номер группы.
Например:
элементы V группы (N, P,
As) низшая степень окисления равна -3 (NH3, Ca3P2), для галогенов (F, Cl, Br, I) равна -1
(HF, NaCl, KBr, HI).
Слайд 41Типы аналогии элементов
Зная закономерности изменений свойств, в зависимости от нахождения
элемента в периодической системе, и находя похожести – аналогии с
типическими элементами, можно охарактеризовать свойства любого элемента и его соединения.Аналогии свойств элементов связаны с похожестью строения их электронных оболочек.
Слайд 42групповые аналоги
Это элементы одной группы .
Одинаковое количество электронов на
внешнем и незавершенном предвнешнем электронных уровнях приводит к одинаковой высшей
степени окисления, и близости свойств соединений элементов в этой степени окисления.Слайд 43Например,
Сl2O5 и Mn2O5 – кислотные оксиды,
им соответствуют сильные,
неустойчивые кислоты
HClO4 (хлорная кислота)
HMnO4 (марганцевая кислота),
а так
же соли NaClO4 (перхлорат натрия),
NaMnO4 (перманганат натрия), проявляющие окислительную активность.
Слайд 44типовые аналоги
Это элементы одной подгруппы . Их схожесть обусловлена одинаковой
структурой последних электронных оболочек.
Химические свойства элементов главных и побочных подгрупп
и их соединений в степенях окисления ниже высшей значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, CI, Br, I, At, побочную — металлы Мn, Тс, Re.
Слайд 45Слоевые аналоги
Слоевыми аналогами называются элементы, которые являются типовыми аналогами, но
не имеют внешних или предвнешних 1s , 2p.
Например:
Li
1s22s1 Na 1s22s22p63s1
K 1s22s22p63s23p64s1
Rb 1s22s22p63s23p64s23d104p65s1
Cs 1s22s22p63s23p64s23d104p65s24d105p66s2
слоевые
Неслоевые
Слайд 46Свойства слоевых аналогов во всех степенях окисления очень близки.
Еще более
близки свойства у шринк аналогов (контракционных) из-за близости их радиусов,
вследствие f- сжатия.К ним относятся пары
Zr –Hf,
Nb –Ta,
Mo - W
Слайд 47горизонтальная аналогия.
Горизонтальная аналогия присуща триадам Fe-Co-Ni, платиновым металлам, лантаноидам.
Химические
свойства лантаноидов очень сходны. Например, все они являются реакционноспособными металлами,
реагируют с водой с образованием гидроксида и водорода.Слайд 48Из-за близости радиуса атома и электроотрицательности среди элементов 2 и
3 периода наблюдается диагональная аналогия.
Например, многие соединения лития, похожи
на аналогичные соединения магния больше, чем на соединения натрия. Диагональная аналогия наблюдается между парами
Li-Mg,
Be-Al,
B-Si.