Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
Содержание
- 1. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
- 2. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
- 3. Слайд 3
- 4. БЕЛКИ – БИОПОЛИМЕРЫ, МОНОМЕРАМИ КОТОРЫХ ЯВЛЯЮТСЯ АМИНОКИСЛОТЫ.
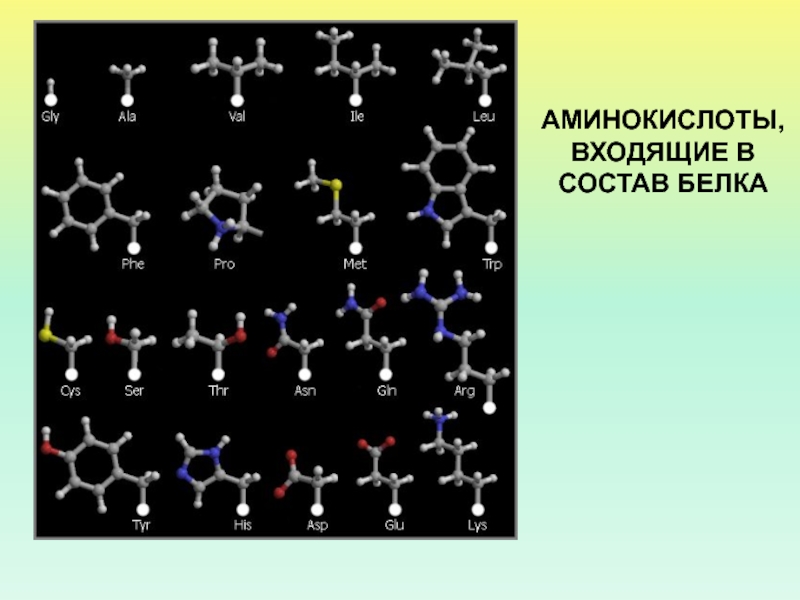
- 5. АМИНОКИСЛОТЫ, ВХОДЯЩИЕ В СОСТАВ БЕЛКА
- 6. АМИНОКИСЛОТЫ, ВХОДЯЩИЕ В СОСТАВ БЕЛКА
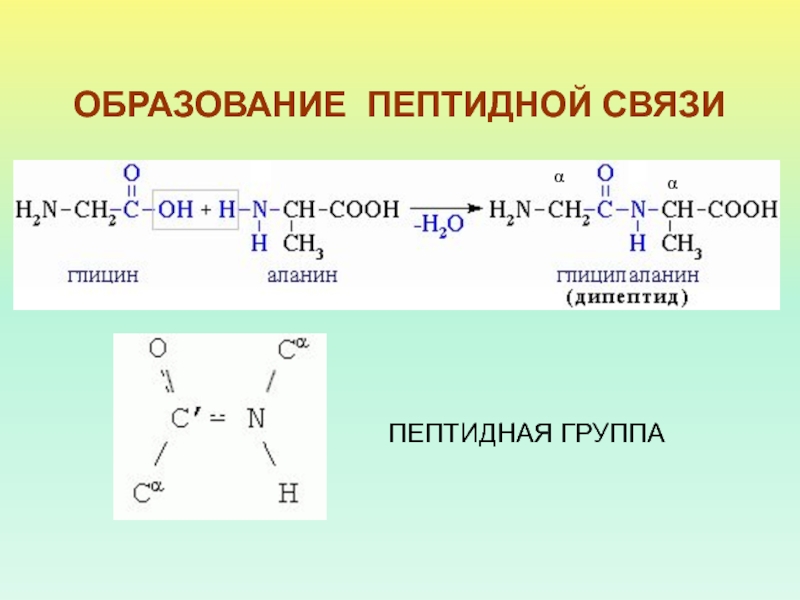
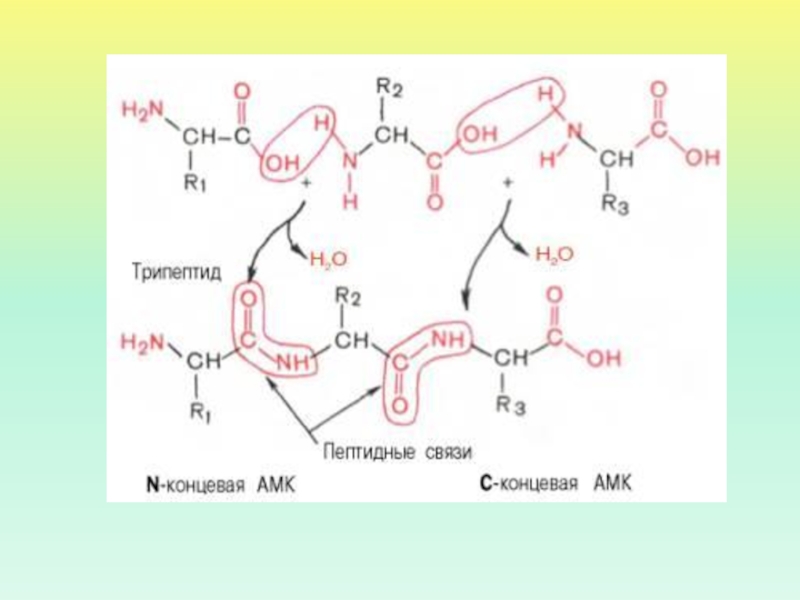
- 7. ОБРАЗОВАНИЕ ПЕПТИДНОЙ СВЯЗИαααПЕПТИДНАЯ ГРУППА
- 8. Слайд 8
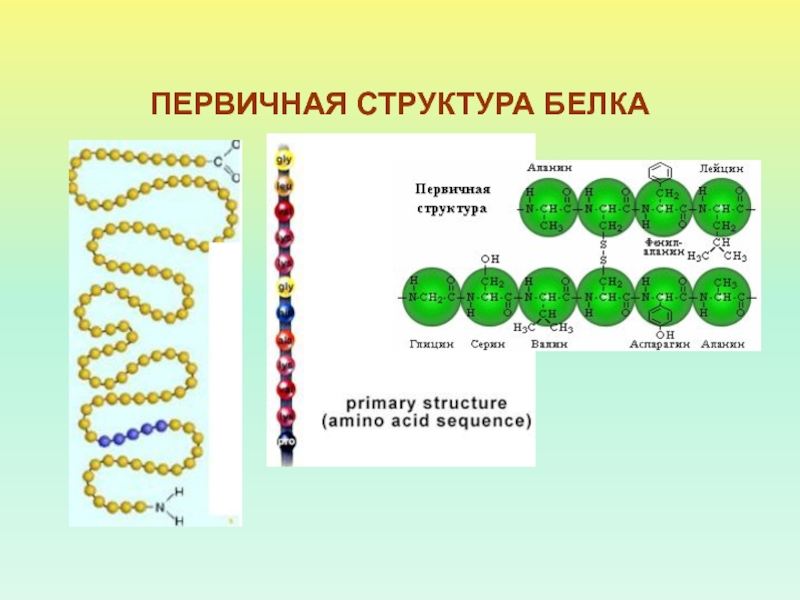
- 9. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
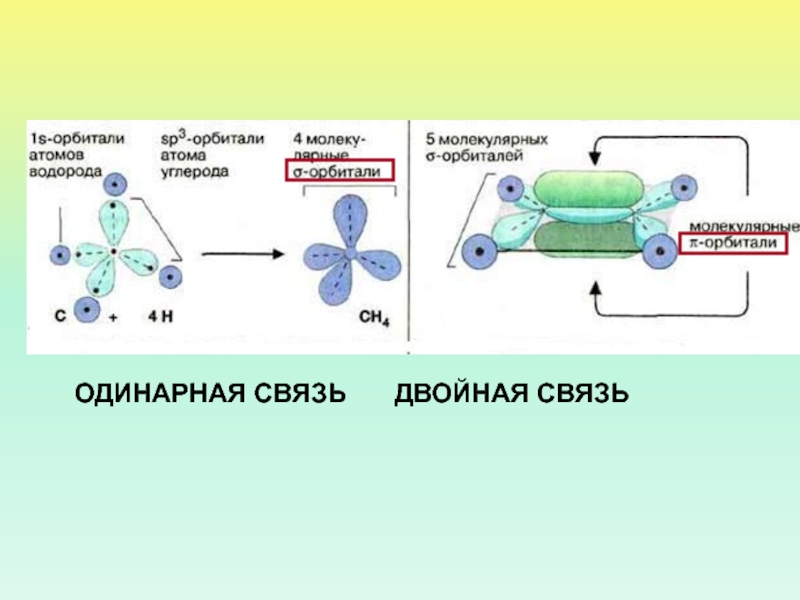
- 10. ОДИНАРНАЯ СВЯЗЬ ДВОЙНАЯ СВЯЗЬ
- 11. ПЛОСКАЯ ФОРМА ПЕПТИДНОЙ ГРУППЫ ОБЕСПЕЧИВАЕТСЯ SP2-ГИБРИДИЗАЦИЕЙ ЭЛЕКТРОНОВ
- 12. ДЕЛОКАЛИЗАЦИЯ π-ЭЛЕКТРОНОВ В ПЕПТИДНОЙ СВЯЗИЭЛЕКТРОНЫ АТОМОВ С
- 13. ДЕЛОКАЛИЗАЦИЯ π-ЭЛЕКТРОНОВ
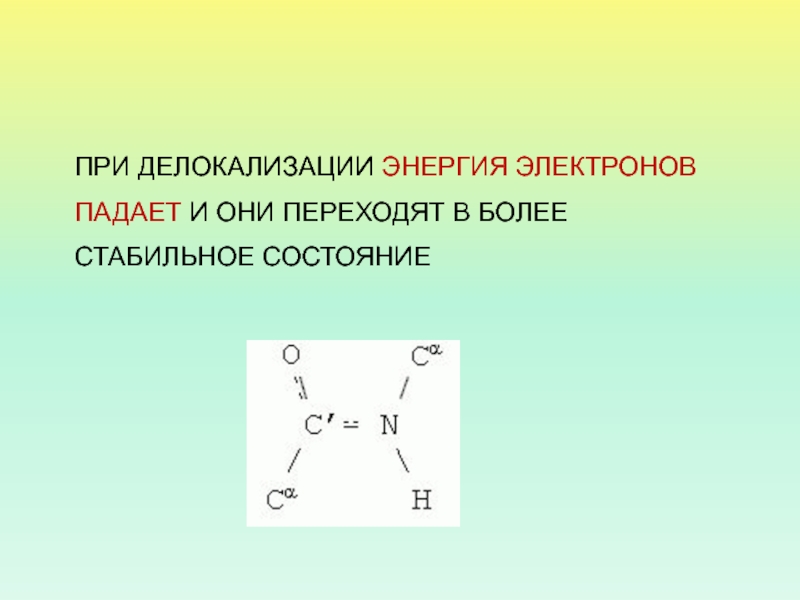
- 14. ПРИ ДЕЛОКАЛИЗАЦИИ ЭНЕРГИЯ ЭЛЕКТРОНОВ ПАДАЕТ И ОНИ ПЕРЕХОДЯТ В БОЛЕЕ СТАБИЛЬНОЕ СОСТОЯНИЕ
- 15. ДЛИНЫ СВЯЗЕЙN – C (ПЕПТИДНАЯ СВЯЗЬ) 0,132
- 16. ДЛИНЫ СВЯЗЕЙ В ПЕПТИДНОЙ ГРУППЕ
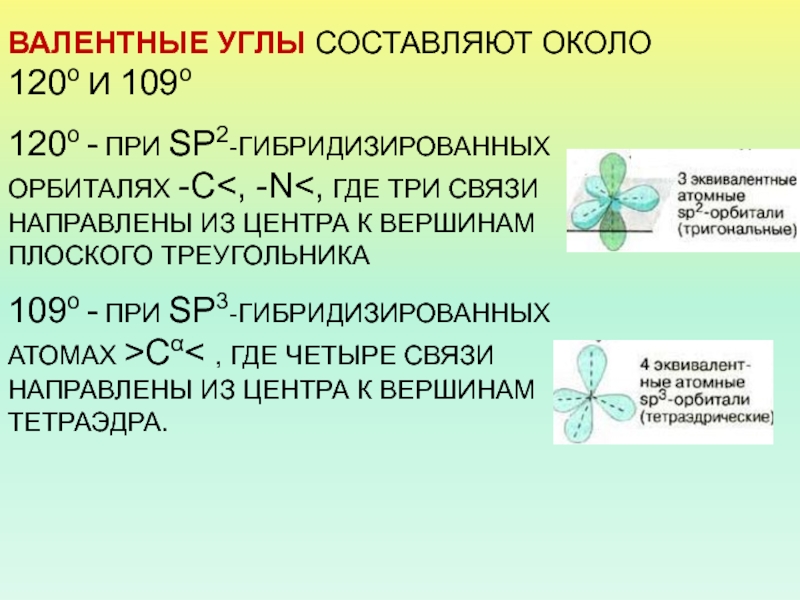
- 17. ВАЛЕНТНЫЕ УГЛЫ СОСТАВЛЯЮТ ОКОЛО 120о И 109о120о - ПРИ SP2-ГИБРИДИЗИРОВАННЫХ ОРБИТАЛЯХ -С
- 18. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ВАЛЕНТНЫЕ СВЯЗИ НЕ ФЛУКТУИРУЮТ:
- 19. ГИБКОСТЬ ПОЛИПЕПТИДНОЙ ЦЕПИ, А, ЗНАЧИТ, И ЕЕ
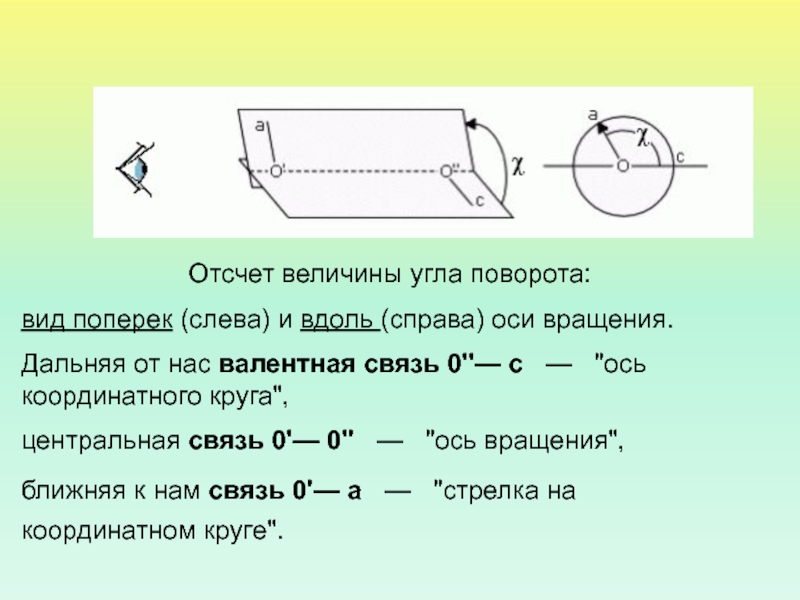
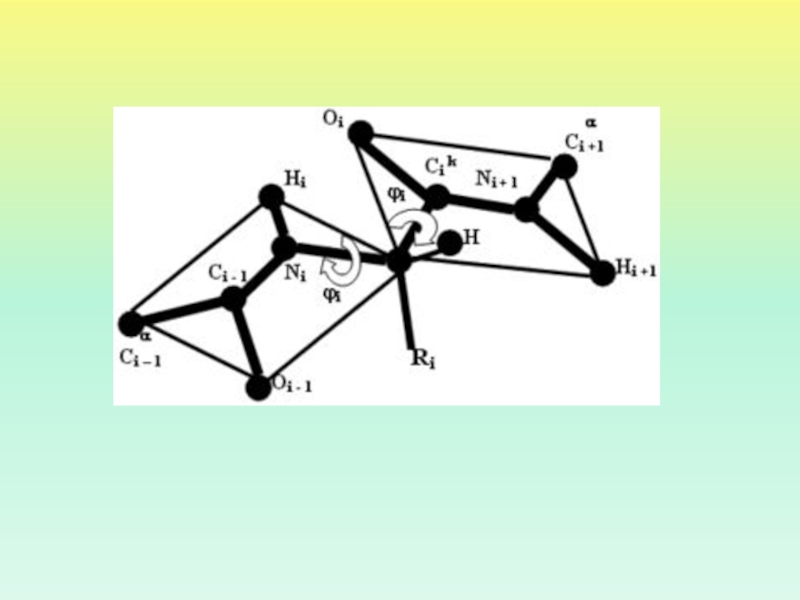
- 20. Отсчет величины угла поворота: вид поперек (слева)
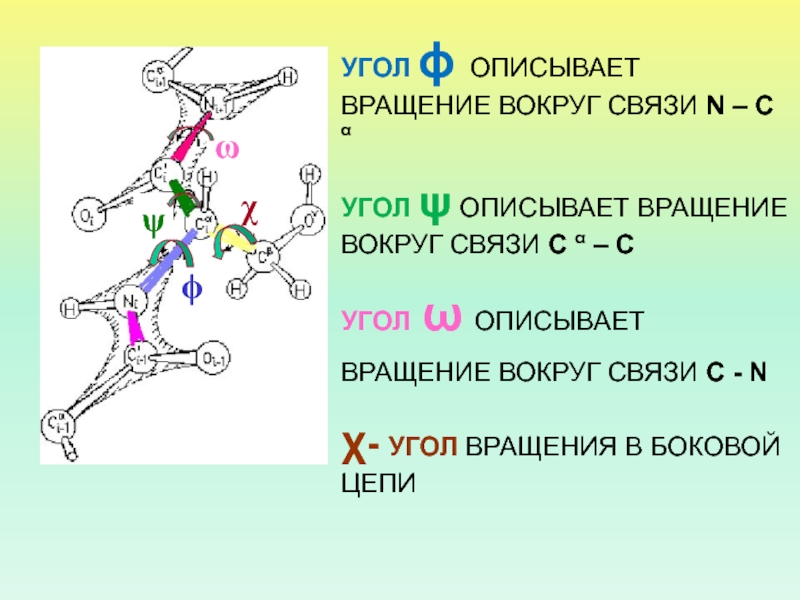
- 21. УГОЛ ϕ ОПИСЫВАЕТ ВРАЩЕНИЕ ВОКРУГ СВЯЗИ N
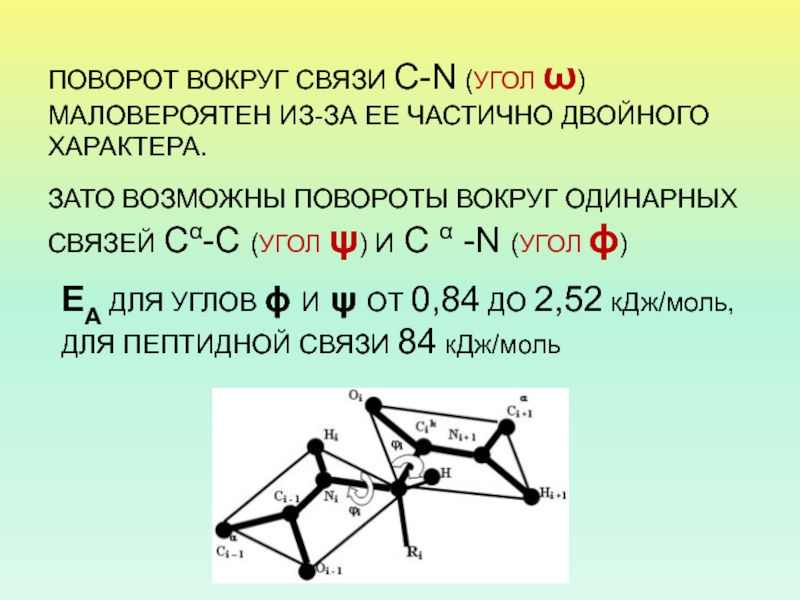
- 22. ПОВОРОТ ВОКРУГ СВЯЗИ С-N (УГОЛ ω) МАЛОВЕРОЯТЕН
- 23. Слайд 23
- 24. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
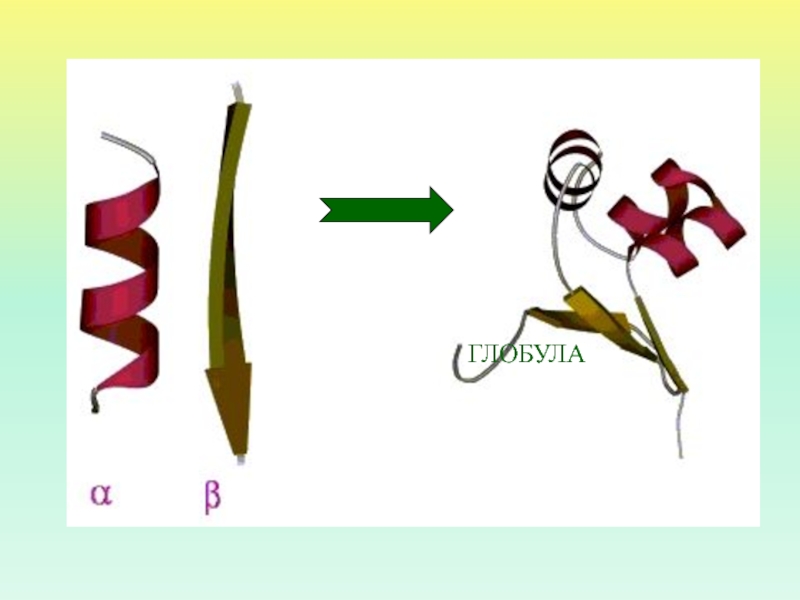
- 25. ГЛОБУЛА
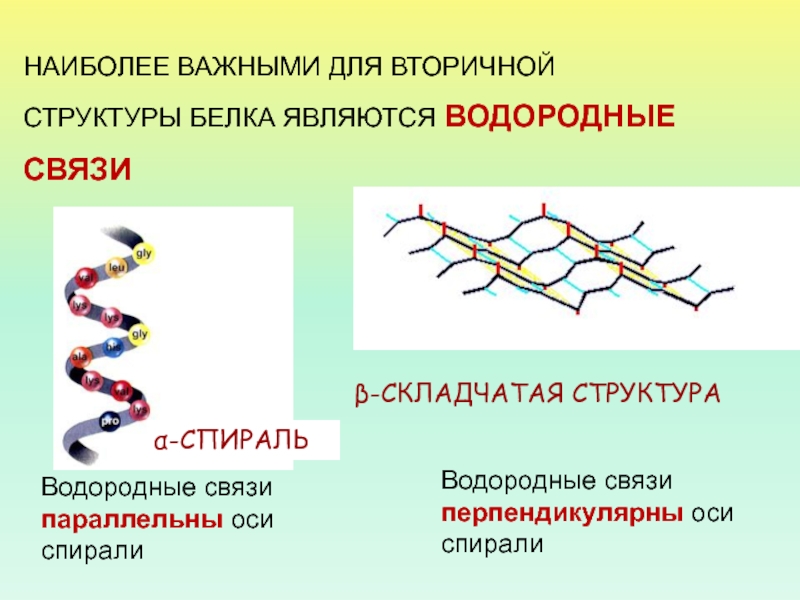
- 26. НАИБОЛЕЕ ВАЖНЫМИ ДЛЯ ВТОРИЧНОЙ СТРУКТУРЫ БЕЛКА ЯВЛЯЮТСЯ
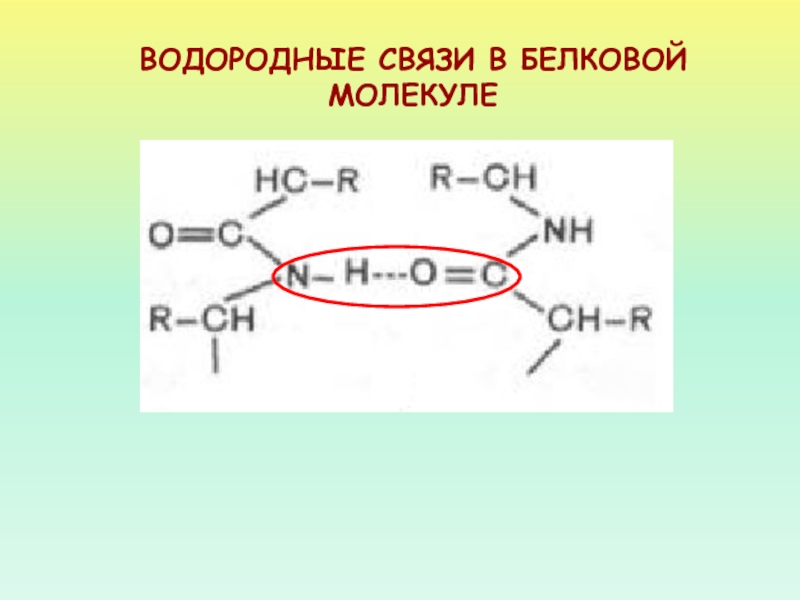
- 27. ВОДОРОДНЫЕ СВЯЗИ В БЕЛКОВОЙ МОЛЕКУЛЕ
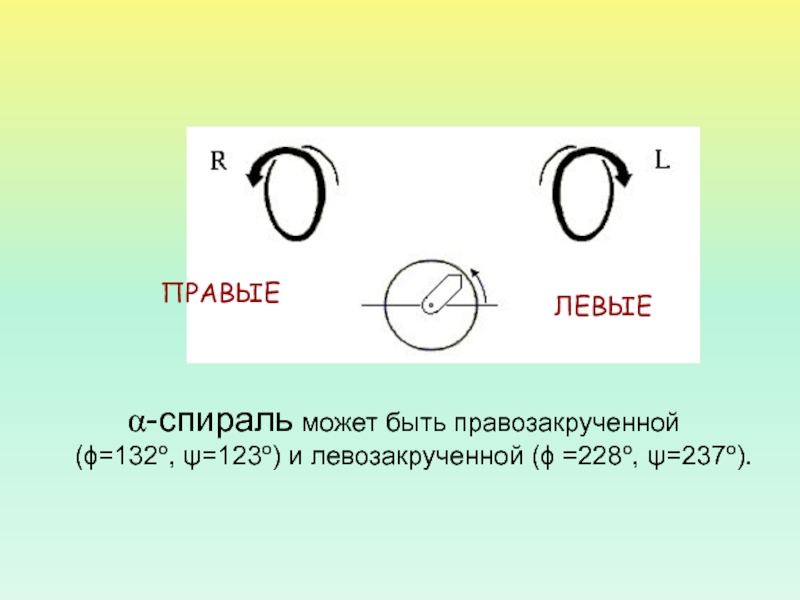
- 28. -спираль может быть правозакрученной (ϕ=132о, ψ=123о) и левозакрученной (ϕ =228о, ψ=237о). ПРАВЫЕЛЕВЫЕ
- 29. Правая α-спираль. (а) Атомарная структура. R —
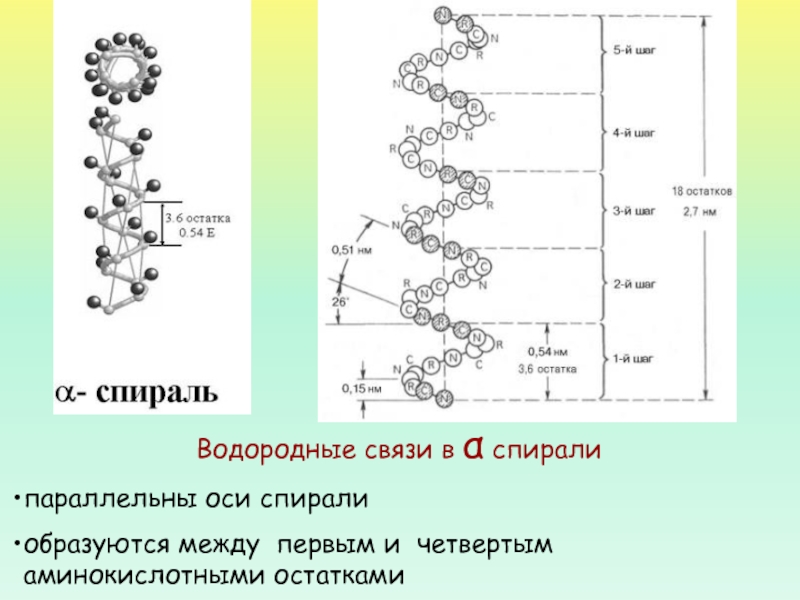
- 30. Водородные связи в α спирали параллельны оси спиралиобразуются между первым и четвертым аминокислотными остатками
- 31. НА КАЖДЫЙ ВИТОК (ШАГ) СПИРАЛИ ПРИХОДИТСЯ 3,6
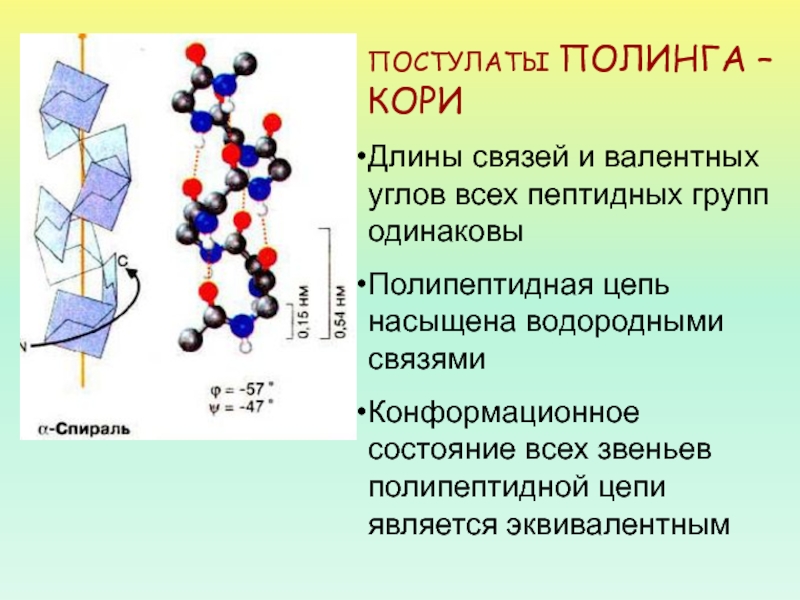
- 32. ПОСТУЛАТЫ ПОЛИНГА – КОРИДлины связей и валентных
- 33. Некоторые остатки аминокислот могут нарушать формирование α-спирали.ПРОЛИНЕго
- 34. участки, где последовательно расположены несколько одинаково заряженных
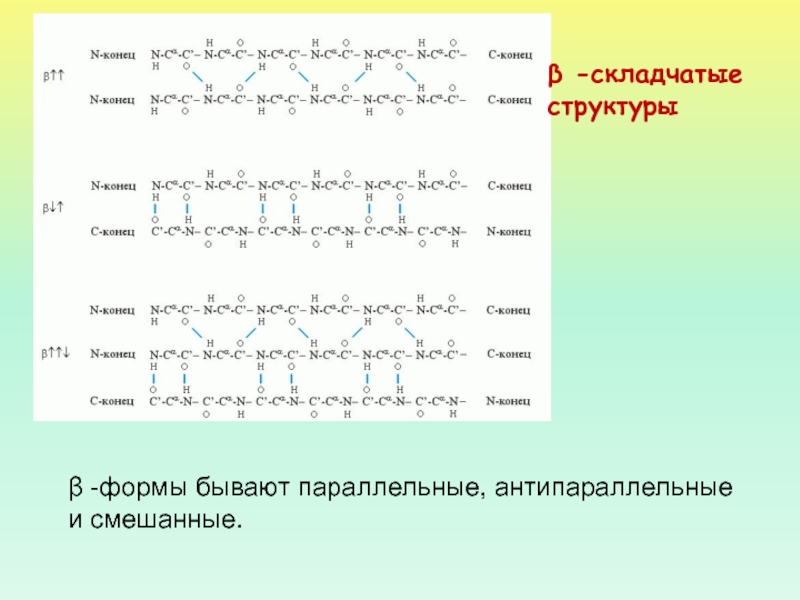
- 35. β -складчатые структуры
- 36. β -формы бывают параллельные, антипараллельные и смешанные. β -складчатые структуры
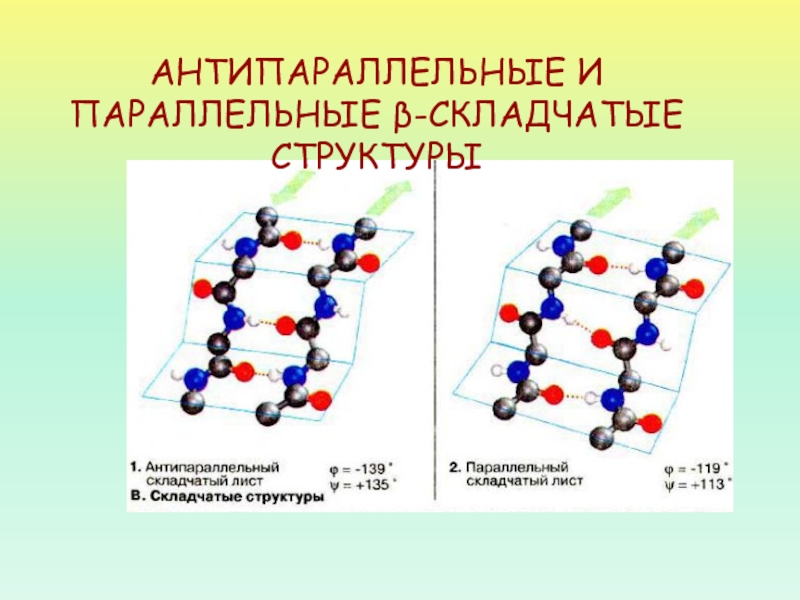
- 37. АНТИПАРАЛЛЕЛЬНЫЕ И ПАРАЛЛЕЛЬНЫЕ β-СКЛАДЧАТЫЕ СТРУКТУРЫ
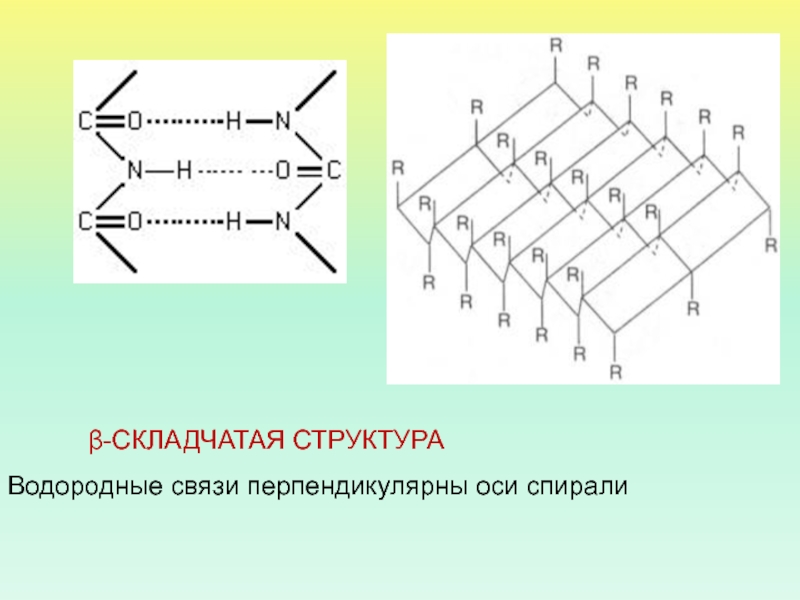
- 38. β-СКЛАДЧАТАЯ СТРУКТУРАВодородные связи перпендикулярны оси спирали
- 39. ИМЕЮТСЯ СПИРАЛИ И БЕЗ ВОДОРОДНЫХ СВЯЗЕЙ, КОТОРЫЕ
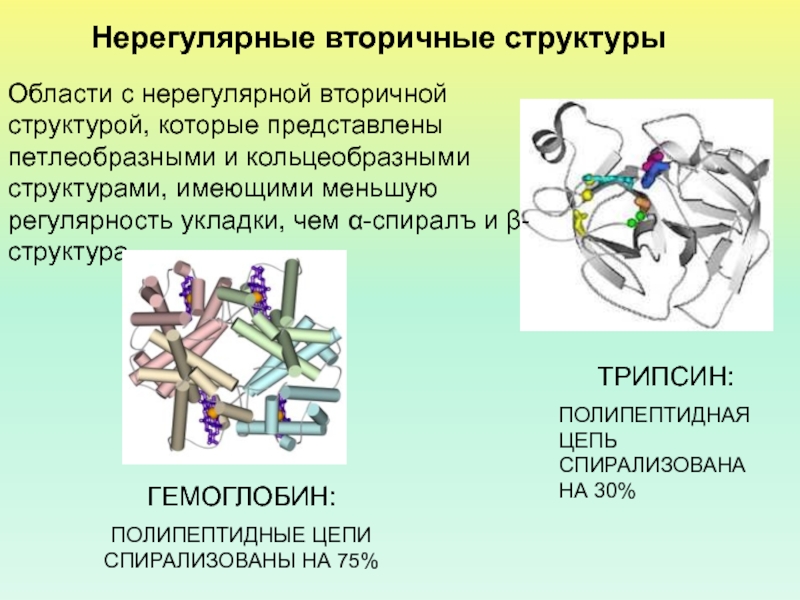
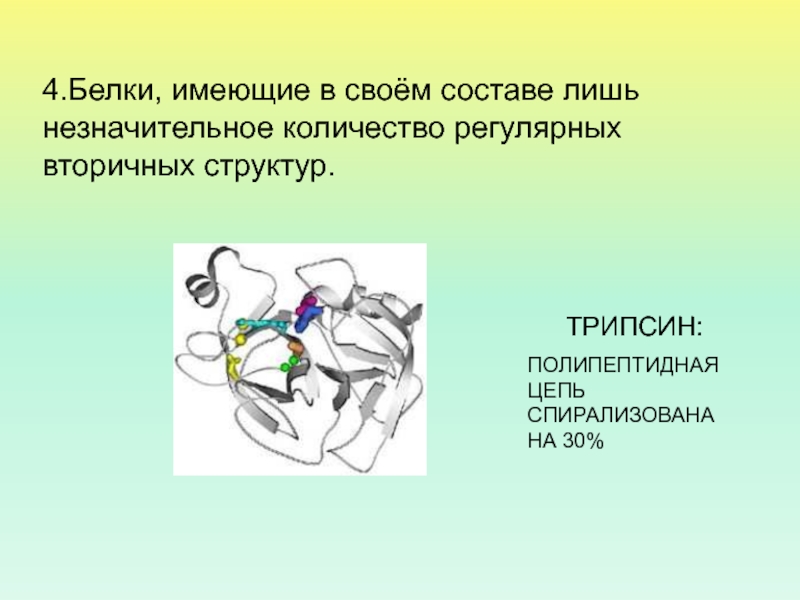
- 40. Нерегулярные вторичные структуры ТРИПСИН: ПОЛИПЕПТИДНАЯ ЦЕПЬ СПИРАЛИЗОВАНА
- 41. ДРУГИЕ СПИРАЛЬНЫЕ КОНФОРМАЦИИСПИРАЛЬ 310 3 ОСТАТКА АМИНОКИСЛОТ
- 42. СВЕРХВТОРИЧНЫЕ СТРУКТУРЫ
- 43. СВЕРХВТОРИЧНЫЕ СТРУКТУРЫ – ЭТО ТЕРМОДИНАМИЧЕСКИ ИЛИ КИНЕТИЧЕСКИ
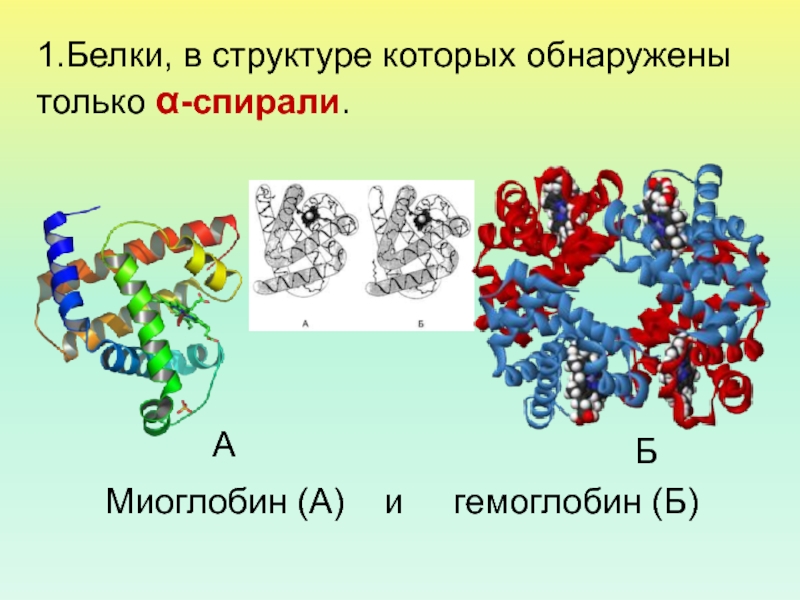
- 44. 1.Белки, в структуре которых обнаружены только α-спирали. Миоглобин (А) и гемоглобин (Б) АБ
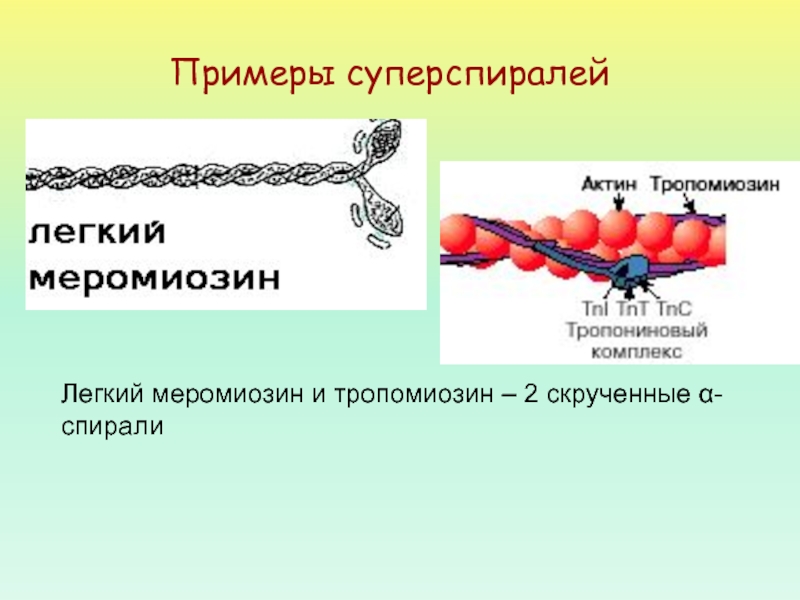
- 45. Примеры суперспиралейЛегкий меромиозин и тропомиозин – 2 скрученные α-спирали
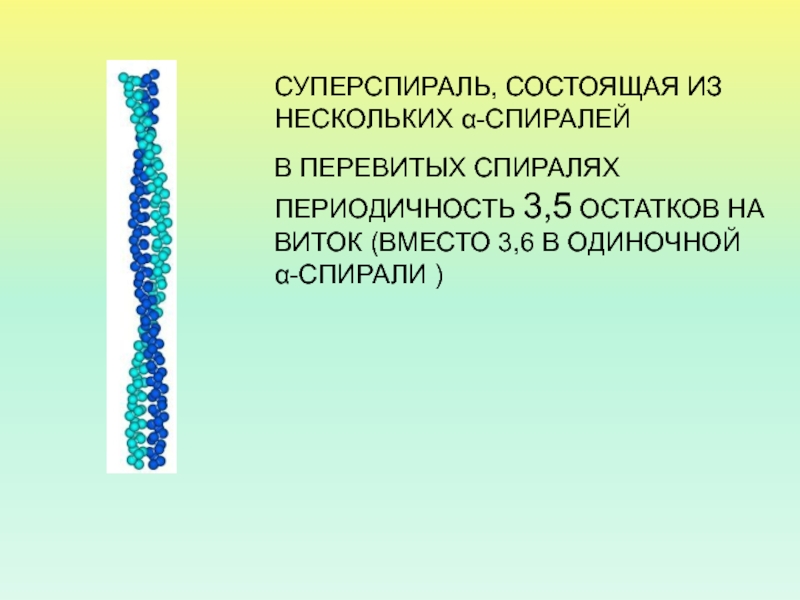
- 46. СУПЕРСПИРАЛЬ, СОСТОЯЩАЯ ИЗ НЕСКОЛЬКИХ α-СПИРАЛЕЙВ ПЕРЕВИТЫХ СПИРАЛЯХ
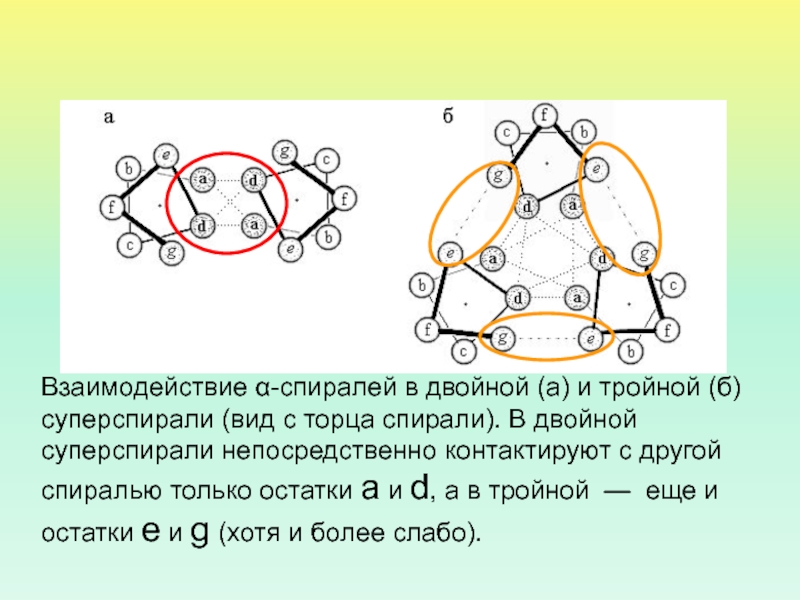
- 47. Взаимодействие α-спиралей в двойной (а) и тройной
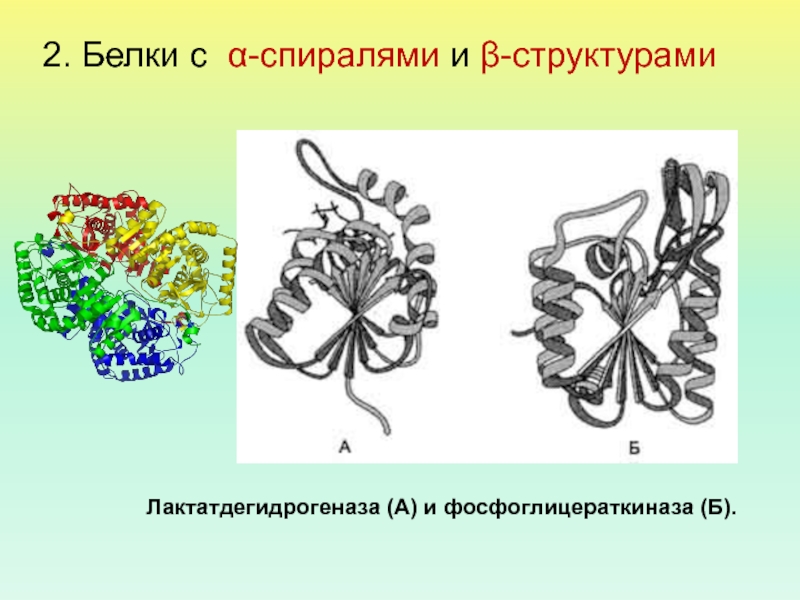
- 48. 2. Белки с α-спиралями и β-структурами Лактатдегидрогеназа (А) и фосфоглицераткиназа (Б).
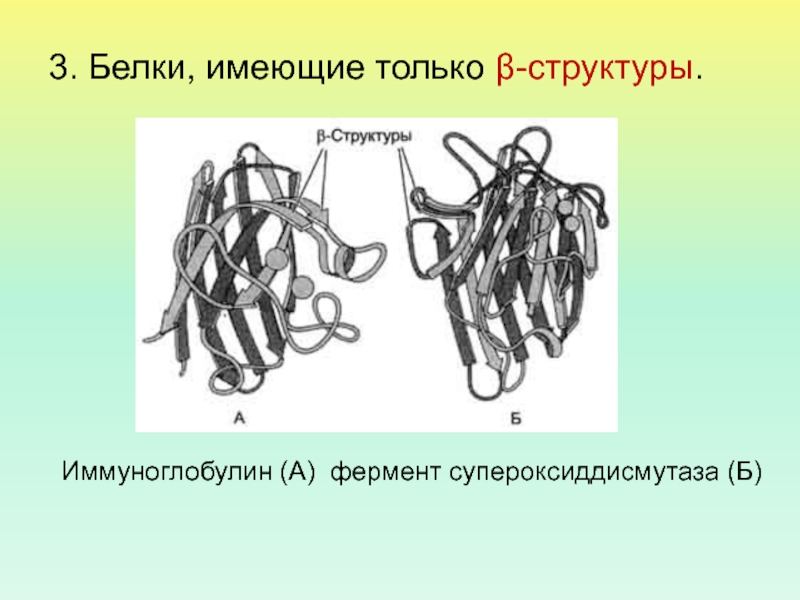
- 49. 3. Белки, имеющие только β-структуры. Иммуноглобулин (А) фермент супероксиддисмутаза (Б)
- 50. 4.Белки, имеющие в своём составе лишь незначительное
- 51. Скачать презентанцию
Слайды и текст этой презентации
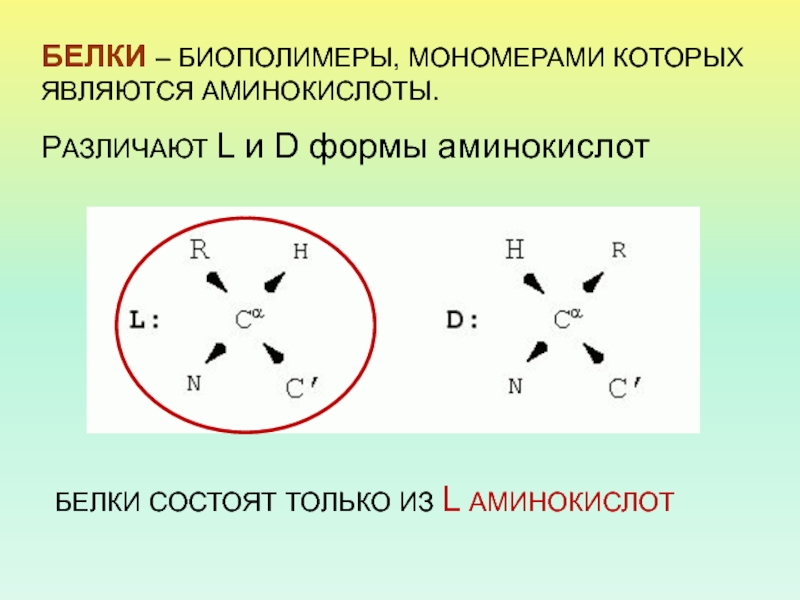
Слайд 4
БЕЛКИ – БИОПОЛИМЕРЫ, МОНОМЕРАМИ КОТОРЫХ ЯВЛЯЮТСЯ АМИНОКИСЛОТЫ.
РАЗЛИЧАЮТ L и
D формы аминокислот
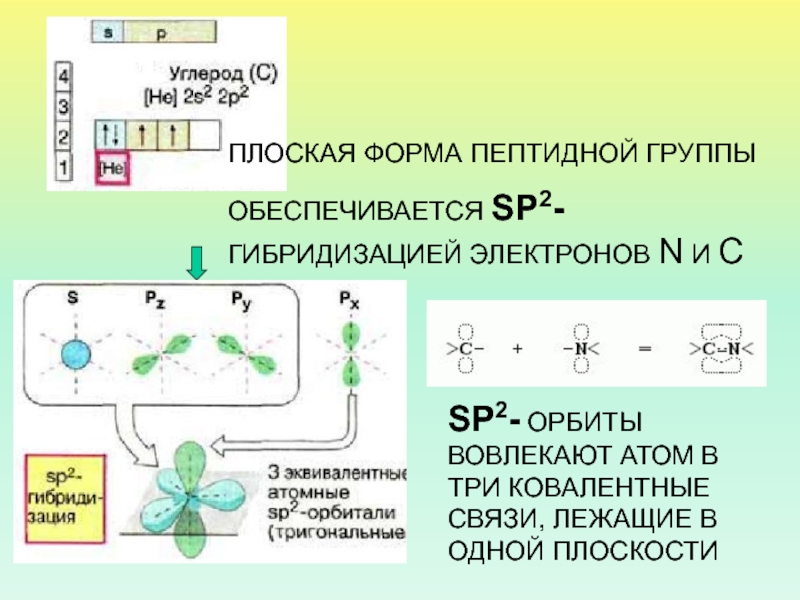
Слайд 11ПЛОСКАЯ ФОРМА ПЕПТИДНОЙ ГРУППЫ
ОБЕСПЕЧИВАЕТСЯ SP2-ГИБРИДИЗАЦИЕЙ ЭЛЕКТРОНОВ N И C
SP2-
ОРБИТЫ ВОВЛЕКАЮТ АТОМ В ТРИ КОВАЛЕНТНЫЕ СВЯЗИ, ЛЕЖАЩИЕ В ОДНОЙ
ПЛОСКОСТИ
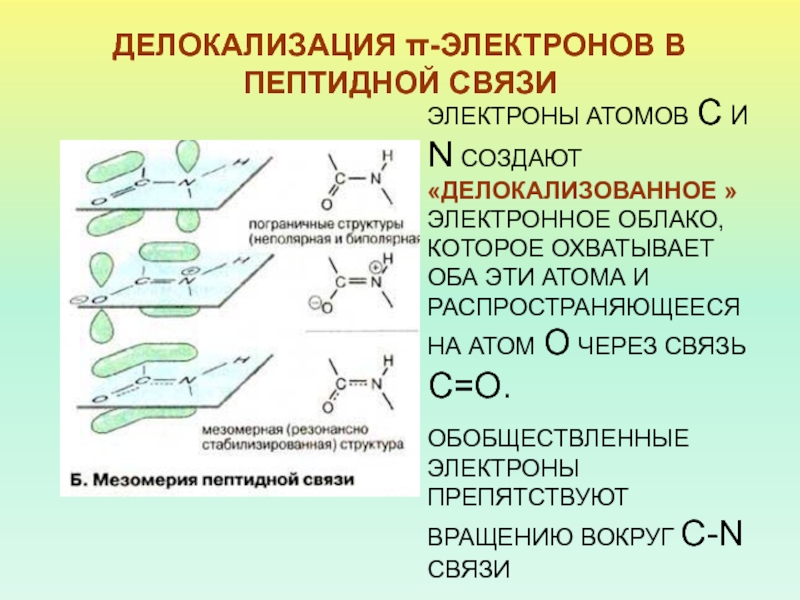
Слайд 12ДЕЛОКАЛИЗАЦИЯ π-ЭЛЕКТРОНОВ В ПЕПТИДНОЙ СВЯЗИ
ЭЛЕКТРОНЫ АТОМОВ С И N СОЗДАЮТ
«ДЕЛОКАЛИЗОВАННОЕ » ЭЛЕКТРОННОЕ ОБЛАКО, КОТОРОЕ ОХВАТЫВАЕТ ОБА ЭТИ АТОМА И
РАСПРОСТРАНЯЮЩЕЕСЯ НА АТОМ О ЧЕРЕЗ СВЯЗЬ С=О.ОБОБЩЕСТВЛЕННЫЕ ЭЛЕКТРОНЫ ПРЕПЯТСТВУЮТ ВРАЩЕНИЮ ВОКРУГ C-N СВЯЗИ
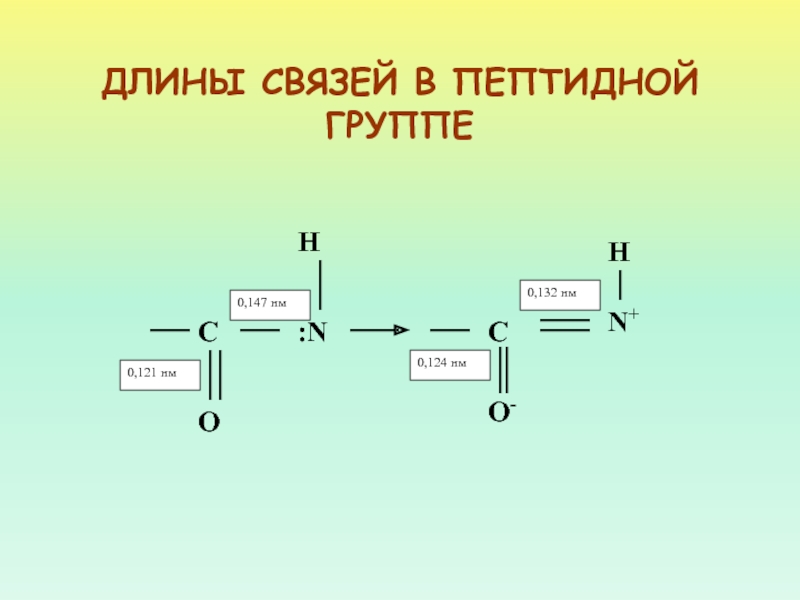
Слайд 15ДЛИНЫ СВЯЗЕЙ
N – C (ПЕПТИДНАЯ СВЯЗЬ) 0,132 НМ
N – C
(ОДИНОЧНАЯ) 0,147 НМ
N
= C (ДВОЙНАЯ) 0,125 НМ0,147 < 0,132 < 0,125
ПЕПТИДНАЯ СВЯЗЬ ЗАНИМАЕТ ПРОМЕЖУТОЧНОЕ ПОЛОЖЕНИЕ
Слайд 17ВАЛЕНТНЫЕ УГЛЫ СОСТАВЛЯЮТ ОКОЛО 120о И 109о
120о - ПРИ SP2-ГИБРИДИЗИРОВАННЫХ
ОРБИТАЛЯХ -С
ВЕРШИНАМ ПЛОСКОГО ТРЕУГОЛЬНИКА109о - ПРИ SP3-ГИБРИДИЗИРОВАННЫХ АТОМАХ >Сα< , ГДЕ ЧЕТЫРЕ СВЯЗИ НАПРАВЛЕНЫ ИЗ ЦЕНТРА К ВЕРШИНАМ ТЕТРАЭДРА.
Слайд 18ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ВАЛЕНТНЫЕ СВЯЗИ НЕ ФЛУКТУИРУЮТ:
ЧАСТОТА КОЛЕБАНИЙ ЭТИХ
СВЯЗЕЙ 2х1013 сек –1
ЧАСТОТА ТЕПЛОВЫХ КОЛЕБАНИЙ 7х1012 сек –1
АМПЛИТУДА ТЕПЛОВЫХ
КОЛЕБАНИЙ ВАЛЕНТНЫХ УГЛОВ НЕВЕЛИКА И СОСТАВЛЯЕТ ОКОЛО 5о.ТАКИМ ОБРАЗОМ, ГИБКОСТЬ ПОЛИПЕПТИДНОЙ ЦЕПИ ОБЕСПЕЧИВАЕТСЯ ДРУГИМИ ФАКТОРАМИ.
Слайд 19ГИБКОСТЬ ПОЛИПЕПТИДНОЙ ЦЕПИ, А, ЗНАЧИТ, И
ЕЕ СПОСОБНОСТЬ ОБРАЗОВЫВАТЬ СПИРАЛИ
И
ГЛОБУЛЫ ОБЕСПЕЧИВАЕТ ВРАЩЕНИЕ ВОКРУГ
ВАЛЕНТНЫХ СВЯЗЕЙ.
Слайд 20
Отсчет величины угла поворота:
вид поперек (слева) и вдоль (справа)
оси вращения.
Дальняя от нас валентная связь 0''— c —
"ось координатного круга", центральная связь 0'— 0'' — "ось вращения",
ближняя к нам связь 0'— a — "стрелка на координатном круге".
Слайд 21
УГОЛ ϕ ОПИСЫВАЕТ ВРАЩЕНИЕ ВОКРУГ СВЯЗИ N – C α
УГОЛ
ψ ОПИСЫВАЕТ ВРАЩЕНИЕ ВОКРУГ СВЯЗИ C α – C
УГОЛ
ω ОПИСЫВАЕТ ВРАЩЕНИЕ ВОКРУГ СВЯЗИ C - N χ- УГОЛ ВРАЩЕНИЯ В БОКОВОЙ ЦЕПИ
ϕ
ω
ψ
χ
Слайд 22ПОВОРОТ ВОКРУГ СВЯЗИ С-N (УГОЛ ω) МАЛОВЕРОЯТЕН ИЗ-ЗА ЕЕ ЧАСТИЧНО
ДВОЙНОГО ХАРАКТЕРА.
ЗАТО ВОЗМОЖНЫ ПОВОРОТЫ ВОКРУГ ОДИНАРНЫХ СВЯЗЕЙ Cα-C (УГОЛ ψ)
И C α -N (УГОЛ ϕ) ЕА ДЛЯ УГЛОВ ϕ И ψ ОТ 0,84 ДО 2,52 кДж/моль, ДЛЯ ПЕПТИДНОЙ СВЯЗИ 84 кДж/моль
Слайд 26НАИБОЛЕЕ ВАЖНЫМИ ДЛЯ ВТОРИЧНОЙ
СТРУКТУРЫ БЕЛКА ЯВЛЯЮТСЯ ВОДОРОДНЫЕ
СВЯЗИ
Водородные связи
параллельны оси спирали
Водородные связи перпендикулярны оси спирали
β-СКЛАДЧАТАЯ СТРУКТУРА
α-СПИРАЛЬ
Слайд 28
-спираль может быть правозакрученной (ϕ=132о, ψ=123о) и левозакрученной (ϕ =228о, ψ=237о).
ПРАВЫЕ
ЛЕВЫЕ
Слайд 29
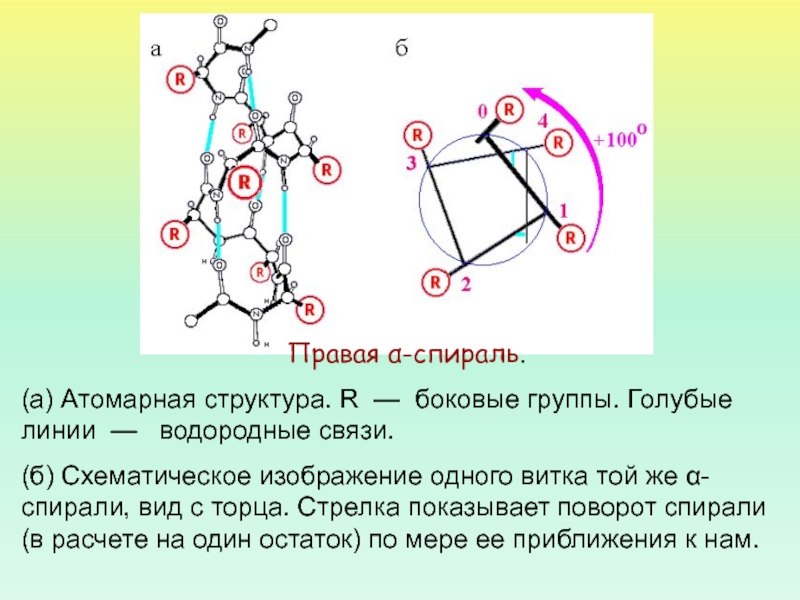
Правая α-спираль.
(а) Атомарная структура. R — боковые группы. Голубые
линии — водородные связи.
(б) Схематическое изображение одного витка той
же α-спирали, вид с торца. Стрелка показывает поворот спирали (в расчете на один остаток) по мере ее приближения к нам. Слайд 30Водородные связи в α спирали
параллельны оси спирали
образуются между первым
и четвертым аминокислотными остатками
Слайд 31НА КАЖДЫЙ ВИТОК (ШАГ) СПИРАЛИ ПРИХОДИТСЯ 3,6 АМИНОКИСЛОТНЫХ ОСТАТКОВ.
ШАГ СПИРАЛИ
(РАССТОЯНИЕ ВДОЛЬ ОСИ) – 0,54 НМ.
НА ОДИН АМИНОКИСЛОТНЫЙ ОСТАТОК ПРИХОДИТСЯ
0,15 НМ.ЧЕРЕЗ 5 ВИТКОВ СПИРАЛИ (18 АМИНОКИСЛОТНЫХ ОСТАТКОВ) СТРУКТУРНАЯ КОНФИГУРАЦИЯ ПОЛИПЕПТИДНОЙ ЦЕПИ ПОВТОРЯЕТСЯ
ПАРАМЕТРЫ α-СПИРАЛИ
Слайд 32ПОСТУЛАТЫ ПОЛИНГА – КОРИ
Длины связей и валентных углов всех пептидных
групп одинаковы
Полипептидная цепь насыщена водородными связями
Конформационное состояние всех звеньев полипептидной
цепи является эквивалентным Слайд 33Некоторые остатки аминокислот могут нарушать формирование α-спирали.
ПРОЛИН
Его атом азота входит
в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH-
связи.Пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб.
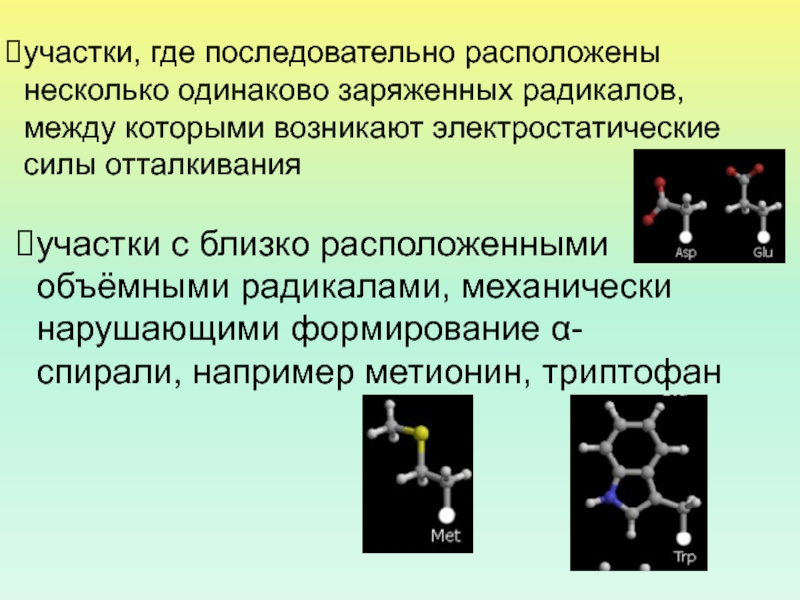
Слайд 34участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми
возникают электростатические силы отталкивания
участки с близко расположенными объёмными радикалами, механически
нарушающими формирование α-спирали, например метионин, триптофанСлайд 39
ИМЕЮТСЯ СПИРАЛИ И БЕЗ ВОДОРОДНЫХ СВЯЗЕЙ,
КОТОРЫЕ СУЩЕСТВУЮТ ЗА СЧЕТ
ВАНДЕРВААЛЬСОВЫХ СИЛ.
ЭТО ПОЛИПРОЛИНОВАЯ
СПИРАЛЬ, КОТОРАЯ РЕАЛИЗУЕТСЯ В КОЛЛАГЕНЕ.
Слайд 40Нерегулярные вторичные структуры
ТРИПСИН:
ПОЛИПЕПТИДНАЯ ЦЕПЬ СПИРАЛИЗОВАНА НА 30%
Области с
нерегулярной вторичной структурой, которые представлены петлеобразными и кольцеобразными структурами, имеющими
меньшую регулярность укладки, чем α-спиралъ и β-структура.ГЕМОГЛОБИН:
ПОЛИПЕПТИДНЫЕ ЦЕПИ СПИРАЛИЗОВАНЫ НА 75%
Слайд 41ДРУГИЕ СПИРАЛЬНЫЕ КОНФОРМАЦИИ
СПИРАЛЬ 310
3 ОСТАТКА АМИНОКИСЛОТ НА ШАГ (ВИТОК)
СПИРАЛИ
РАДИУС 0,19 НМ
СПИРАЛЬ
4,4 ОСТАТКА НА ШАГ СПИРАЛИ
РАДИУС 0,28 НМ
Слайд 43СВЕРХВТОРИЧНЫЕ СТРУКТУРЫ –
ЭТО ТЕРМОДИНАМИЧЕСКИ ИЛИ КИНЕТИЧЕСКИ
СТАБИЛЬНЫЕ КОМПЛЕКСЫ α-СПИРАЛЕЙ
И
βСТРУКТУР, КОТОРЫЕ ФОРМИРУЮТСЯ ЗА
СЧЕТ МЕЖРАДИКАЛЬНЫХ ВЗАИМОДЕЙСТВИЙ.
Слайд 46СУПЕРСПИРАЛЬ, СОСТОЯЩАЯ ИЗ НЕСКОЛЬКИХ α-СПИРАЛЕЙ
В ПЕРЕВИТЫХ СПИРАЛЯХ ПЕРИОДИЧНОСТЬ 3,5 ОСТАТКОВ
НА ВИТОК (ВМЕСТО 3,6 В ОДИНОЧНОЙ α-СПИРАЛИ )
Слайд 47
Взаимодействие α-спиралей в двойной (а) и тройной (б) суперспирали (вид
с торца спирали). В двойной суперспирали непосредственно контактируют с другой
спиралью только остатки а и d, а в тройной — еще и остатки e и g (хотя и более слабо).