Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Побочная подгруппа I группы периодической системы 19 мая в 16 20 состоится
Содержание
- 1. Побочная подгруппа I группы периодической системы 19 мая в 16 20 состоится
- 2. Слайд 2
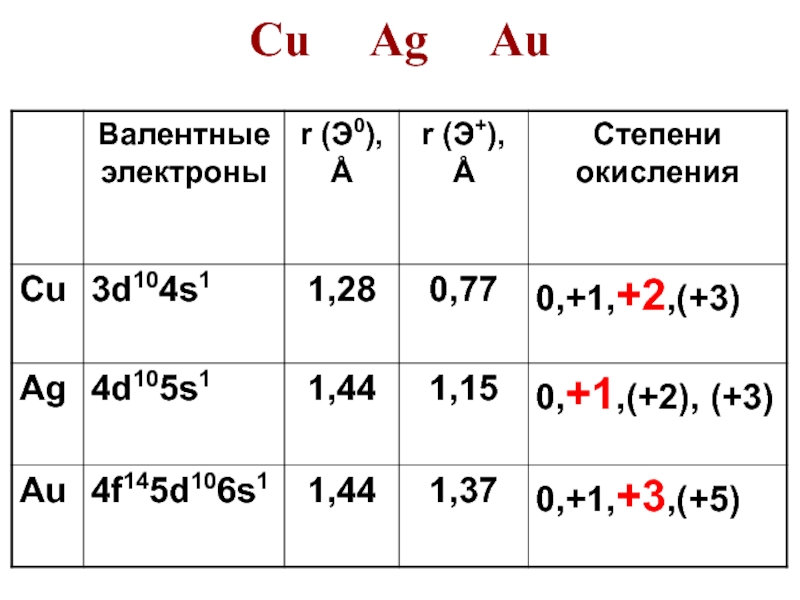
- 3. Cu Ag Au
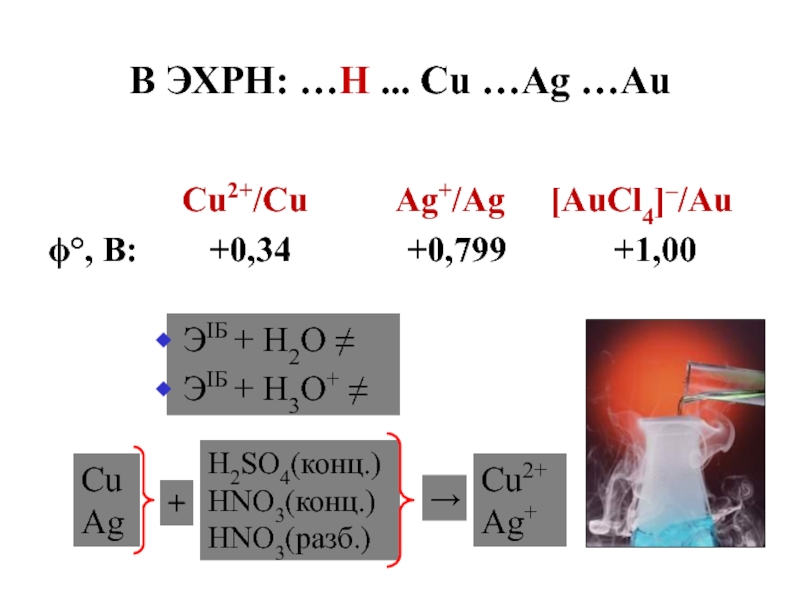
- 4. В ЭХРН: …H ... Cu …Ag …Au
- 5. Cu – 25 место; CuFeS2 (халькорипит),
- 6. Известны с древнейших временСu – гр. «кипрос»
- 7. 2Сu2S + 3O2 = 2Cu2O + 2SO2
- 8. Цианидный способ для извлечения Ag и AuРазработан
- 9. Добыча золота
- 10. Свойства простых веществCu + X2 = CuX2
- 11. Реакции с кислотами-окислителямиCu + 2H2SO4 конц. =
- 12. Ox-red свойства В кислой среде устойчивы Cu2+
- 13. Соединения Cu+Эл. конфигурация: d10 , Почти все
- 14. Н/р соли: CuX (X = Cl, Br,
- 15. Получение нерастворимых солей:Cu2+ + 3I– = CuI
- 16. Cu2+ + 2OH– = Cu(OH)2↓ голубойРастворяется в
- 17. Нерастворимы в воде: CuS, CuCO3Растворимы в воде:
- 18. Ag+ – окислительные свойства. Ag+ + 1e
- 19. 2Ag+ + 2OH– = Ag2O↓ + H2O
- 20. Комплексы Ag+Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+
- 21. Au+Н/р соли: AuX ( X = Cl,
- 22. Au3+Сильные окислители, в основном, комплексы.[AuCl4]– + 3OH–
- 23. Побочная подгруппа II группы периодической системы
- 24. Слайд 24
- 25. Валентные электроны:Zn: [Ar]3d104s2Cd:[Kr]4d105s2Hg: [Xe]4f145d106s2 Zn Cd Hg
- 26. Zn – 24 место; ZnS (сфалерит), ZnO
- 27. Открытие элементовZn – производство в Индии с
- 28. ПолучениеZn и Cd В природе: ZnS –
- 29. Hg В природе: HgS (киноварь), самородная ртуть
- 30. Свойства простых веществZn, Cd – легкоплавкие активные
- 31. Свойства простых в-вM + H2SO4 разб =
- 32. Сравнение соединений Zn и CdСходство:Растворимые соли: MX2
- 33. Оксиды/гидрокcидыZnO/Zn(OH)2 – амфотерные свойства:Zn(OH)2 + H2SO4 =
- 34. АмальгамыMxHgy в зависимости от соотношения x и
- 35. Hg2+Hg + ½O2 = HgO красный оксид
- 36. Соли Hg2+Гидролиз сильных электролитов:Hg2+ + NO3– +H2O
- 37. Соли Hg22+ (ст.ок. 1+)Hg (изб.) + HNO3
- 38. [H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X]Растворимые соли: Hg2(NO3)2, Hg2F2Нерастворимые соли: Hg2X2
- 39. Ox-red реакции1) Hg + HNO3 разб =
- 40. Сравнение Hg(NO3)2 и Hg2(NO3)2
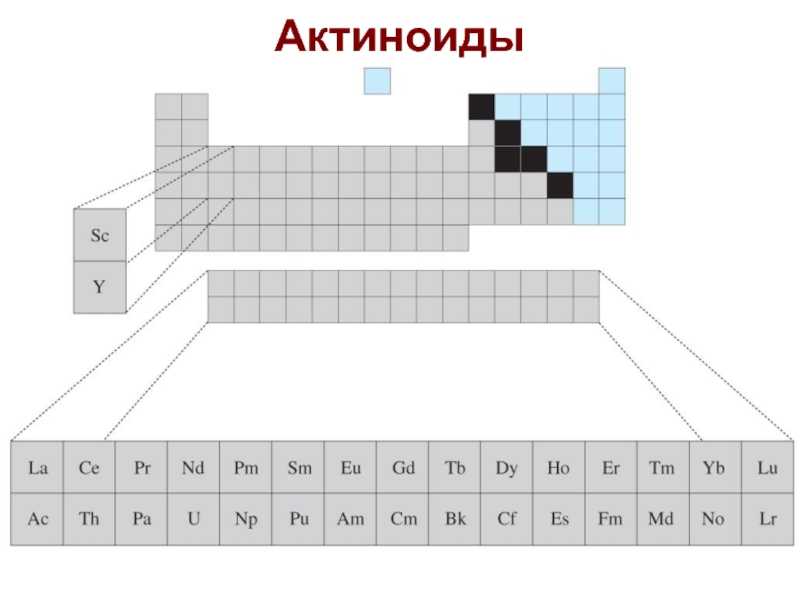
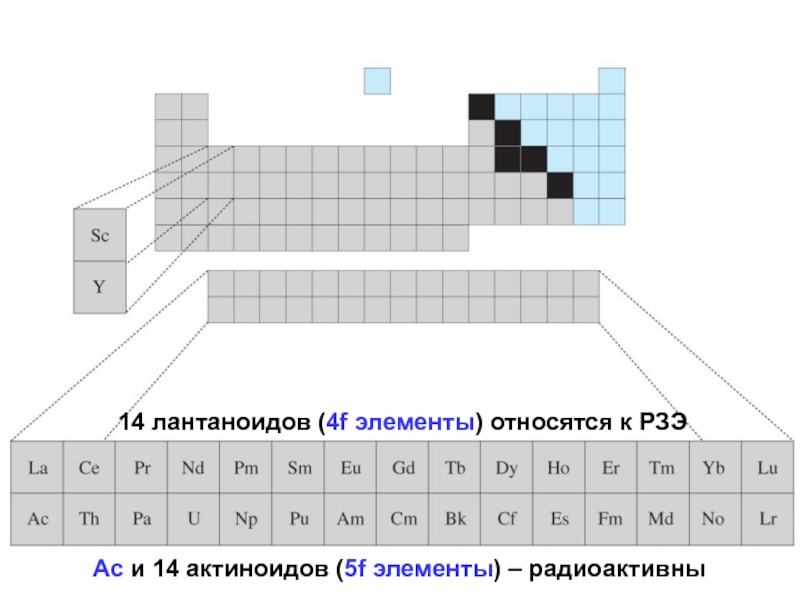
- 41. Побочная подгруппа III группы периодической системы(f-элементы)
- 42. 14 лантаноидов (4f элементы) относятся к РЗЭ Ac и 14 актиноидов (5f элементы) – радиоактивны
- 43. Распространенность РЗЭПрометий Pm – радиоактивен 145Pm61 t1/2
- 44. Sc и РЗЭ Активные металлы 2Э +
- 45. Лантаноидное сжатиеУ лантаноидов (как и у актиноидов)
- 46. Основные соединенияОксиды M2O3 – тугоплавкие, плохо растворимы
- 47. Ce 4f26s2
- 48. Степень окисления +4Ce4+: [Xe] CeO2, CeF4 Pr4+: [Xe]4f1
- 49. Степени окисления +2Sm2+: [Xe]4f6 SmI2Eu2+: [Xe]4f7 EuO,
- 50. Комплексы лантаноидовАквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за
- 51. Актиноиды
- 52. АктиноидыАктиноидное сжатие – уменьшение R(M3+) от 1,26
- 53. АктиноидыВсе радиоактивны232Th t1/2 = 3,28.1010 лет; 238U t1/2=
- 54. Ac (актиний), Th (торий), Pa (протактиний)Ac3+ -
- 55. Pa5+ – похож на Nb5+ и Ta5+
- 56. Атомная станция Фукусима-1235UO2 – топливо
- 57. U238U – 99% t1/2= 4.5 млрд. лет235U
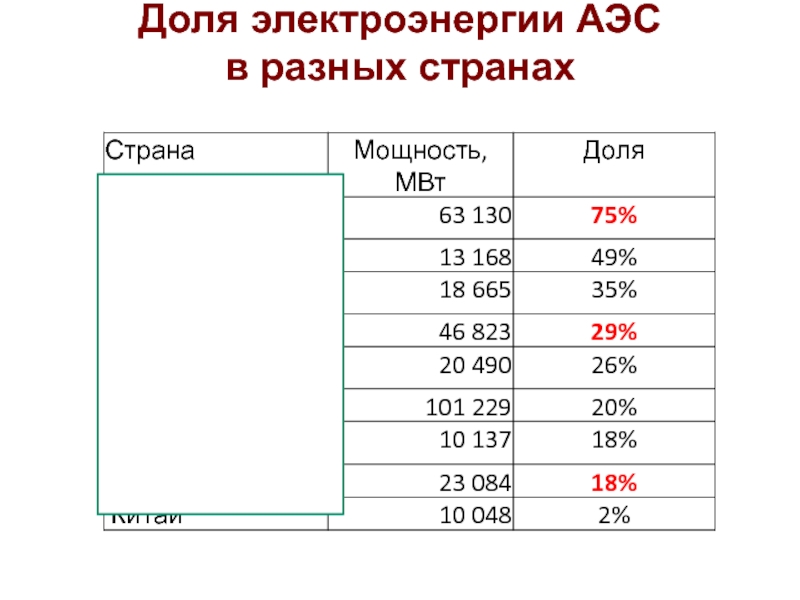
- 58. Доля электроэнергии АЭС в разных странах
- 59. ПрименениеЯдерное горючее – 235U, 238U, 239Pu В перспективе
- 60. Ядерные реакцииОбразование трансурановых элементов в ядерном реакторе
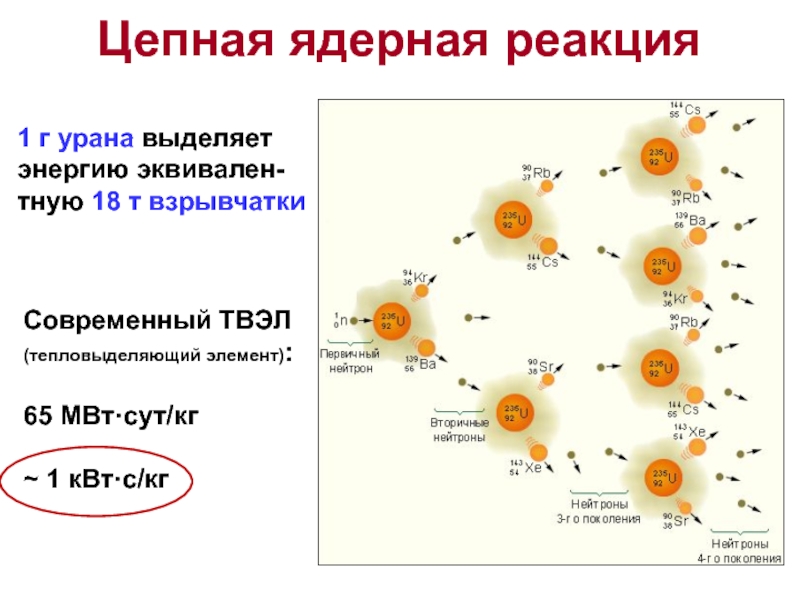
- 61. Цепная ядерная реакция1 г урана выделяетэнергию эквивален-
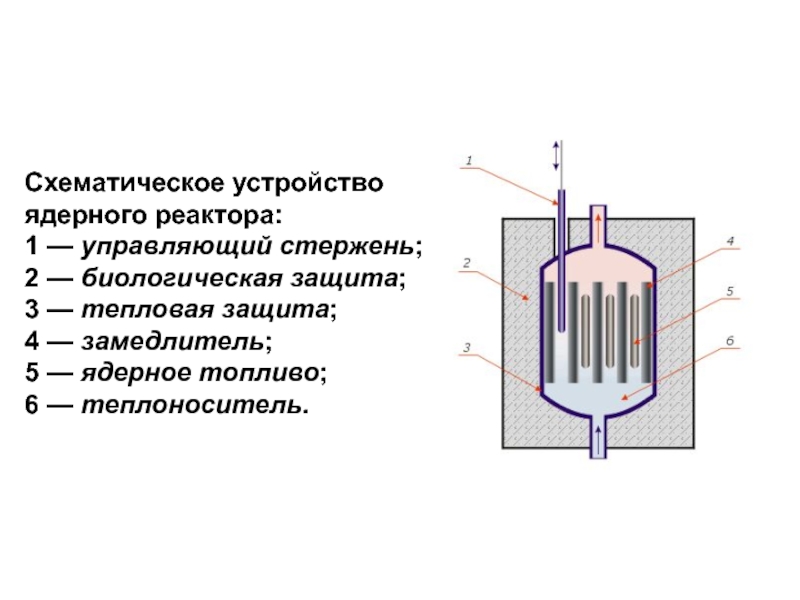
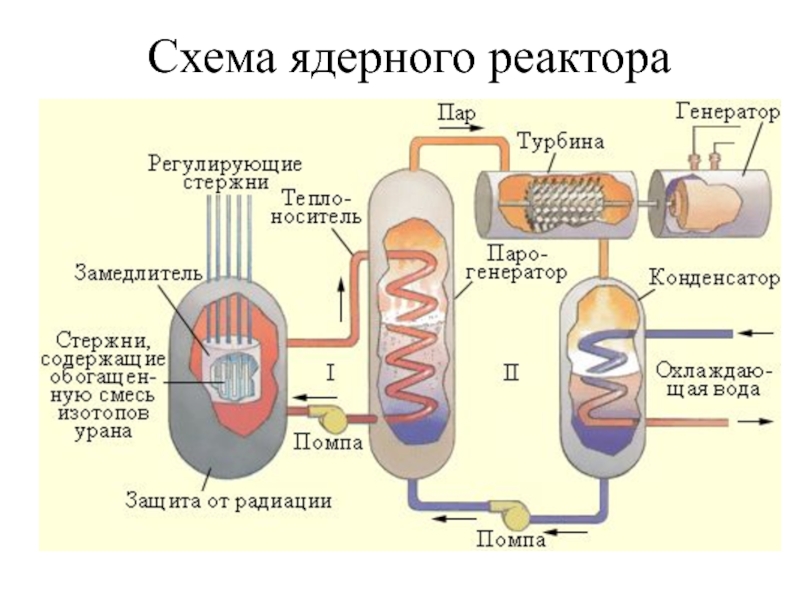
- 62. Схематическое устройство ядерного реактора: 1 —
- 63. Схема ядерного реактора
- 64. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4В ЭХРН: …H ... Cu …Ag …Au
Сu2+/Cu Ag+/Ag
[AuСl4]–/Au, В: +0,34 +0,799 +1,00
ЭIБ + H2O
ЭIБ + H3O+
CuAg
H2SO4(конц.) HNO3(конц.) HNO3(разб.)
Cu2+ Ag+
Слайд 5Cu – 25 место; CuFeS2 (халькорипит), Cu2S (халькозин), 2CuCO3.Cu(OH)2 (азурин),
CuCO3.Cu(OH)2 (азурин), самородная Cu
Ag – 70; Ag2S (аргентин), самородное Ag
Au
– 75; самородное Au, Au2Te (калавит)CuCO3.Cu(OH)2 (малахит)
самородное Ag
Распространенность и минералы
Слайд 6Известны с древнейших времен
Сu – гр. «кипрос» - остров Кипр.
Ag
– гр. «аргос» - блестящий.
Au – лат. «аурум» - желтый.
Открытие
элементовСлайд 72Сu2S + 3O2 = 2Cu2O + 2SO2 (обжиг)
Cu2S + 2Cu2O
= 4Cu + SO2 (томление, без O2)
Рафинирование: электролиз
Извлечение при
цианировании:Cu + H2O + 2KCN = K[Cu(CN)2] + 1/2H2 + KOH
2 = 1016
Получение
Слайд 8Цианидный способ для извлечения Ag и Au
Разработан в 1843 г.
в России
2M + H2O + 4KCN + ½O2 = 2K[M(CN)2]
+ 2KOHM = Ag (2 = 7.1019); Au (2 = 2.1038)
2K[M(CN)2] + Zn = K2[Zn(CN)4] + 2M
Получение
Слайд 10Свойства простых веществ
Cu + X2 = CuX2 (X = Cl,
Br)
Cu + ½I2 = CuI
Cu + O2 = CuO
Cu +
S = CuS2Ag + X2 = 2AgX (X = Cl, Br, I)
Ag + F2 = AgF2
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Слайд 11Реакции с кислотами-окислителями
Cu + 2H2SO4 конц. = CuSO4 + SO2
+ 2H2O
Cu + 4HNO3 конц. = Cu(NO3)2 + 2NO2 +
2H2O2Ag + H2SO4 конц. = Ag2SO4 + SO2 + 2H2O
Ag + 2HNO3 конц. = AgNO3 + NO2 + H2O
Ag + царская водка = нет реакции (AgCl↓)
2Au + 6H2SeO4 распл. = Au2(SeO4)3 + 3SeO2 +6H2O
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Слайд 12Ox-red свойства
В кислой среде устойчивы Cu2+ и Ag+;
В
кислой среде диспропорционируют Cu+ и Au+;
Комплексообразование и образование нерастворимых
соединений стабилизирует эти степени окисления;Cu3+, Ag3+, Au3+ – сильные окислители, сила уменьшается в этом ряду.
Слайд 13Соединения Cu+
Эл. конфигурация: d10 ,
Почти все соединения бесцветны.
НО!
Cu2O – красного цвета.
4Cu2+ + 8OH– + N2H4 =
2Cu2O + N2 + 6H2OСвойства:
Cu2O + 2HCl = 2CuCl + H2O
CuCl + HCl изб. = H[CuCl2] бесцв.
CuCl + 2NH3 = [Cu(NH3)2]Cl бесцв.
Слайд 14Н/р соли: CuX (X = Cl, Br, I, CN, SCN).
CuF
– неизвестен.
Растворимые соли Cu+ в водных р-рах не сущ-ют!!!
2Сu+ =
Cu2+ + Cu0 K298 = 106Cu2O + H2SO4 разб = CuSO4 + Cu + H2O
Cu2O + 3H2SO4 конц = 2CuSO4 + SO2 + 3H2O
Соединения Cu+
Слайд 15Получение нерастворимых солей:
Cu2+ + 3I– = CuI + I2
2Cu2+ +
4CN– = 2CuCN + (CN)2
(добавление KCN к кипящему раствору CuSO4)
CuCl2
+ Cu = 2CuCl(нагревание в растворе HCl)
Устойчивы и растворимы комплексы:
[Cu(CN)2]–, [CuCl2]–, [CuI2]–.
Соединения Cu+
Слайд 16Cu2+ + 2OH– = Cu(OH)2↓ голубой
Растворяется в кислотах и щелочах.
Сu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2OH– =
[Cu(OH)4]2– купраты(II)Соединения Cu2+
Слайд 17Нерастворимы в воде: CuS, CuCO3
Растворимы в воде:
CuX2 (X =
Cl, Br, NO3, ½SO4, ClO4, OAc)
CuSO4 – б/цв
CuSO4.5H2O – голубой
(медный купорос)CuCl2 – коричневый
CuCl2.6H2O – зеленый; в конц. р-рах зеленый, в разб. р-рах голубой
Соединения Cu2+
Слайд 18Ag+ – окислительные свойства.
Ag+ + 1e = Ag0, E0
= 0,80 В
AgNO3 – ляпис, «адский камень», используется в
медицине для прижигания и стерилизации ран.2Ag+ + Zn = 2Ag + Zn2+
Ag+ + C6H12O6 (глюкоза) – «серебряное зеркало»
Соединения Ag+
Слайд 192Ag+ + 2OH– = Ag2O↓ + H2O (бурый, основный)
Ag2O +
2HF = 2AgF + H2O
Ag2O + 2HNO3 = 2AgNO3 +
H2OAgOH – очень неустойчив,
сильное основание.
Растворимые: AgNO3 (практ. не гидролизуется), AgF
Н/р соли: AgX (X = Cl, Br, I, CN, SCN, ½S, ½CO3, 1/3PO4, ½CrO4 и др).
Соединения Ag+
Слайд 20Комплексы Ag+
Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH–
AgCl↓ +
2NH3 = [Ag(NH3)2]+ + Cl–
2 = 107
AgBr, AgI не
растворимы в водном NH3AgX↓ + 2CN– = [Ag(CN)2]– + X– (X = Cl, Br, I)
AgX↓ + 2S2O32– = [Ag(S2O3)2]3– + X– (X = Cl, Br, I)
2([Ag(CN)2]–) = 1020; 2([Ag(S2O3)2]3–) = 1013
Слайд 21Au+
Н/р соли: AuX ( X = Cl, Br, I, CN).
Диспропорционируют
даже н/р:
3AuCl↓ + H2O = 2Au + [AuCl3(OH)]– + H+
Устойчивые
комплексы:[AuCl2]–, [Au(CN)2]–, [Au(S2O3)2]3–
Au2O и AuOH плохо охарактеризованы
Слайд 22Au3+
Сильные окислители,
в основном, комплексы.
[AuCl4]– + 3OH– = Au(OH)3↓+ 4Cl–
Красно-коричневый,
амфотерный.
Au(OH)3 + KOH =K[Au(OH)4] гидроксоаурат
Au(OH)3 + 4HCl = H[AuCl4]
+ 3H2O(золотохлороводородная кислота)
2Au(OH)3 = Au2O3 + 3H2O (ниже 150 oC)
4Au2O3 = 4Au + 2Au2O +5O2 (выше 150 oC)
Слайд 26Zn – 24 место; ZnS (сфалерит), ZnO (цинкит).
Cd – 48
место; CdS (гринокит), CdCO3 (отавит).
Hg – 57 место, HgS (киноварь)
и самородная ртуть.Содержание в земной коре и минералы
Слайд 27Открытие элементов
Zn – производство в Индии с XII века; сплав
с медью (латунь) до н.э.; возможно от нем. Zinn (олово).
Cd
– 1817 г., нем. Штромейер; греч. «кадмия» – цинковая руда.
Hg – известна с ~1500 г. до н.э.; Меркурий – ближайшая к Солнцу планета; лат. Hydrargirum – серебряная вода.
Слайд 28Получение
Zn и Cd
В природе: ZnS – сфалерит (цинковая обманка),
Cd сопутствует Zn в рудах
ZnS + 3/2O2 =
ZnO +SO2 (обжиг)Пирометаллургия: ZnO + C = CO + Zn (1300 oC), Cd отделяют перегонкой
Гидрометаллургия:
ZnO + H2SO4 = ZnSO4 + H2O
Катод: Zn2+ +2e- = Zn0
Слайд 29Hg
В природе: HgS (киноварь), самородная ртуть
HgS + O2
= Hg + SO2 (обжиг)
HgS + Fe = Hg +
FeSHgO = Hg + ½O2 ( 500 oC)
Получение
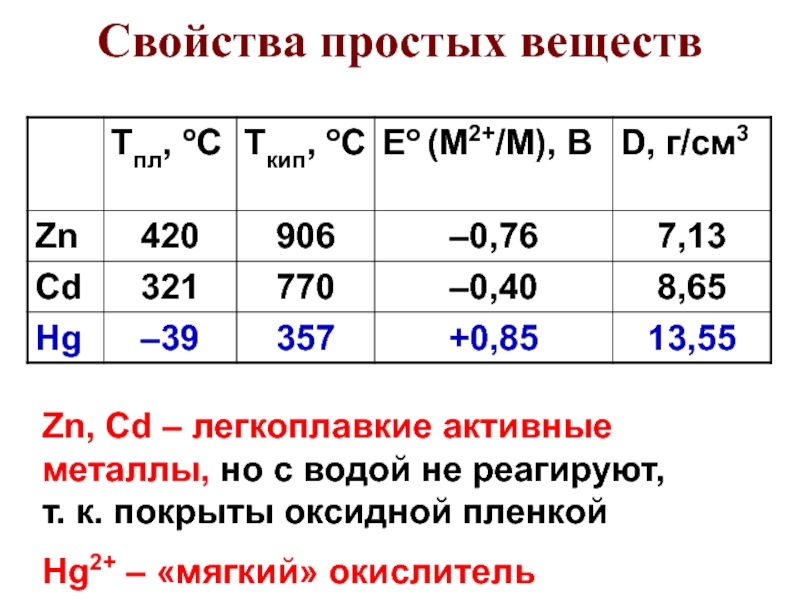
Слайд 30Свойства простых веществ
Zn, Cd – легкоплавкие активные металлы, но с
водой не реагируют,
т. к. покрыты оксидной пленкой
Hg2+ – «мягкий»
окислительСлайд 31Свойства простых в-в
M + H2SO4 разб = MSO4 + H2
(M = Zn, Cd)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4]
+ H2Сd + NaOH = нет реакции
Кислоты окислители:
4Zn + 10HNO3 разб = 4Zn(NO3)2 +NH4NO3 + 3H2O
4Cd + 10HNO3 разб = 4Cd(NO3)2 +N2O + 5H2O
3Hg + 8HNO3 разб = 3Hg(NO3)2 +2NO + 4H2O
Реакции с неметаллами: O2, S, галогены
Слайд 32Сравнение соединений Zn и Cd
Сходство:
Растворимые соли: MX2 (X = Cl,
Br, NO3, ½SO4)
Н/р соли: M(CN)2 (белые), ZnS (белый), CdS (желтый)
Различие
в поведении растворов в воде:ZnCl2 = Zn2+ + 2Cl– (полная диссоциация)
CdBr2 = CdBr+ + Br– (α1 = 0,5)
CdBr+ = Cd2+ + Br– (α2 = 0,05)
Слайд 33Оксиды/гидрокcиды
ZnO/Zn(OH)2 – амфотерные свойства:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Zn(OH)2
+ 2NaOH = Na2[Zn(OH)4] цинкат
CdO/Cd(OH)2 – основные свойства:
Как Zn, но
реакции с конц. щелочами только при повышенной температуре HgO/гидроксида нет!!! – только основные свойства.
Слайд 34Амальгамы
MxHgy
в зависимости от соотношения x и y могут быть
жидкими или твердыми.
M = Na, Ag, Au, Al, Cu, Cd,
ZnFe – не образует амальгаммы
Химические свойства амальгам повторяют химические свойства металлов которые их составляют
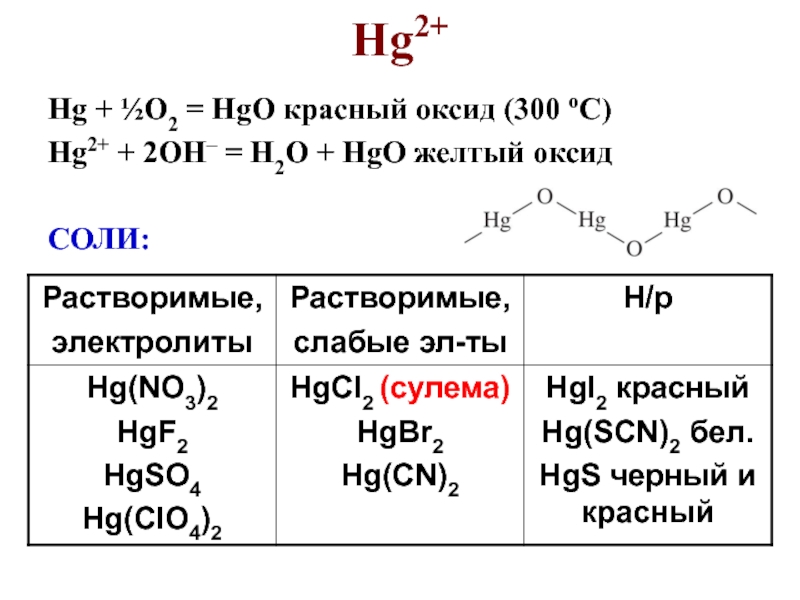
Слайд 36Соли Hg2+
Гидролиз сильных электролитов:
Hg2+ + NO3– +H2O = (HgOH)NO3↓ +
H+
белый осадок растворим при добавлении кислот
HgF2 + H2O = HgO↓
+ 2HF полный гидролиз
Гидролиз слабых электролитов:
HgCl2 = HgCl+ + Cl– ( ~ 0,01)
Hg(CN)2 – не гидролизуется, раствор практически не проводит эл. ток.
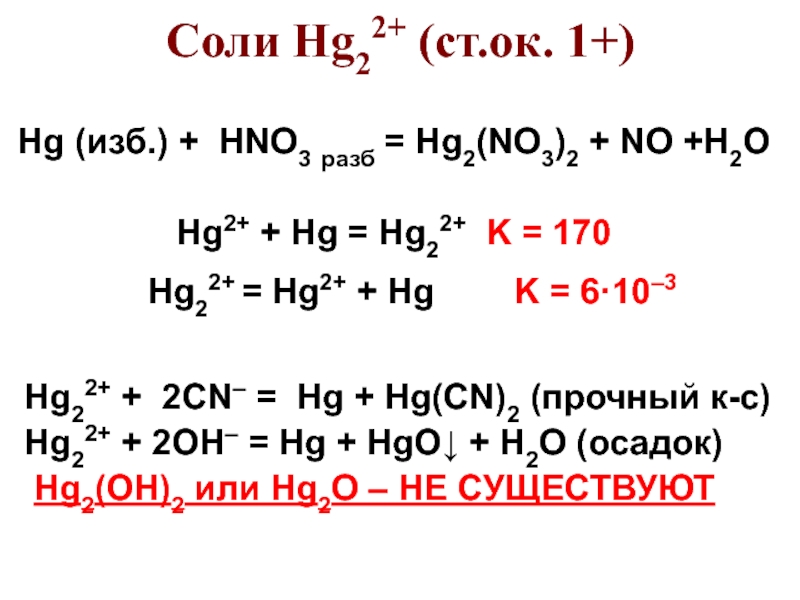
Слайд 37Соли Hg22+ (ст.ок. 1+)
Hg (изб.) + HNO3 разб = Hg2(NO3)2
+ NO +H2O
Hg2+ + Hg = Hg22+ K = 170
Hg22+
+ 2CN– = Hg + Hg(CN)2 (прочный к-с)Hg22+ + 2OH– = Hg + HgO↓ + H2O (осадок)
Hg2(OH)2 или Hg2O – НЕ СУЩЕСТВУЮТ
Hg22+ = Hg2+ + Hg K = 6·10–3
Слайд 38[H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X]
Растворимые соли: Hg2(NO3)2, Hg2F2
Нерастворимые соли: Hg2X2 (X = Cl,
Br, I)
Гидролиз растворимых солей:
Hg2(NO3)2 + H2O = Hg2(OH)NO3 +
HNO3 (мутнеет) Hg2F2 + H2O = HgO + Hg + 2HF (полный)
Hg2(OH)2 , Hg2O, HgCN, Hg2S – НЕ СУЩЕСТВУЮТ
Соли Hg22+ (ст.ок. 1+)
Слайд 39Ox-red реакции
1) Hg + HNO3 разб = Hg(NO3)2 + NO
+ H2O
Hg изб + HNO3 разб = Hg2(NO3)2 + NO
+ H2O2) Окисление:
Hg2(NO3)2+4HNO3 конц= 2Hg(NO3)2+2NO2 +2H2O
3) Восстановление:
2HgCl2 + SnCl2 недост = Hg2Cl2↓ + SnCl4
HgCl2 + SnCl2 изб = Hg↓ + SnCl4
Слайд 4214 лантаноидов (4f элементы) относятся к РЗЭ
Ac и 14 актиноидов
(5f элементы) – радиоактивны
Слайд 43Распространенность РЗЭ
Прометий Pm – радиоактивен 145Pm61 t1/2 = 26 лет.
Самый редкий из стабильных – тулий Tm (как иод), более
распространен, чем As, Cd, Hg и SeСамые распространенные La и Ce – сравнимы с Cu, Pb.
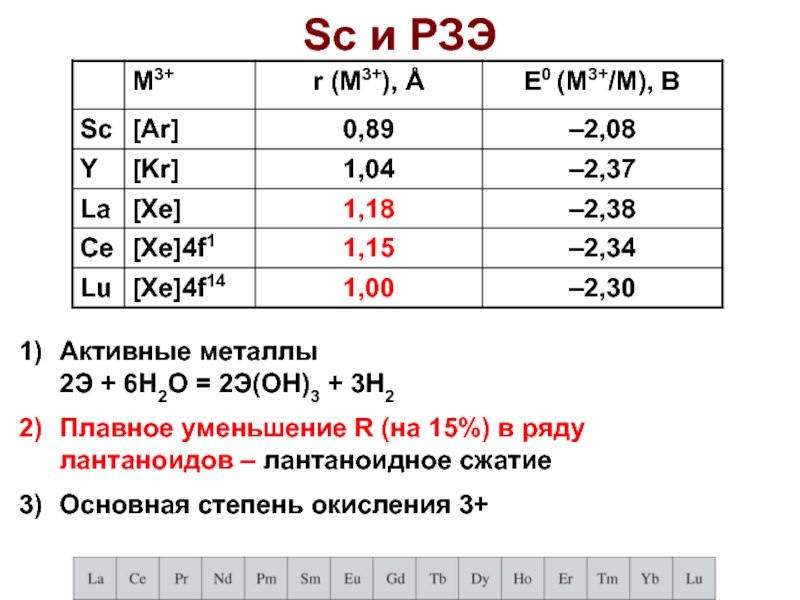
Слайд 44Sc и РЗЭ
Активные металлы
2Э + 6H2О = 2Э(ОН)3 +
3H2
Плавное уменьшение R (на 15%) в ряду лантаноидов – лантаноидное
сжатиеОсновная степень окисления 3+
Слайд 45Лантаноидное сжатие
У лантаноидов (как и у актиноидов) увеличение атомного номера
приводит не к повышению, а к понижению размеров атомов и
ионов. Причина этого явления, называемого лантаноидным сжатием, – неполное экранирование добавочными 4f-электронами уже имеющихся 4f-электронов. С ростом атомного номера РЗЭ увеличивается эффективный заряд ядра, воздействующий на каждый из f-электронов, а неполное экранирование последних вызывает смещение электронных оболочек атомов ближе к ядру.La(OH)3 → ……………………………. → Lu(OH)3 уменьшение основных свойств,
увеличение степени гидролиза солей
Слайд 46Основные соединения
Оксиды M2O3 – тугоплавкие, плохо растворимы в воде, растворимы
в кислотах.
Но: La2O3 + 3H2O = 2La(OH)3 (бурно).
Поглощают СО2 и
Н2О из воздуха → La2(СO3)3, La(OH)3.Гидроксиды M(OH)3 – плохорастворимые основания средней силы.
Растворимые соли – галогениды, нитраты, ацетаты, перхлораты.
Плохо растворимые соли – карбонаты, фосфаты, оксалаты, а также фториды (маленький катион и маленький анион).
Слайд 47 Ce 4f26s2
4f06s0 (Ce4+)
Eu 4f76s2
4f76s0 (Eu2+)Gd 4f75d16s2 4f76s0 (Gd3+)
Tb 4f96s2 4f76s0 (Tb4+)
Предполагается, что вакантная, заполненная наполовину и заполненная полностью f-оболочки обладают повышенной устойчивостью. Для большинства РЗЭ устойчива только степень окисления М3+, но для Се и Тb устойчиво также состояние М4+, а для Еu и Yb устойчиво также М2+.
Степени окисления
Слайд 48Степень окисления +4
Ce4+: [Xe] CeO2, CeF4
Pr4+: [Xe]4f1 PrO2 (P(O2)=280 атм,
400˚C); PrF4
Но устойчивы сложные оксиды, Pr5O9, Pr6O11, Pr7O12.
Сильные окислители, Pr4+
окисляет воду4Pr4+ + 2H2O = 4Pr3+ + O2 + 4H+
E0(Ce4+/Ce3+) = 1.2 B; E0(Pr4+/Pr3+) = 2.9 B
Получение соединений Ce4+:
Ce + O2 = CeO2 (горение, пирофорность)
2 Сe(OH)3 + 2OH– + Cl2 = 2 Ce(OH)4 + 2Cl– (pH > 7)
2Ce(OH)4 + 8HCl = 2CeCl3 + Cl2 + 8H2O (pH < 7)
Слайд 49Степени окисления +2
Sm2+: [Xe]4f6 SmI2
Eu2+: [Xe]4f7 EuO, EuX2, EuSO4 (н/р),
EuCO3 (н/р)
Yb2+: [Xe]4f14 YbO, YbX2, YbSO4
Cильные восстановители:
Sm2+ + H2O =
[SmOH]2+ + ½H2E0(Sm3+/Sm2+) = –1.55 B; E0(Eu3+/Eu2+) = –0.43 B;
E0(Yb3+/Yb2+) = –1.15 B
Получение:
EuCl3 + “H” = EuCl2 + HCl (Zn + HCl)
Как Ba2+!!!
Слайд 50Комплексы лантаноидов
Аквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9
с);
Предпочитают координацию по кислороду;
Высокие координационные числа и многообразие координационных полиэдров;
Маленький
Sc3+: [Sc(acac)3], KЧ = 6Средний Y3+: [Y(acac)3(H2O)], KЧ = 7
Большой La3+: [La(acac)3(H2O)2], КЧ = 8
Слайд 52Актиноиды
Актиноидное сжатие – уменьшение R(M3+) от 1,26 Å для Ac
до 1,02 Å для Lr
Металлический блеск, тугоплавкие, реакционноспособные, в ряду
напряжений левее Н, реагируют с О2, S, Н2, N2, X2Порошки на воздухе самовоспламеняются
3U + 4O2 = U3O8 – урановая смолка (UO2.2UO3)
Th + O2 = ThO2
Слайд 53Актиноиды
Все радиоактивны
232Th t1/2 = 3,28.1010 лет; 238U t1/2= 4,47.109 лет;
251Cf t1/2=
900 лет; 259No t1/2= 1,4 ч; 260Lr t1/2 = 3мин
Наиболее устойчивые
степени окисления:Слайд 54Ac (актиний), Th (торий), Pa (протактиний)
Ac3+ - похож на La 227Ac
t1/2= 22 года
Ac2O3; Ac(OH)3 – только основные св-ва
Ac(OH)3↓+ 3HCl =
AcCl3 + 3H2OAcCl3, Ac(NO3)3 - растворимы
AcPO4, Ac2(СO3)3 - не растворимы
Th4+ - похож на Zr и Hf
Th + O2 = ThO2; Th + 2H2O = ThO2 + H2 (нагрев.)
Th(OH)4 – только основные св-ва
Th(OH)4 + 4HCl → ThCl4 + 4H2O
ThCl4 + 4NaOH = Th(OH)4↓ + 4NaCl (или xThO2·yH2O)
Слайд 55
Pa5+ – похож на Nb5+ и Ta5+
Продукт распада урана,
получены десятки грамм.
Pa(OH)5 – слабые амфотерные свойства
Pa(OH)5 + 5HF
→ PaF5 + 5H2O PaF5 + 2KF → K2[PaF7]
Pa2O5 + NaOH(сплавление) → NaPaO3 или Na3PaO4
Ac (актиний), Th (торий), Pa (протактиний)
Слайд 57U
238U – 99% t1/2= 4.5 млрд. лет
235U – 0,75% -
наиболее важен
t1/2= 0.7 млн. лет
U4+:
коричневый UO2, U(OH)4 – слабое
основание;U4+ + 4F– = UF4 ; UO2 + 4HF = UF4 + 2H2O
U6+: оранжевый UO3, UF6 (возгоняется при 57 оС)
UO3 + NaOH → Na2U2O7 (Na2UO4) – уранаты
Слайд 59Применение
Ядерное горючее – 235U, 238U, 239Pu
В перспективе – 233U (из
232Th);
2. Портативные источники энергии (космос,
кардиостимуляторы) – 239Pu (плутоний), 242Cm, 244Cm
(кюрий);3. Источники нейтронов – 241Am; 252Cf;
4. Ионизация – 241Am в радиографии, дефекто-
скопии;
5. Медицина – 241Am в диагностике щитовидной
железы; 252Cf – нейтронная терапия рака.
Слайд 60Ядерные реакции
Образование трансурановых элементов в ядерном реакторе происходит по следующим
схемам:
235U + n → 236U + n → 237U →
(7 сут) → 237Np + n → 238Np
→ (2,1 сут) → 238Pu238U + n → 239U →(23 мин)→ 239Np →(2,3 сут)→ 239Pu (+осколки) + n → 240Pu + n → 241Pu (+осколки) + n → 242Pu + n → 243Pu →(5 ч)→ 243Am + n → 244Am → (26 мин)→ 244Cm
Время между стрелками обозначает период полураспада, «+n» обозначает поглощение нейтрона.
















![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Комплексы Ag+Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH–AgCl↓ + 2NH3 Комплексы Ag+Ag2O↓+ 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OH–AgCl↓ + 2NH3 = [Ag(NH3)2]+ + Cl– 2 =](/img/tmb/3/248192/90b269a373b0801bb65da45524b28762-800x.jpg)

![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Au3+Сильные окислители, в основном, комплексы.[AuCl4]– + 3OH– = Au(OH)3↓+ 4Cl–Красно-коричневый, амфотерный. Au3+Сильные окислители, в основном, комплексы.[AuCl4]– + 3OH– = Au(OH)3↓+ 4Cl–Красно-коричневый, амфотерный. Au(OH)3 + KOH =K[Au(OH)4] гидроксоауратAu(OH)3 +](/img/thumbs/5d4237fff0e49eed776316a440989696-800x.jpg)

![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Валентные электроны:Zn: [Ar]3d104s2Cd:[Kr]4d105s2Hg: [Xe]4f145d106s2 Zn Cd Hg Валентные электроны:Zn: [Ar]3d104s2Cd:[Kr]4d105s2Hg: [Xe]4f145d106s2 Zn Cd Hg](/img/thumbs/1a539916f36c2cfd6e6ad272b6acbe2b-800x.jpg)






![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Оксиды/гидрокcидыZnO/Zn(OH)2 – амфотерные свойства:Zn(OH)2 + H2SO4 = ZnSO4 + 2H2OZn(OH)2 + Оксиды/гидрокcидыZnO/Zn(OH)2 – амфотерные свойства:Zn(OH)2 + H2SO4 = ZnSO4 + 2H2OZn(OH)2 + 2NaOH = Na2[Zn(OH)4] цинкатCdO/Cd(OH)2 – основные](/img/tmb/3/248192/296737a9a43019dde7698a3ac0a49c5d-800x.jpg)


![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится [H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X]Растворимые соли: Hg2(NO3)2, Hg2F2Нерастворимые соли: Hg2X2 (X = Cl, Br, [H2O–Hg–Hg–OH2]2+, [X–Hg–Hg–X]Растворимые соли: Hg2(NO3)2, Hg2F2Нерастворимые соли: Hg2X2 (X = Cl, Br, I) Гидролиз растворимых солей:Hg2(NO3)2 + H2O](/img/tmb/3/248192/5dc56d0b4f7b30d6ad1c9e657f95f822-800x.jpg)







![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Степень окисления +4Ce4+: [Xe] CeO2, CeF4 Pr4+: [Xe]4f1 PrO2 (P(O2)=280 атм, 400˚C); Степень окисления +4Ce4+: [Xe] CeO2, CeF4 Pr4+: [Xe]4f1 PrO2 (P(O2)=280 атм, 400˚C); PrF4Но устойчивы сложные оксиды, Pr5O9, Pr6O11,](/img/tmb/3/248192/5526bdfa4c38efc0b39c0980f8181a38-800x.jpg)
![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Степени окисления +2Sm2+: [Xe]4f6 SmI2Eu2+: [Xe]4f7 EuO, EuX2, EuSO4 (н/р), EuCO3 Степени окисления +2Sm2+: [Xe]4f6 SmI2Eu2+: [Xe]4f7 EuO, EuX2, EuSO4 (н/р), EuCO3 (н/р)Yb2+: [Xe]4f14 YbO, YbX2, YbSO4Cильные восстановители:Sm2+](/img/tmb/3/248192/599afa5e8f5bb67f848f3db07878b0a4-800x.jpg)
![Побочная подгруппа
I группы периодической системы
19 мая в 16 20 состоится Комплексы лантаноидовАквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9 с);Предпочитают Комплексы лантаноидовАквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9 с);Предпочитают координацию по кислороду;Высокие координационные числа и](/img/tmb/3/248192/ac2908bcce9a9ea94017eeb7c51647b5-800x.jpg)