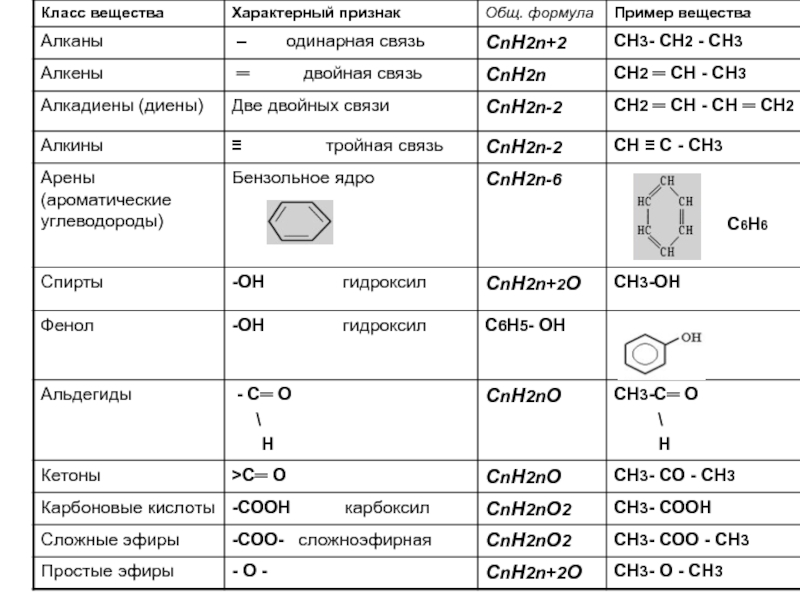
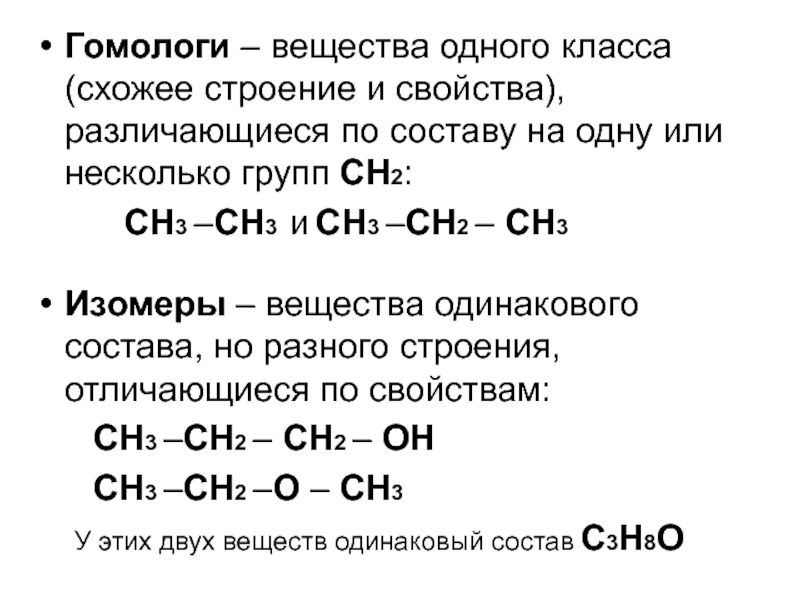
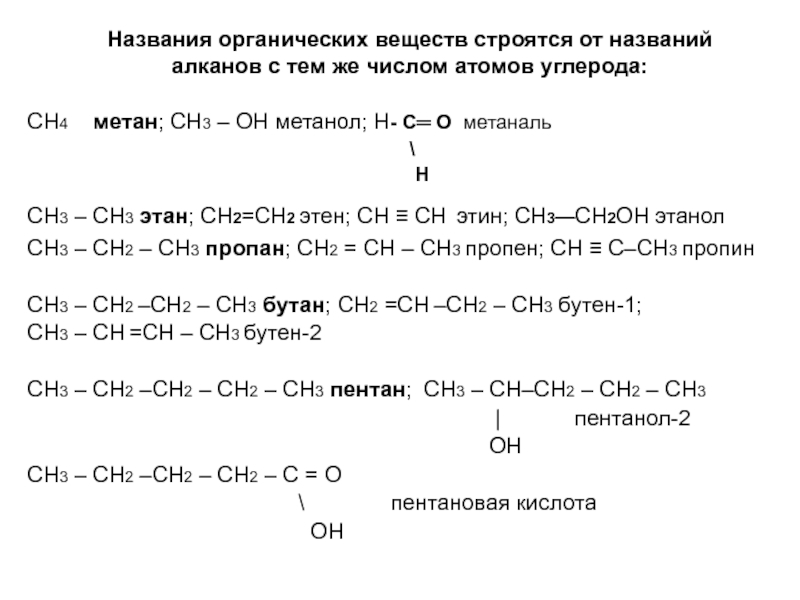
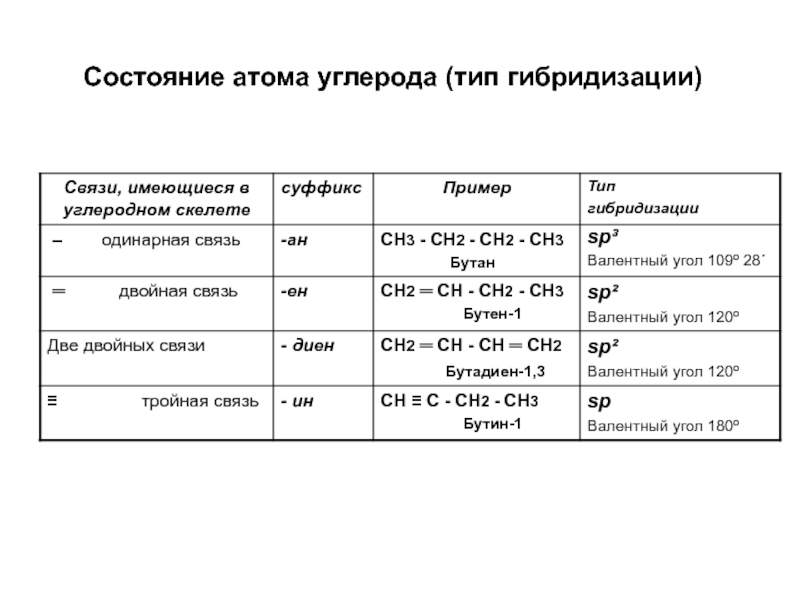
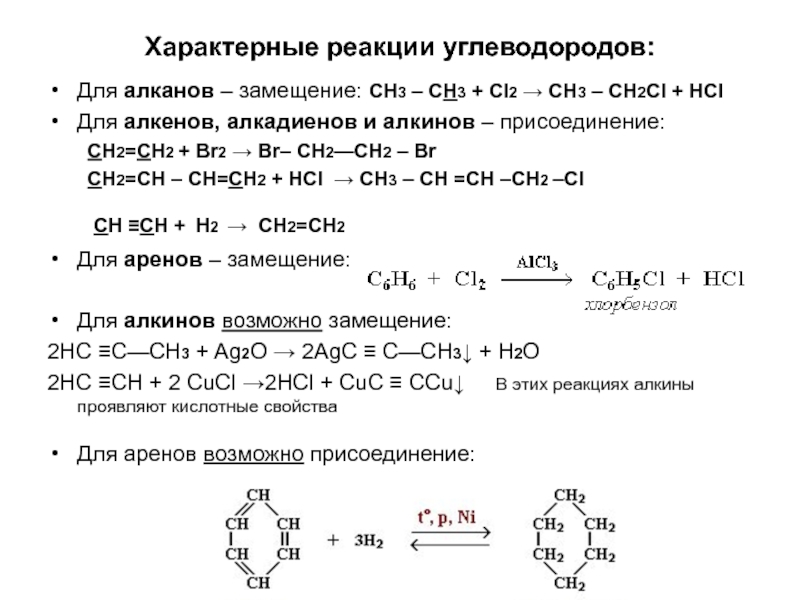
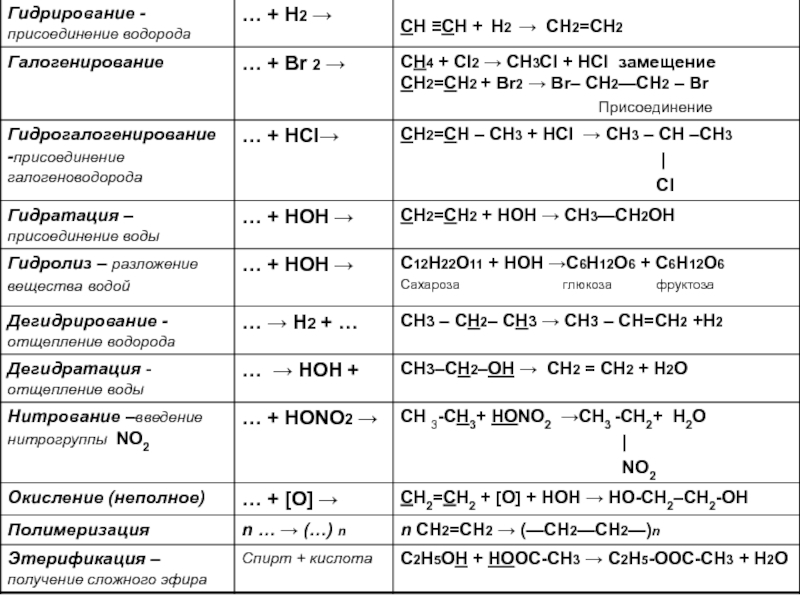
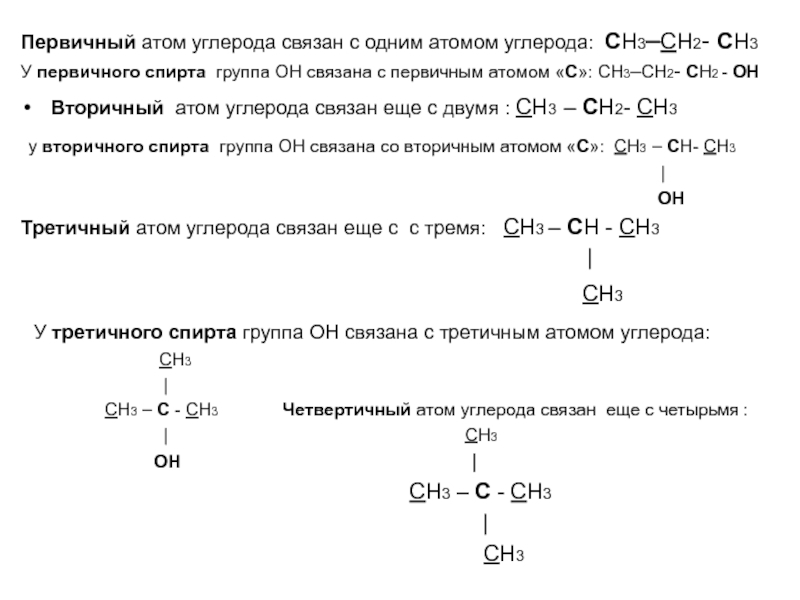
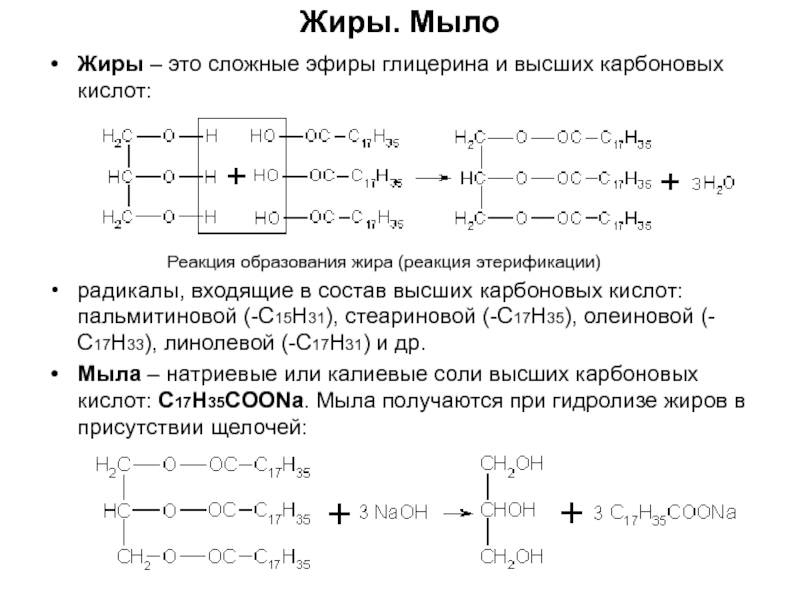
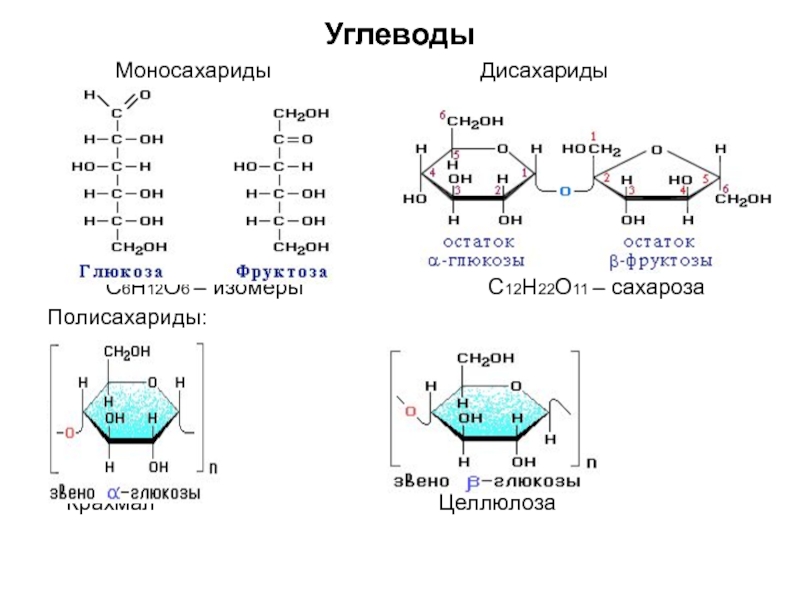
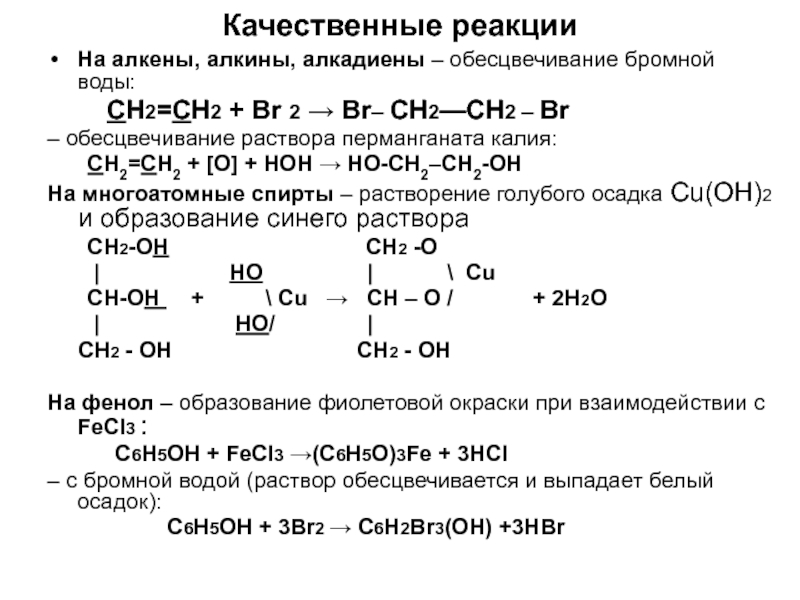
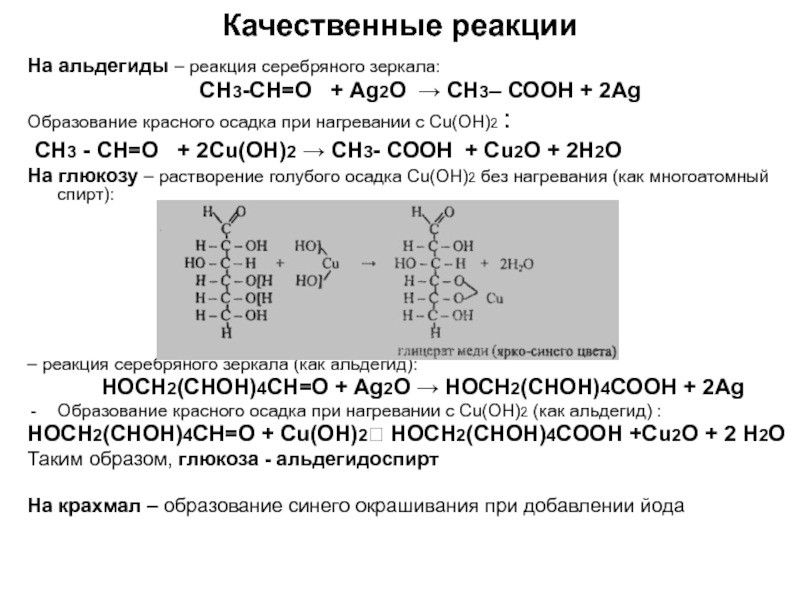
по составу на одну или несколько групп СН2:
СН3
–СН3 и СН3 –СН2 – СН3 Изомеры – вещества одинакового состава, но разного строения, отличающиеся по свойствам:
СН3 –СН2 – СН2 – ОН
СН3 –СН2 –О – СН3
У этих двух веществ одинаковый состав С3Н8О