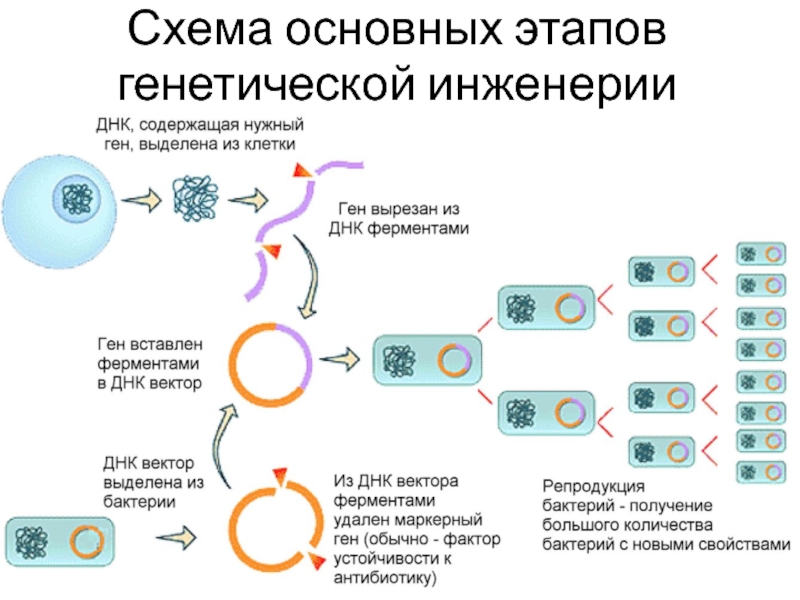
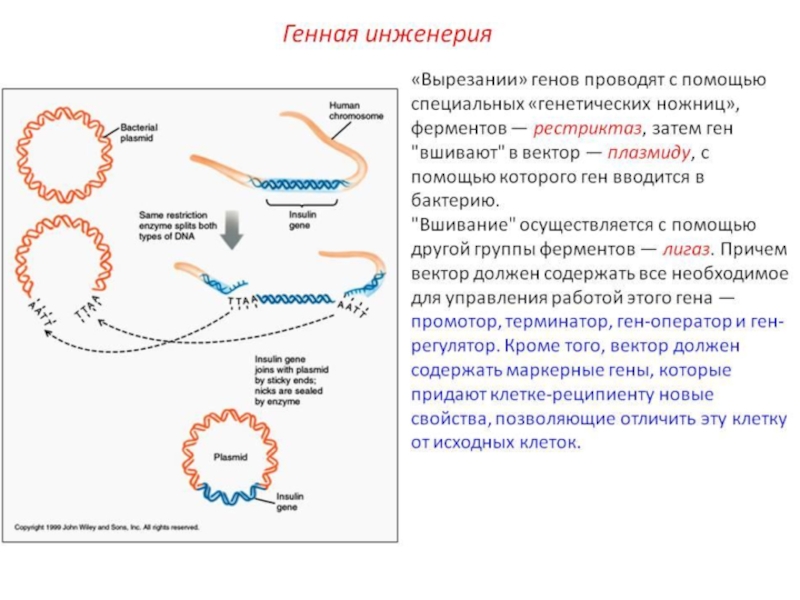
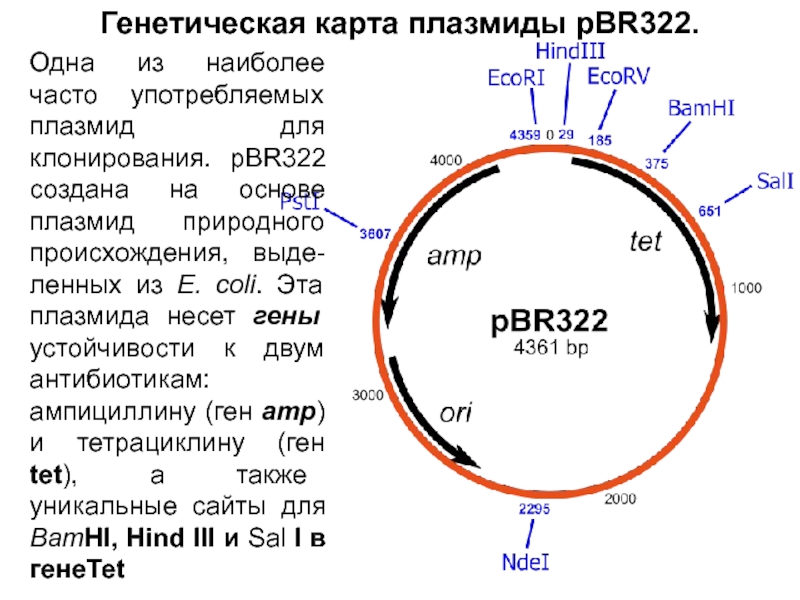
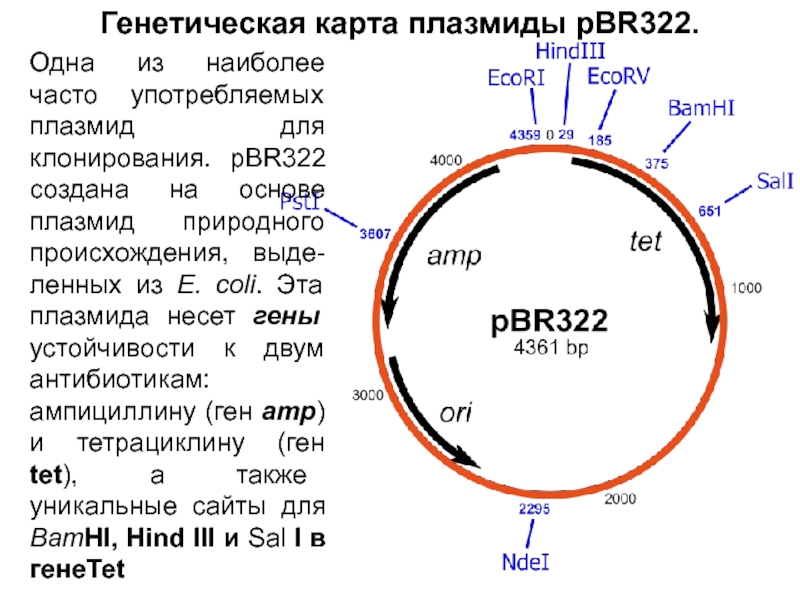
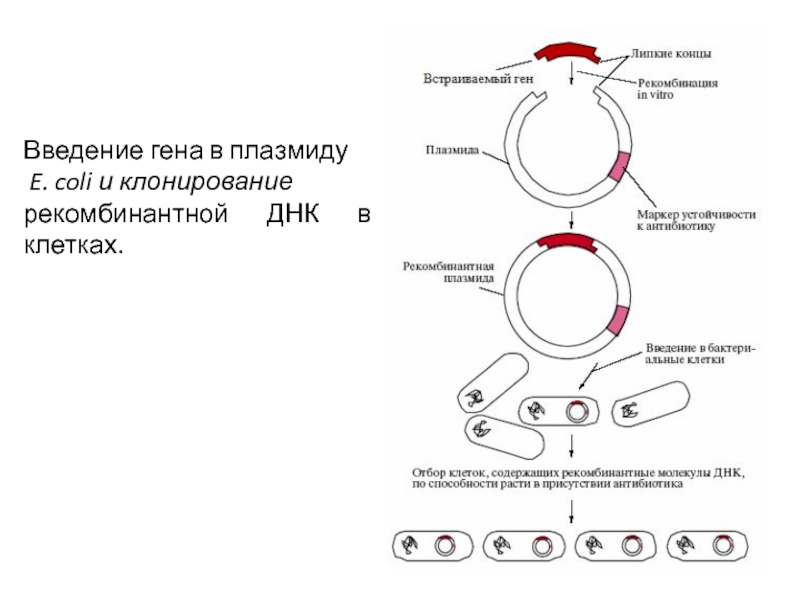
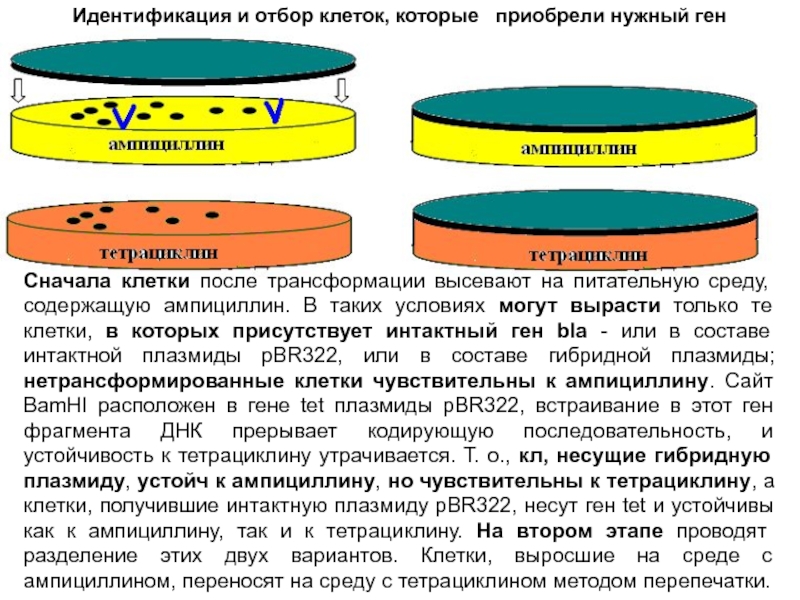
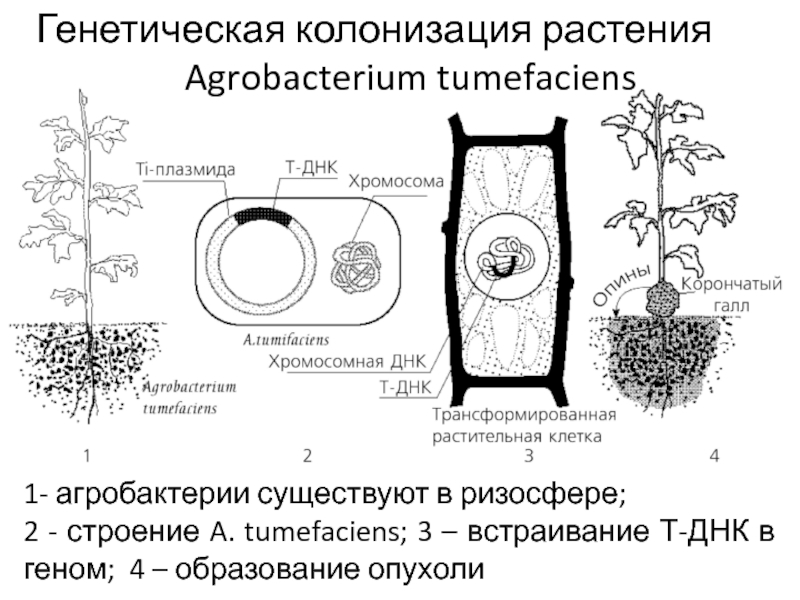
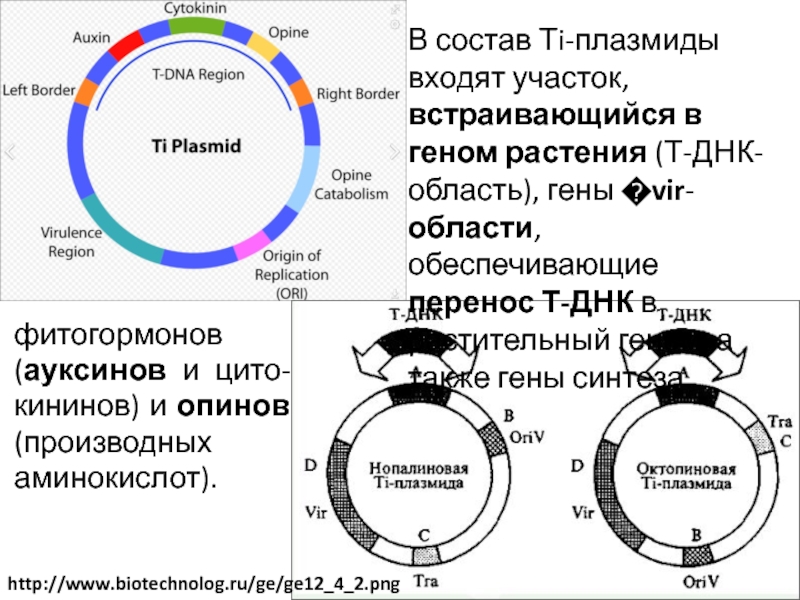
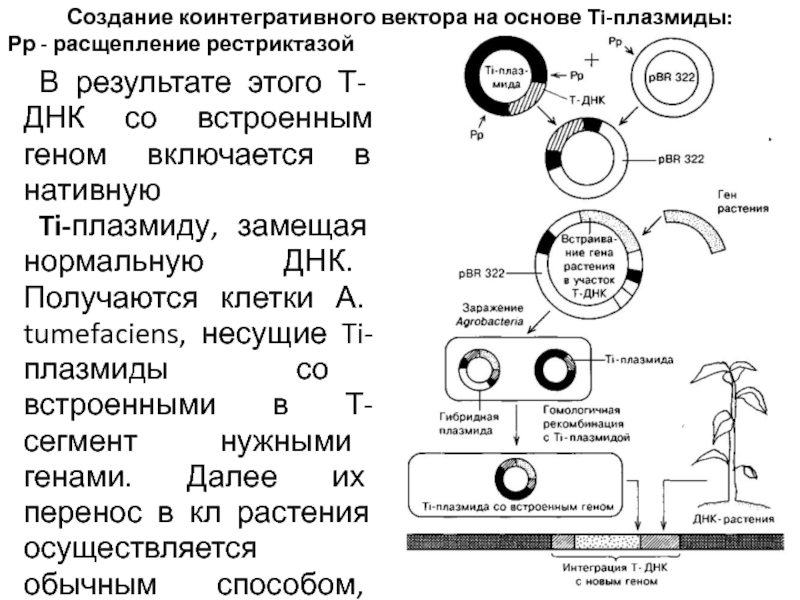
В таких условиях могут вырасти только те клетки, в которых
присутствует интактный ген bla - или в составе интактной плазмиды pBR322, или в составе гибридной плазмиды; нетрансформированные клетки чувствительны к ампициллину. Сайт BamHI расположен в гене tet плазмиды pBR322, встраивание в этот ген фрагмента ДНК прерывает кодирующую последовательность, и устойчивость к тетрациклину утрачивается. Т. о., кл, несущие гибридную плазмиду, устойч к ампициллину, но чувствительны к тетрациклину, а клетки, получившие интактную плазмиду pBR322, несут ген tet и устойчивы как к ампициллину, так и к тетрациклину. На втором этапе проводят разделение этих двух вариантов. Клетки, выросшие на среде с ампициллином, переносят на среду с тетрациклином методом перепечатки.
Идентификация и отбор клеток, которые приобрели нужный ген