Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Правовые основы проведения клинических исследований
Содержание
- 1. Правовые основы проведения клинических исследований
- 2. Блок 11Общие вопросы проведения КИ в РФ
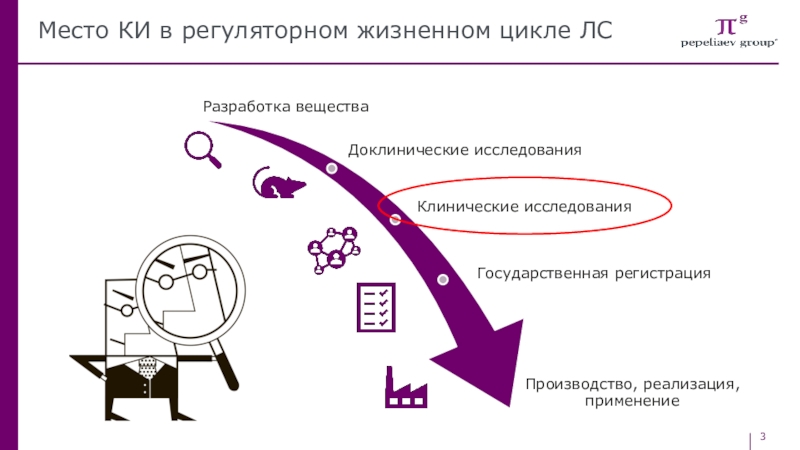
- 3. Место КИ в регуляторном жизненном цикле ЛС
- 4. Что такое клиническое исследование?Клиническое исследование лекарственного препарата
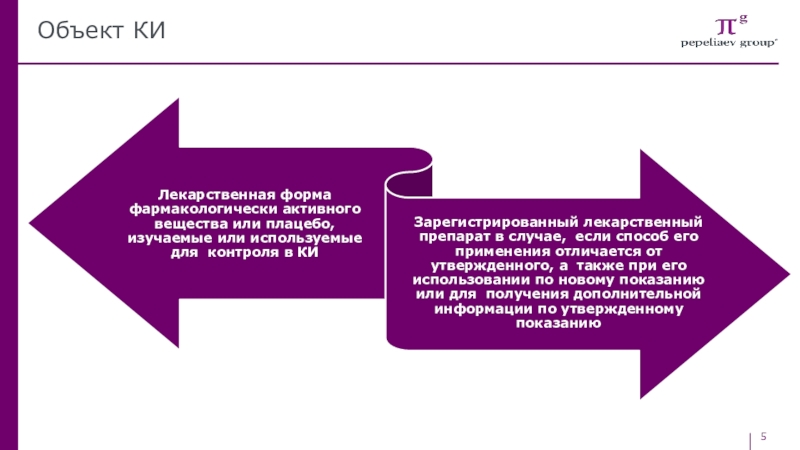
- 5. Объект КИ
- 6. Цели проведения КИустановление безопасности лекарственных препаратов для
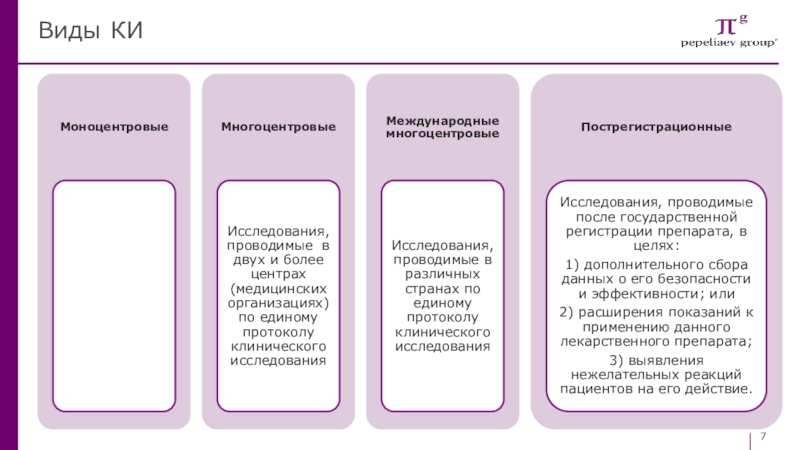
- 7. Виды КИ
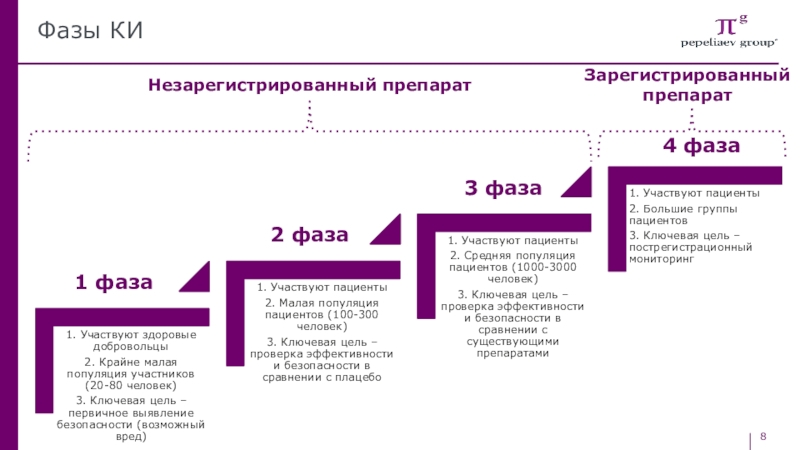
- 8. Фазы КИ1 фаза2 фаза3 фаза4 фазаНезарегистрированный препаратЗарегистрированный препарат
- 9. Фазы КИ Фаза – клинико -фармакологические исследования,
- 10. Фазы КИ Фаза: Дополнительная проверка исследуемого вещества
- 11. Виды исследований по дизайнупредусматривает неосведомленность участников КИ
- 12. Кто может стать участником КИс согласия родителей,
- 13. Кто не может стать участником КИ?
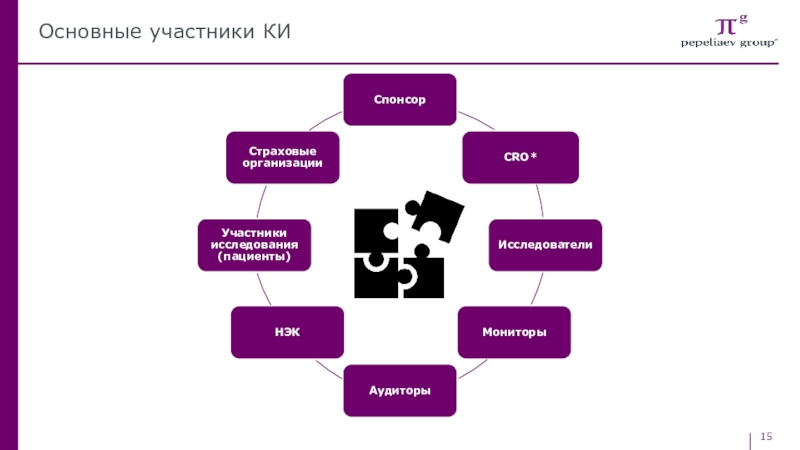
- 14. Блок 22Участники КИ и их функциональные роли
- 15. Основные участники КИ
- 16. Этический комитет: функциипротокол (поправки к протоколу);письменную форма
- 17. Этический комитет: составне менее 5 человек;по крайней
- 18. Спонсорфизическое или юридическое лицо, отвечающее за инициацию, организацию и обеспечение финансирования клинического исследованияЗоны ответственности спонсора
- 19. CROфизическое лицо или организация (коммерческая, научно-исследовательская или
- 20. Исследовательфизическое лицо, отвечающее за проведение исследования в исследовательском центреДля проведения КИ должен
- 21. ИсследовательВ рамках проведения КИ должен:
- 22. МониторыМонитор – основное связующее звено между исследователем
- 23. Аудитсистематическая и независимая проверка относящихся к исследованию
- 24. Страхование в КИСпонсор обязан в качестве страхователя
- 25. Иные возможные участники
- 26. Блок 33Обязательные документы в рамках КИ
- 27. 1) Разрешение на проведение КИКлиническое исследование лекарственного
- 28. Разрешение на КИ и реестрУполномоченный федеральный орган
- 29. 2) Информированное согласие (информационный листок пациента)Свободное и
- 30. Содержание Листка Пациента (Patient information sheet)Требования НЭКИные требования
- 31. Информационный листок пациента Правовая природа Листка Пациента
- 32. Протокол исследованияСодержит сведения о цели, дизайне, методологии,
- 33. Брошюра исследователяОсновной документ исследователя об исследовании, который
- 34. Блок 44Договоры в рамках КИ
- 35. Основные положенияДоговорКлиническое исследование лекарственного препарата для медицинского
- 36. Существенные условия договора на проведение КИУсловия и
- 37. Договорные связи между основными участниками КИДоговорИнициатор КИНесет
- 38. Содержание договора между спонсором и CROвыполнение заказа
- 39. Содержание договора между спонсором/CRO и исследовательским центром/исследователемоказание
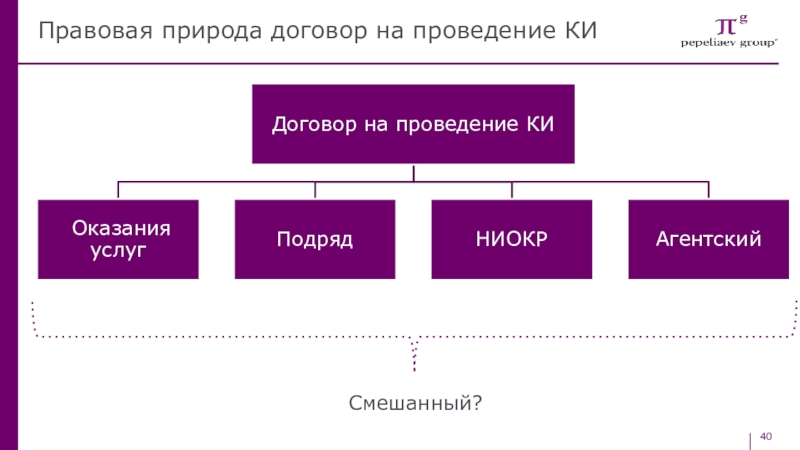
- 40. Правовая природа договор на проведение КИСмешанный?
- 41. Договор оказания услуг VS договор подрядаВажен результатВажен
- 42. «Работоподобные» услуги«Поскольку стороны в силу статьи 421
- 43. Блок 55Контроль за проведением КИ
- 44. Проверки в рамках КИКонтроль за проведением КИ
- 45. Возможные нарушенияНе обеспечено направления в Минздрав сообщения
- 46. Блок 66Новые возможности для КИ
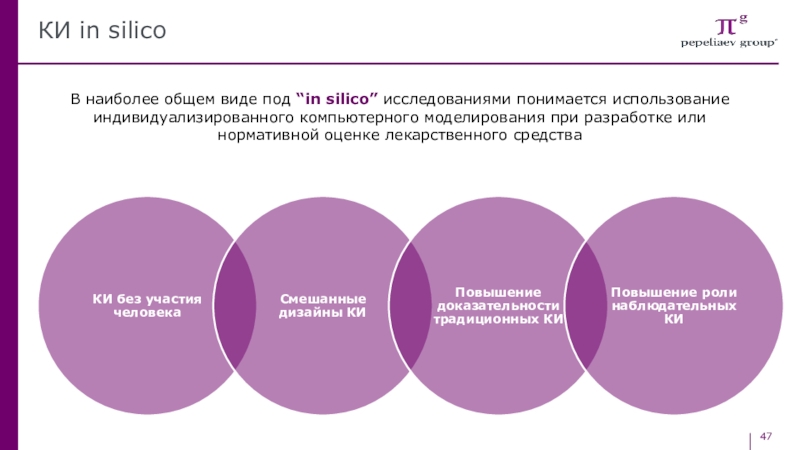
- 47. КИ in silicoВ наиболее общем виде под
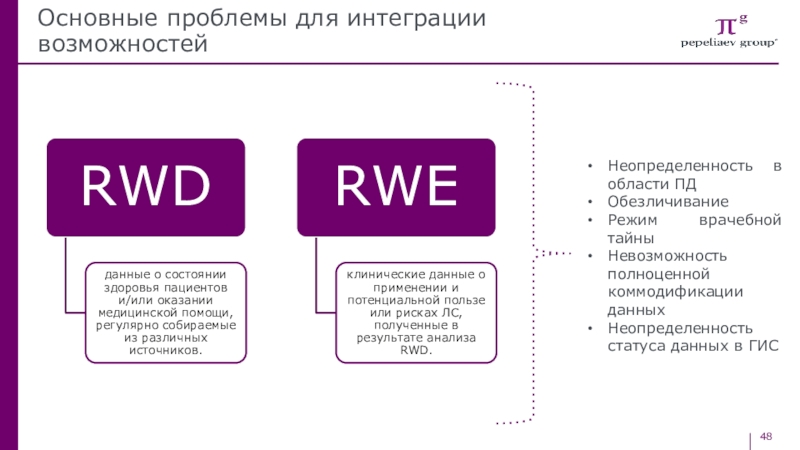
- 48. Основные проблемы для интеграции возможностейНеопределенность в области
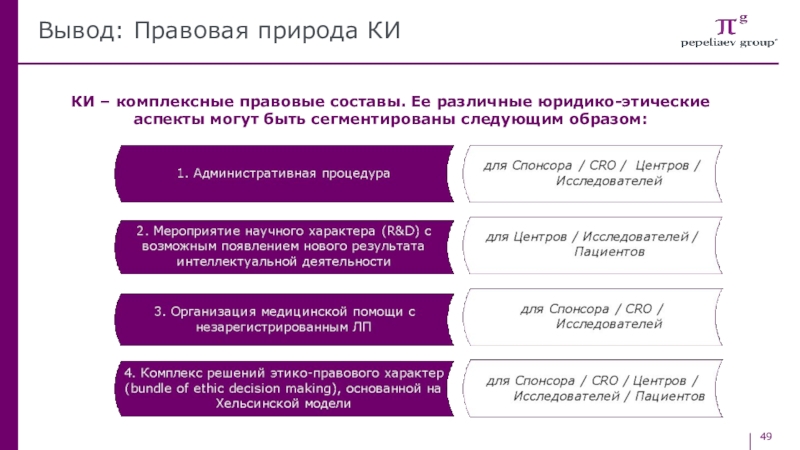
- 49. Вывод: Правовая природа КИКИ – комплексные правовые
- 50. Карина КолобоваМладший практики здравоохранения и коммерцииk.kolobova@pgplaw.ru Тел. 8-985-687-48-74Контактные данные
- 51. +7 (495) 767-00-07+7 (495) 765-00-07www.pgplaw.ruinfo@pgplaw.ruМосква Санкт-ПетербургКрасноярскЮжно-СахалинскПекинШанхайTel.: Fax: Контактная информация
- 52. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Правовые основы проведения клинических исследований
Младший юрист практики здравоохранения и коммерции
Карина
Колобова
Слайд 4Что такое клиническое исследование?
Клиническое исследование лекарственного препарата - изучение диагностических,
лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения
у человека, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения:Доказательств безопасности, качества и эффективности лекарственного препарата,
Данных о нежелательных реакциях организма человека на применение лекарственного препарата и
Об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами.
В РФ проведение КИ необходимо для референтного лекарственного препарата - лекарственного препарата, который впервые регистрируется в РФ, и который в дальнейшем используется для оценки биоэквивалентности или терапевтической эквивалентности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата (дженерика).
Слайд 6Цели проведения КИ
установление безопасности лекарственных препаратов для здоровых добровольцев и
(или) переносимости их здоровыми добровольцами, за исключением таких исследований лекарственных
препаратов, произведенных за пределами Российской Федерации;подбор оптимальных дозировок лекарственного препарата и курса лечения для пациентов с определенным заболеванием, оптимальных доз и схем вакцинации иммунобиологическими лекарственными препаратами здоровых добровольцев;
установление безопасности лекарственного препарата и его эффективности для пациентов с определенным заболеванием, профилактической эффективности иммунобиологических лекарственных препаратов для здоровых добровольцев;
изучение возможности расширения показаний для медицинского применения и выявления ранее неизвестных побочных действий зарегистрированных лекарственных препаратов.
Слайд 9Фазы КИ
Фаза – клинико -фармакологические исследования, первый опыт применения
вещества ограниченным количеством здоровых добровольцев в условиях стационара для оценки
профиля безопасности, токсичности, определения безопасного диапазона дозировки и выявления побочных эффектов.Фаза – применение у пациентов с определенным заболеванием. Цель - установление
эффективности, определение оптимальных режимов дозирования, оценка безопасности.
Фаза IIa (pilot studies) – терапевтические пилотные исследования. Исследуется фармакологические свойства вещества (активность, безопасность, устанавливается популяция пациентов, режим дозирования, зависимость эффекта от дозы, критерии оценки эффективности и т.д.). Испытания проводятся на ограниченном числе пациентов (100-300), за которыми осуществляется тщательное наблюдение, иногда в стационаре.
Фаза IIb (pivotal trial) – более обширные исследования у пациентов с заболеванием, которое является основным показанием к назначению нового вещества.
Слайд 10Фазы КИ
Фаза: Дополнительная проверка исследуемого вещества для определения безопасности
и эффективности, контроля побочных эффектов и сравнения со стандартными методами
терапии. Применение вещества на нескольких сот до нескольких тысяч людей с определенным заболеванием. Как правило, это многоцентровые испытания.Чаще всего исследования являются двойными слепыми контролируемыми, рандомизированными, а условия исследований максимально приближены к обычной реальной рутинной медицинской практике.
Полученные данные являются основой для создания инструкций по применению и для решения о регистрации препарата.
Фаза: пострегистрационные исследования.
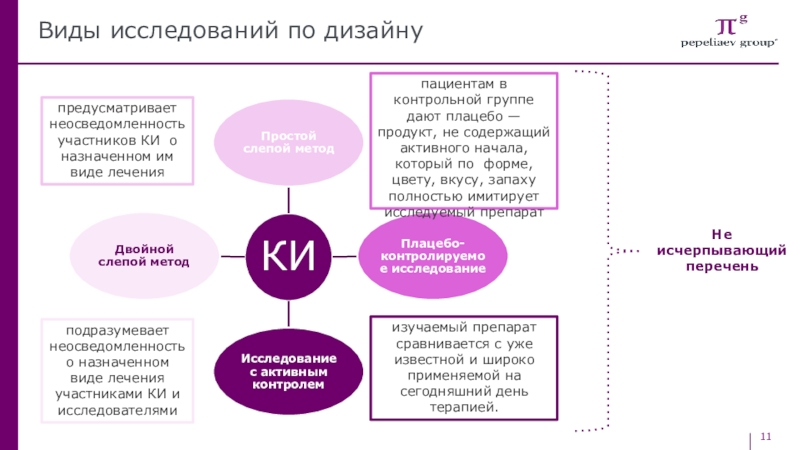
Слайд 11Виды исследований по дизайну
предусматривает неосведомленность участников КИ о назначенном им
виде лечения
подразумевает неосведомленность о назначенном виде лечения участниками КИ и
исследователямипациентам в контрольной группе дают плацебо — продукт, не содержащий активного начала, который по форме, цвету, вкусу, запаху полностью имитирует исследуемый препарат
изучаемый препарат сравнивается с уже известной и широко применяемой на сегодняшний день терапией.
Не исчерпывающий перечень
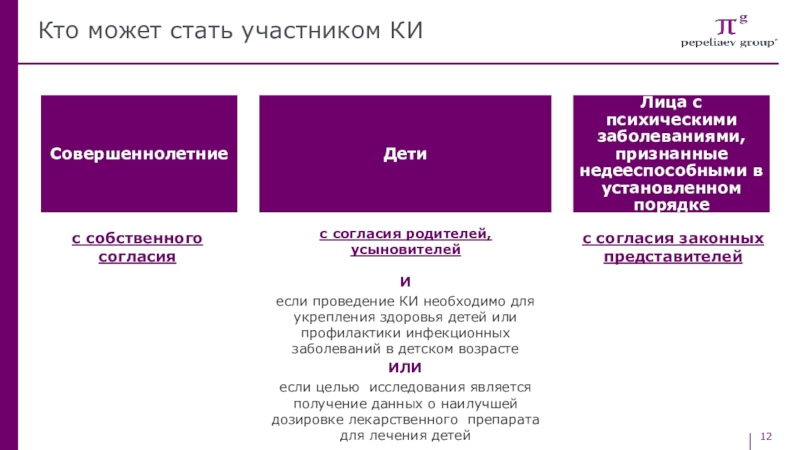
Слайд 12Кто может стать участником КИ
с согласия родителей, усыновителей
И
если проведение КИ
необходимо для укрепления здоровья детей или профилактики инфекционных заболеваний в
детском возрастеИЛИ
если целью исследования является получение данных о наилучшей дозировке лекарственного препарата для лечения детей
с согласия законных представителей
с собственного согласия
Слайд 16Этический комитет: функции
протокол (поправки к протоколу);
письменную форма информированного согласия и
ее последующие редакции, предлагаемые исследователем для использования в исследовании;
описание действий,
направленных на привлечение субъектов к участию в исследовании (например, рекламные объявления);письменные материалы, которые будут предоставлены субъектам исследования;
брошюра исследователя;
известная информация, касающаяся безопасности;
информация о выплатах и компенсациях субъектам исследования;
текущую редакцию резюме исследователя и (или) другие материалы, подтверждающие его квалификацию;
другие документы, которые могут потребоваться ЭСО (НЭК) для выполнения его обязанностей.
Экспертный совет организации (независимый этический комитет) призван защищать права, безопасность и благополучие всех субъектов исследования.
Рассматривает и утверждает следующие документы
Слайд 17Этический комитет: состав
не менее 5 человек;
по крайней мере 1 человек,
не специализирующийся в области научных исследований (деятельности);
по крайней мере 1
человек, не являющийся сотрудником медицинского учреждения (исследовательского центра), в котором проводится исследование.Решение о проведении КИ –несотрудники исследователя или спонсора + отсутствие заинтересованности
!
Можно привлекать дополнительных независимых экспертов по узким вопросам
Исследователи могут участвовать, предоставлять информацию по любым аспектам исследования, но не могут участвовать в прениях или в голосовании.
Слайд 18Спонсор
физическое или юридическое лицо, отвечающее за инициацию, организацию и обеспечение
финансирования клинического исследования
Зоны ответственности спонсора
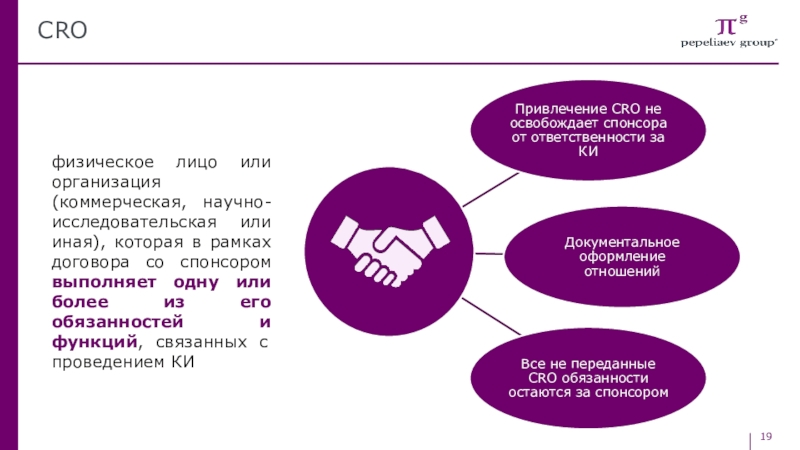
Слайд 19CRO
физическое лицо или организация (коммерческая, научно-исследовательская или иная), которая в
рамках договора со спонсором выполняет одну или более из его
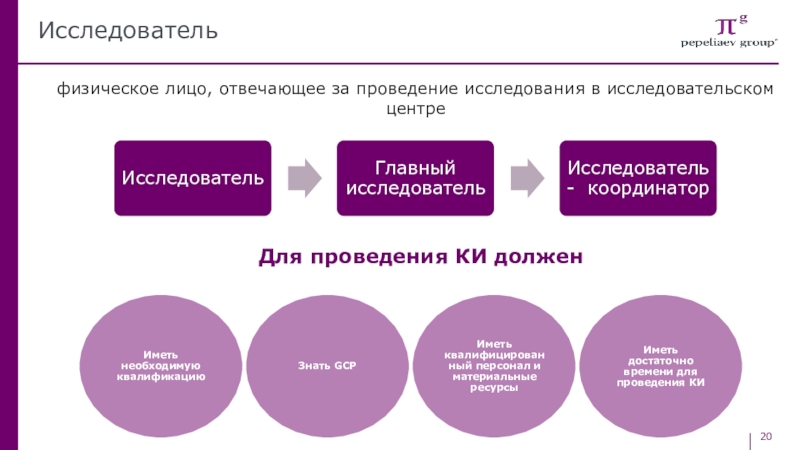
обязанностей и функций, связанных с проведением КИСлайд 20Исследователь
физическое лицо, отвечающее за проведение исследования в исследовательском центре
Для проведения
КИ должен
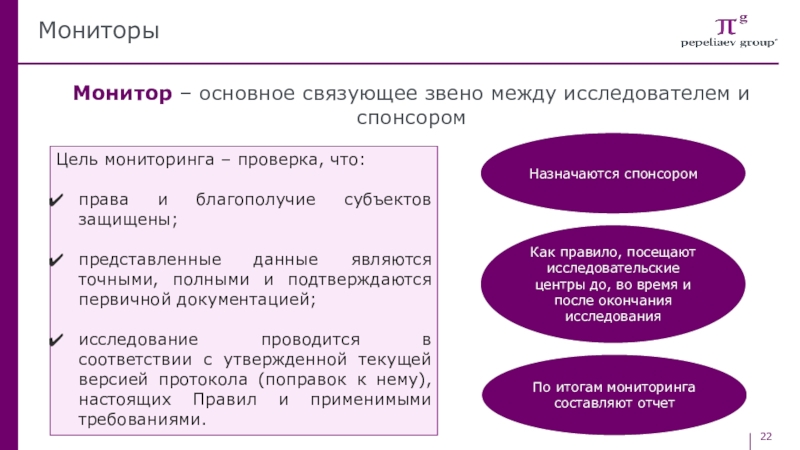
Слайд 22Мониторы
Монитор – основное связующее звено между исследователем и спонсором
Цель мониторинга
– проверка, что:
права и благополучие субъектов защищены;
представленные данные являются точными,
полными и подтверждаются первичной документацией;исследование проводится в соответствии с утвержденной текущей версией протокола (поправок к нему), настоящих Правил и применимыми требованиями.
Назначаются спонсором
Как правило, посещают исследовательские центры до, во время и после окончания исследования
По итогам мониторинга составляют отчет
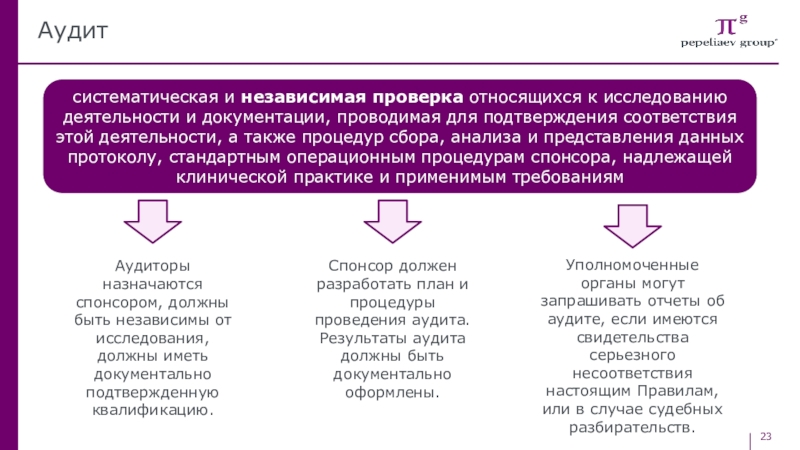
Слайд 23Аудит
систематическая и независимая проверка относящихся к исследованию деятельности и документации,
проводимая для подтверждения соответствия этой деятельности, а также процедур сбора,
анализа и представления данных протоколу, стандартным операционным процедурам спонсора, надлежащей клинической практике и применимым требованиямАудиторы назначаются спонсором, должны быть независимы от исследования, должны иметь документально подтвержденную квалификацию.
Спонсор должен разработать план и процедуры проведения аудита. Результаты аудита должны быть документально оформлены.
Уполномоченные органы могут запрашивать отчеты об аудите, если имеются свидетельства серьезного несоответствия настоящим Правилам, или в случае судебных разбирательств.
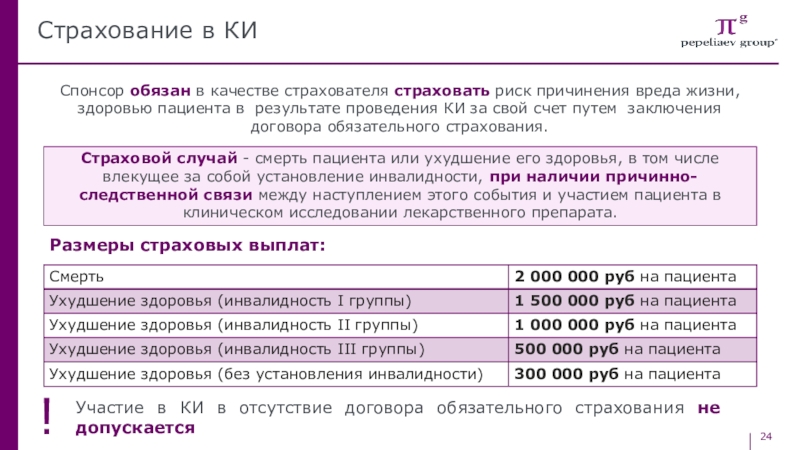
Слайд 24Страхование в КИ
Спонсор обязан в качестве страхователя страховать риск причинения
вреда жизни, здоровью пациента в результате проведения КИ за свой
счет путем заключения договора обязательного страхования.Страховой случай - смерть пациента или ухудшение его здоровья, в том числе влекущее за собой установление инвалидности, при наличии причинно-следственной связи между наступлением этого события и участием пациента в клиническом исследовании лекарственного препарата.
Размеры страховых выплат:
Участие в КИ в отсутствие договора обязательного страхования не допускается
!
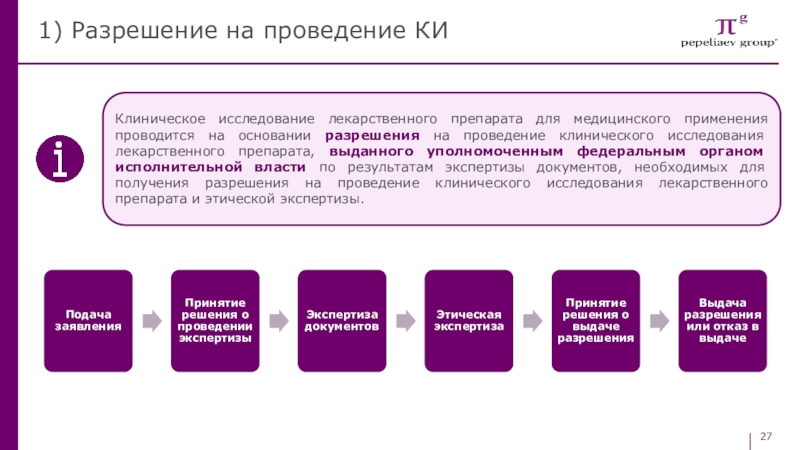
Слайд 271) Разрешение на проведение КИ
Клиническое исследование лекарственного препарата для медицинского
применения проводится на основании разрешения на проведение клинического исследования лекарственного
препарата, выданного уполномоченным федеральным органом исполнительной власти по результатам экспертизы документов, необходимых для получения разрешения на проведение клинического исследования лекарственного препарата и этической экспертизы.Слайд 28Разрешение на КИ и реестр
Уполномоченный федеральный орган исполнительной власти ведет
реестр выданных разрешений на проведение клинических исследований лекарственного препарата, содержащий
указание на их цель или цели, в установленном этим органом порядке. Реестр находится в публичном доступе.Слайд 292) Информированное согласие (информационный листок пациента)
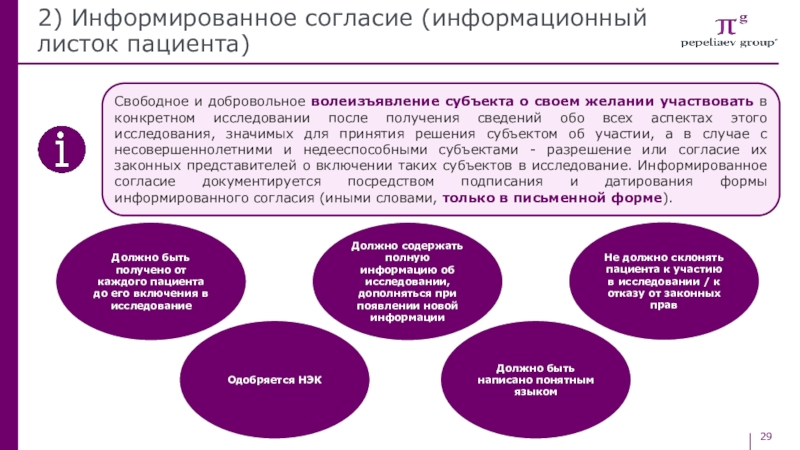
Свободное и добровольное волеизъявление субъекта
о своем желании участвовать в конкретном исследовании после получения сведений
обо всех аспектах этого исследования, значимых для принятия решения субъектом об участии, а в случае с несовершеннолетними и недееспособными субъектами - разрешение или согласие их законных представителей о включении таких субъектов в исследование. Информированное согласие документируется посредством подписания и датирования формы информированного согласия (иными словами, только в письменной форме).Должно быть получено от каждого пациента до его включения в исследование
Одобряется НЭК
Должно содержать полную информацию об исследовании, дополняться при появлении новой информации
Должно быть написано понятным языком
Не должно склонять пациента к участию в исследовании / к отказу от законных прав
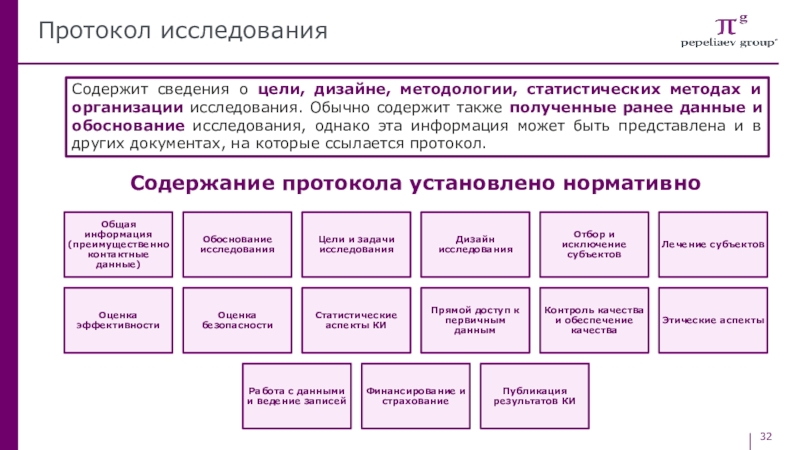
Слайд 32Протокол исследования
Содержит сведения о цели, дизайне, методологии, статистических методах и
организации исследования. Обычно содержит также полученные ранее данные и обоснование
исследования, однако эта информация может быть представлена и в других документах, на которые ссылается протокол.Содержание протокола установлено нормативно
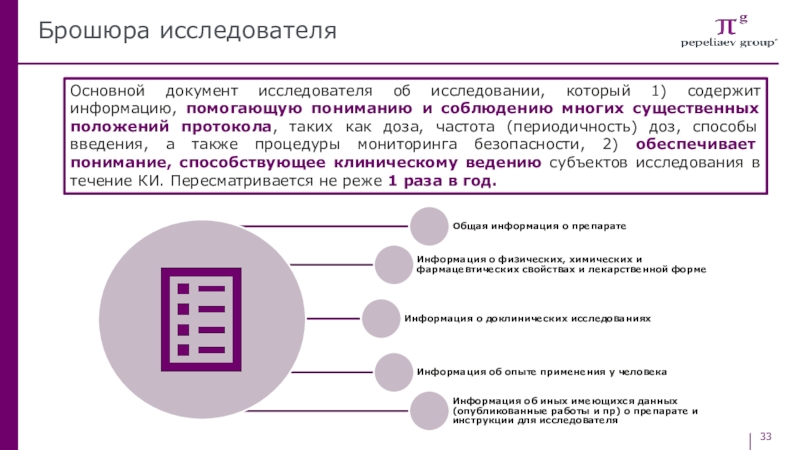
Слайд 33Брошюра исследователя
Основной документ исследователя об исследовании, который 1) содержит информацию,
помогающую пониманию и соблюдению многих существенных положений протокола, таких как
доза, частота (периодичность) доз, способы введения, а также процедуры мониторинга безопасности, 2) обеспечивает понимание, способствующее клиническому ведению субъектов исследования в течение КИ. Пересматривается не реже 1 раза в год.Слайд 35Основные положения
Договор
Клиническое исследование лекарственного препарата для медицинского применения проводится в
соответствии с договором о проведении клинического исследования лекарственного препарата для
медицинского применения, заключаемым между организацией, получившей разрешение уполномоченного федерального органа исполнительной власти на организацию проведения такого исследования, и медицинской организацией, осуществляющей проведение такого исследования.Слайд 36Существенные условия договора на проведение КИ
Условия и сроки проведения КИ;
Определение
общей стоимости программы КИ с указанием сумм, предназначающихся для выплат
(со)исследователям;Определение формы представления результатов КИ в Минздрав (!)
Содержание договора является предметом проверки Росздравнадзора
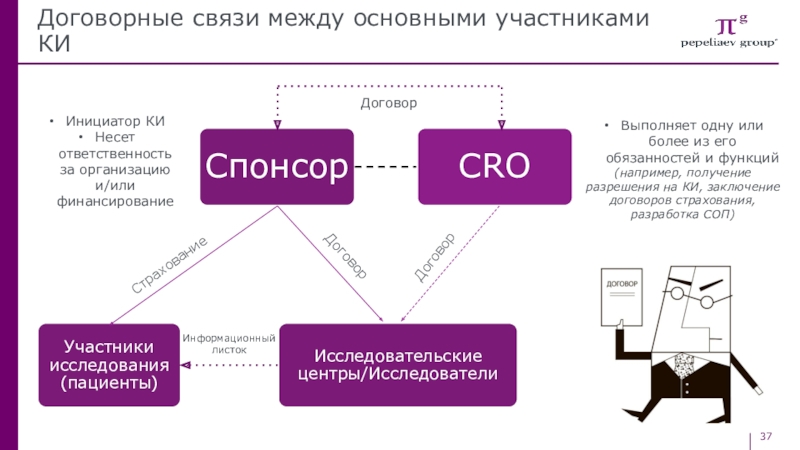
Слайд 37Договорные связи между основными участниками КИ
Договор
Инициатор КИ
Несет ответственность за организацию
и/или финансирование
Выполняет одну или более из его обязанностей и функций
(например, получение разрешения на КИ, заключение договоров страхования, разработка СОП)
Договор
Договор
Информационный листок
Страхование
Слайд 38Содержание договора между спонсором и CRO
выполнение заказа (работ) или оказание
услуг по организации КИ;
в результате КИ может появиться новый объект
интеллектуальных прав;организация оказания медицинских услуг в пользу третьего лица (!);
внедрение и поддержание СМК КИ (рандомизация, аудиты etc);
обязанность совершение ethical decision making (этический комитет) и patient ethical treatment (обязанности по выводу/вводу пациентов в исследование);
обязанность по информационному обмену и охране информации (152-ФЗ, ст. 13 323-ФЗ) при сохранении возможности раскрытия в целях КИ (аудит, мониторинг)
Алеаторный для третьих лиц
Большое
кол-во нормативных императивных требований
Этико-правовая нагрузка на всех участников процесса
Невозможность деления ответственности
Слайд 39Содержание договора между спонсором/CRO и исследовательским центром/исследователем
оказание медицинских услуг в
пользу третьим лицом (!);
обязанность соблюдения GCP и протокола исследования;
согласие на
соблюдение процедуры регистрации данных, утвержденной спонсором;согласие на проведение мониторинга, аудитов спонсора и инспекицй;
согласие хранение основных документов, связанных с исследованием до тех пор, пока спонсор не сообщит, что эти документы больше не требуются;
финансовые вопросы организации КИ в данном центре;
обязательства по учету и соблюдению условий хранения исследуемого ЛП.
Содержание договора является предметом проверки Росздравнадзора
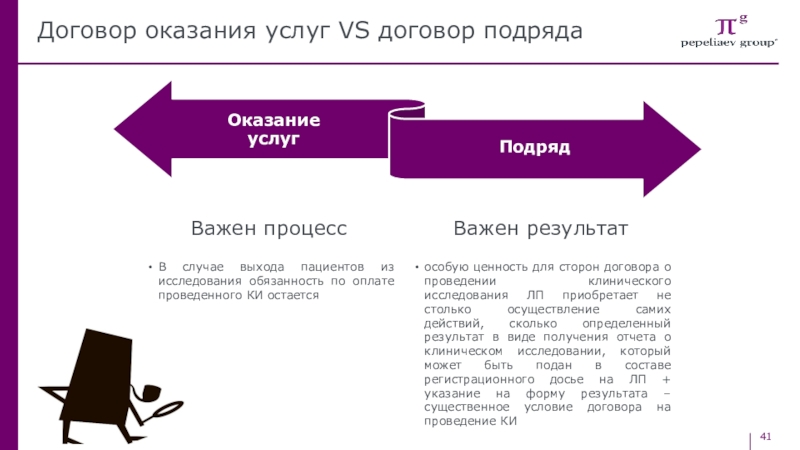
Слайд 41Договор оказания услуг VS договор подряда
Важен результат
Важен процесс
особую ценность
для сторон договора о проведении клинического исследования ЛП приобретает не
столько осуществление самих действий, сколько определенный результат в виде получения отчета о клиническом исследовании, который может быть подан в составе регистрационного досье на ЛП + указание на форму результата – существенное условие договора на проведение КИВ случае выхода пациентов из исследования обязанность по оплате проведенного КИ остается
Слайд 42«Работоподобные» услуги
«Поскольку стороны в силу статьи 421 Гражданского кодекса вправе
определять условия договора по своему усмотрению, обязанности исполнителя по договору
возмездного оказания услуг могут включать в себя не только совершение определенных действий (деятельности), но и представление заказчику результата своих действий»- Постановление Президиума ВАС РФ от 24.01.2012 N 11563/11 по делу N А41-27081/10
Правовая природа договора на проведение КИ
Почему проблема работы vs услуги может быть важной?
Слайд 44Проверки в рамках КИ
Контроль за проведением КИ осуществляет Росздравнадзор
Плановые/внеплановые проверки
в соответствии с Федеральным законом от 26.12.2008 № 294-ФЗ «О защите прав юридических лиц
и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроляhttp://www.roszdravnadzor.ru/control/plan - Ежегодный план проверок Росздравнадзора
Слайд 45Возможные нарушения
Не обеспечено направления в Минздрав сообщения о начале КИ;
Не
обеспечено своевременное назначение исследователей/со-исследователей, принимающих участие в проведении КИ;
Нарушения в
работе НЭК (несоблюдение положений, регламентирующих деятельность НЭК , отсутствие СОП и прочее);Отклонения от протокола;
Нарушения, связанные с информированных согласием пациента (до пациента не доведена новая редакция формы согласия; нарушение процедуры получения согласия; пациент не был своевременно проинформирован по вопросам, которые должны быть отражены в форме информированного согласия и прочее);
Нарушения в сфере хранения исследуемого лекарственного препарата, его учета инвентаризации и пр.