Слайд 1Предельные углеводороды и их производные
Лекция 3
Слайд 2Наиболее простыми органическими соединениями являются предельные углеводороды или алканы
Углеродный скелет
представляет собой открытую линейную или разветвленную цепь
В молекулах этих соединений
все атомы углерода имеют максимальную валентность, равную четырем, поэтому их называют предельными, или насыщенными
В алканах реализуются только одинарные σ-связи
Алканы образуют гомологический ряд, и формула любого члена этого ряда имеет вид CnH2n+2
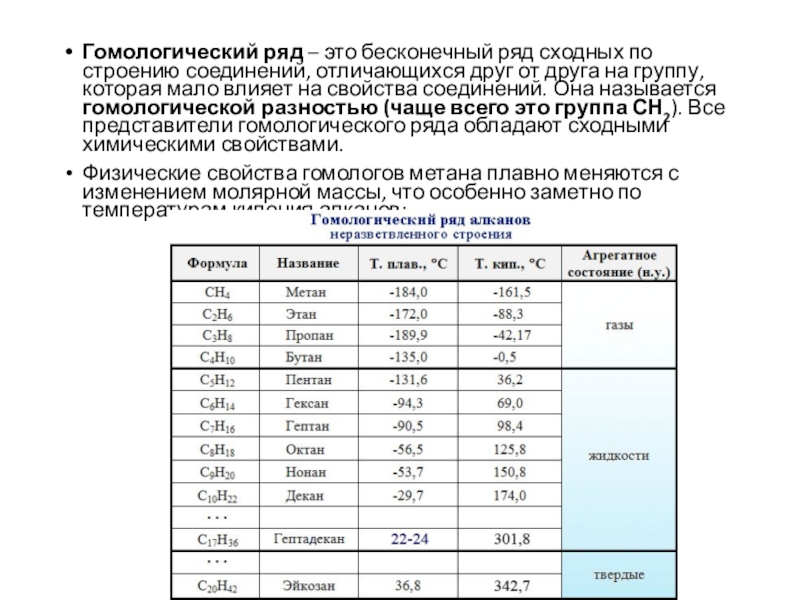
Слайд 3Гомологический ряд – это бесконечный ряд сходных по строению соединений,
отличающихся друг от друга на группу, которая мало влияет на
свойства соединений. Она называется гомологической разностью (чаще всего это группа СН2). Все представители гомологического ряда обладают сходными химическими свойствами.
Физические свойства гомологов метана плавно меняются с изменением молярной массы, что особенно заметно по температурам кипения алканов:
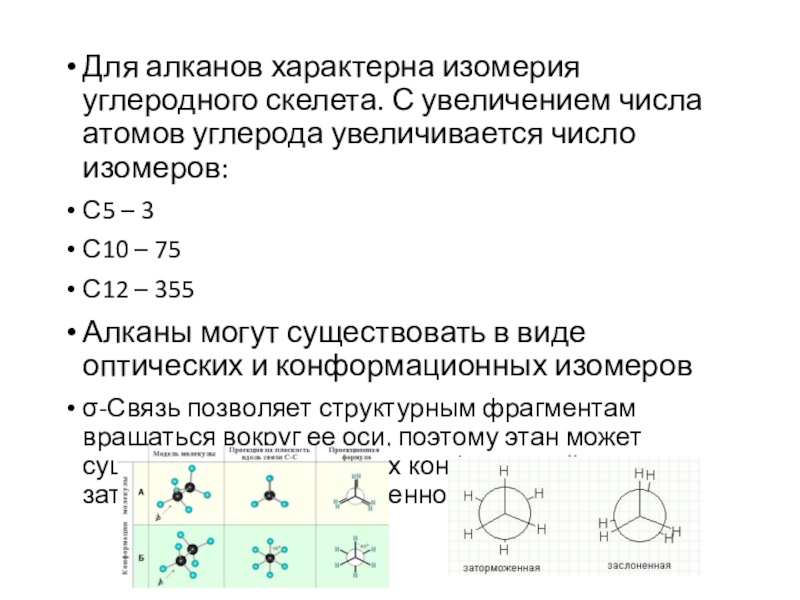
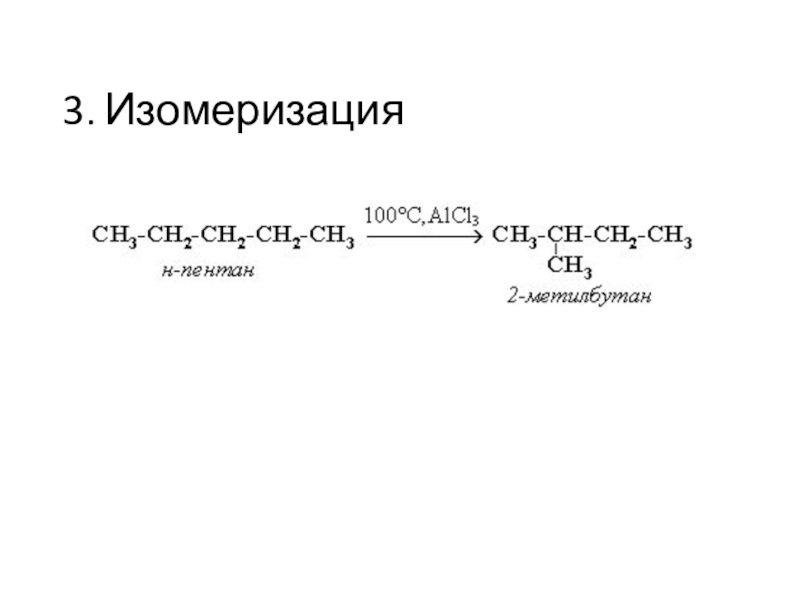
Слайд 4Для алканов характерна изомерия углеродного скелета. С увеличением числа атомов
углерода увеличивается число изомеров:
С5 – 3
С10 – 75
С12 – 355
Алканы
могут существовать в виде оптических и конформационных изомеров
σ-Связь позволяет структурным фрагментам вращаться вокруг ее оси, поэтому этан может существовать в виде двух конформаций: заторможенной и заслоненной.
Слайд 5Способы получения алканов
Предельные углеводороды широко встречаются в природе. Источниками являются:
Природный
газ - основную часть природного газа составляет метан (CH4) —
от 70 до 98 %. В состав природного газа могут входить более тяжёлые углеводороды - гомологи метана
Нефть - природная маслянистая горючая жидкость со специфическим запахом, состоящая в основном из сложной смеси углеводородов различной молекулярной массы и некоторых других химических соединений
Каменный уголь
Горный воск (озокерит) - природный углеводород из группы нефти, по другим данным - из группы нефтяных битумов. Является смесью высокомолекулярных твёрдых насыщенных углеводородов (обычно состоит из 85-87 % углерода и 13-14 % водорода), по консистенции напоминает пчелиный воск, имеет запах керосина
Слайд 6Лабораторные способы получения алканов
1. Реакции с сохранением углеродного скелета
Гидрирование алкенов
и алкинов
Восстановление галогенпроизводных
Восстановление карбонильных соединений
С помощью реактива Гриньяра
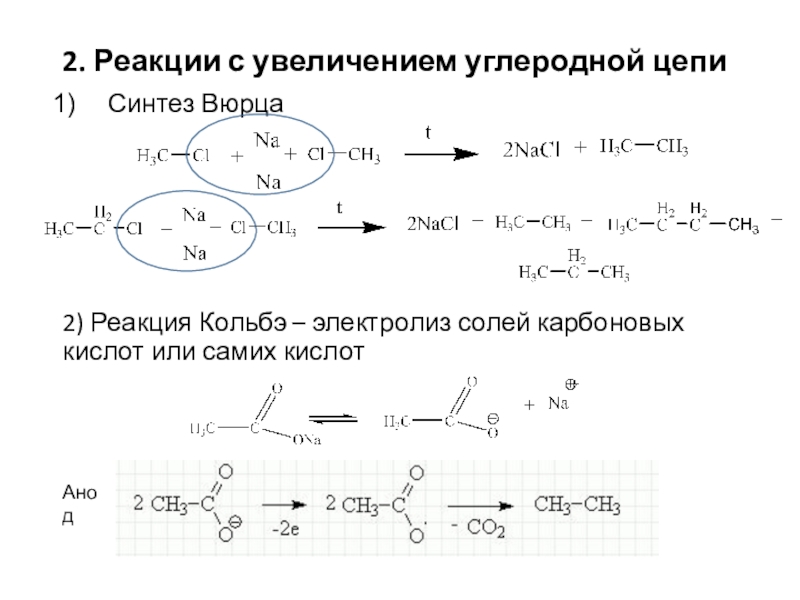
Слайд 72. Реакции с увеличением углеродной цепи
Синтез Вюрца
2) Реакция Кольбэ –
электролиз солей карбоновых кислот или самих кислот
Анод
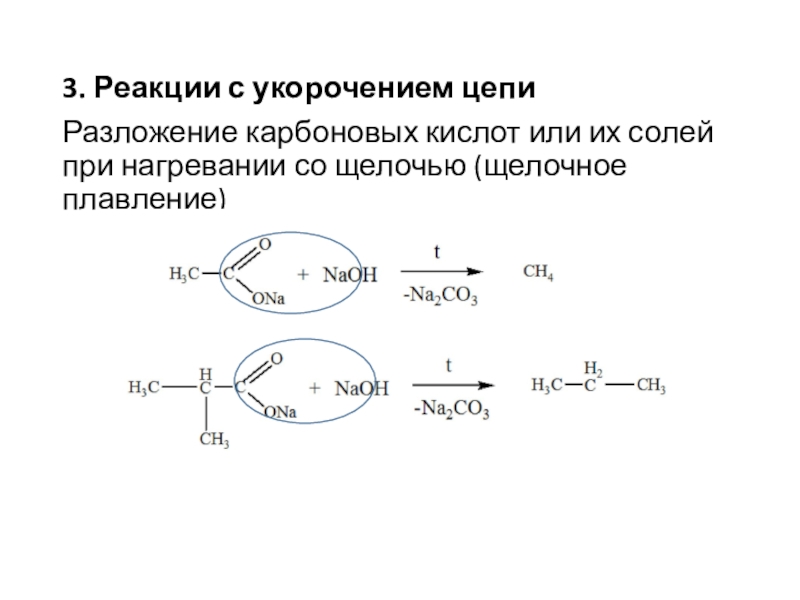
Слайд 83. Реакции с укорочением цепи
Разложение карбоновых кислот или их солей
при нагревании со щелочью (щелочное плавление)
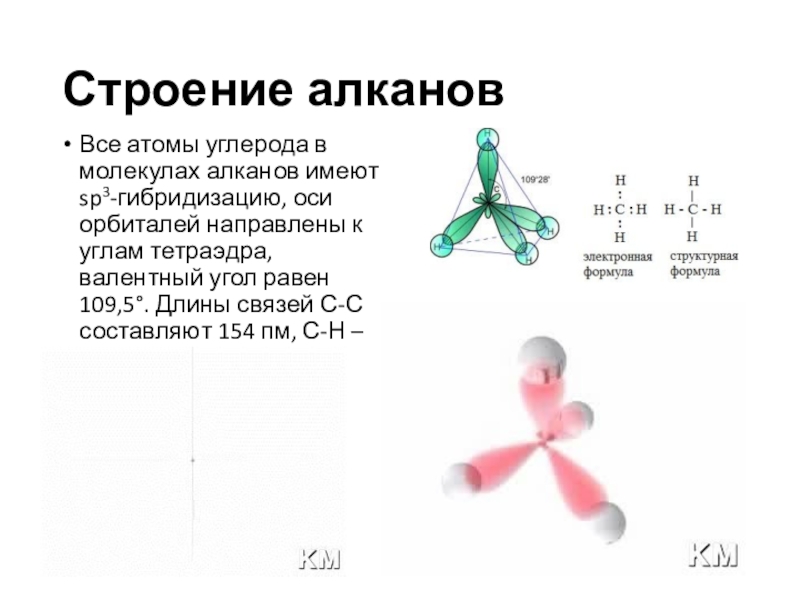
Слайд 9Строение алканов
Все атомы углерода в молекулах алканов имеют sp3-гибридизацию, оси
орбиталей направлены к углам тетраэдра, валентный угол равен 109,5°. Длины
связей С-С составляют 154 пм, С-Н – 109 пм.
Слайд 10Химические свойства алканов
Алканы – химически устойчивые соединения.
Причина: высокая прочность σ-связей
С-С и С-Н; неполярность связей С-С и очень низкая полярность
связей С-Н (небольшая разница в электроотрицательности)
Алканы не проявляют склонности к гетеролитическому разрыву; эти соединения устойчивы к действию ионных реагентов. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они не окисляются сильными окислителями, не взаимодействуют со щелочными металлами.
Неполярные связи алканов способны расщепляться гомолитически при атаке активными свободными радикалами.
Это реакции замещения атомов водорода, расщепления углеродного скелета (крекинг), окисления – частичного или полного (горение)
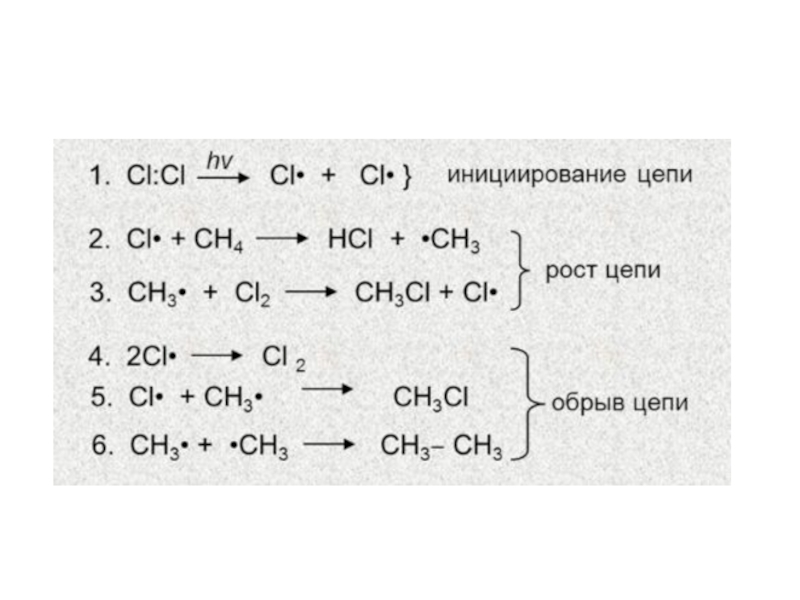
Слайд 111. Реакции замещения (SR)
Свободно-радикальный механизм
Галогенирование. Скорость зависит от типа галогена.
Активно с фтором, с хлором – на свету, с бромом
не идет
Нитрование (по Коновалову) 140-150°С разбавленной азотной кислотой или оксидами азота
Сульфохлорирование (хлористый сульфурил)
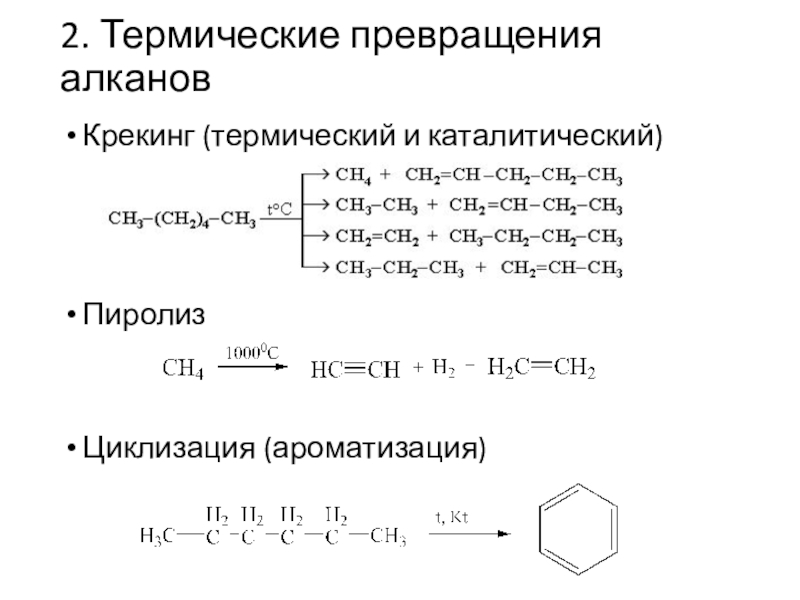
Слайд 132. Термические превращения алканов
Крекинг (термический и каталитический)
Пиролиз
Циклизация (ароматизация)
Слайд 154. Окисление
При высокой температуре на воздухе алканы сгорают до углекислого
газа и воды их пары образуют взрывчатую смесь с воздухом.
При сгорании углеводородов выделяется большое количество тепла (метан - 890 кДж/моль), поэтому они широко применяются как источники тепловой энергии
Слайд 16Реакционная способность
Реакционная способность алканов увеличивается начиная с метана с увеличением
числа атомов углерода в молекуле
В реакциях радикального замещения устойчивость углеводородных
радикалов уменьшается в ряду: третичные, вторичные, первичные. Разветвленные радикалы наиболее стабильны.
Увеличение устойчивости
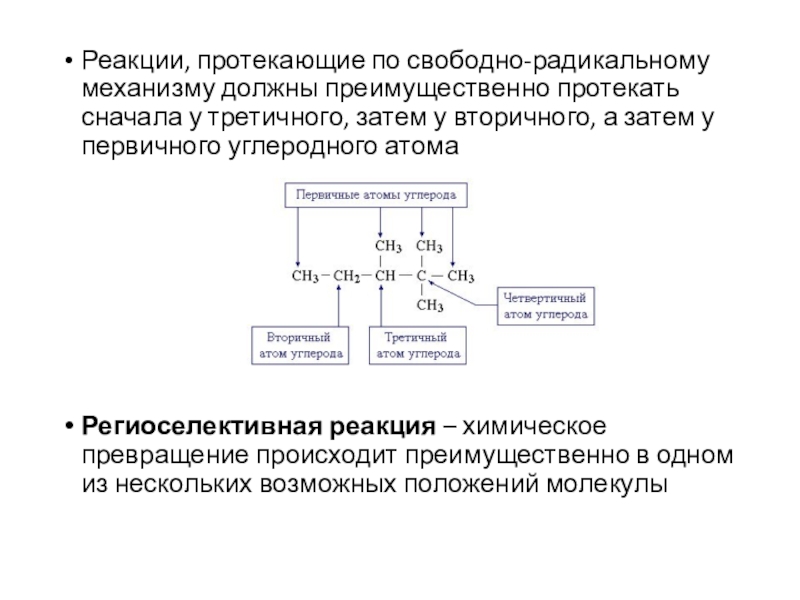
Слайд 17Реакции, протекающие по свободно-радикальному механизму должны преимущественно протекать сначала у
третичного, затем у вторичного, а затем у первичного углеродного атома
Региоселективная
реакция – химическое превращение происходит преимущественно в одном из нескольких возможных положений молекулы
Слайд 18Применение алканов
Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве
ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных
топливах и используются в качестве растворителей.
Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых алканов С19-С35) - белая твеpдая масса без запаха и вкуса (т.пл. 50-70 °C) - применяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых процедур в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.

Слайд 20К галогеналканам причисляют предельные алифатические соединения, в молекулах которых присутствует
атом галогена вместо одного (или нескольких) атома водорода
В классе галогеналканов
наблюдается изомерия строения углеродного скелета (нормальная и разветвленная цепь), изомерия, обусловленная различным расположением галогена в молекуле, и оптическая изомерия
Слайд 21Получение галогеналканов
Реакции замещения
из алканов (свободно-радикальное замещение, SR )
из спиртов (нуклеофильное
замещение, SN )
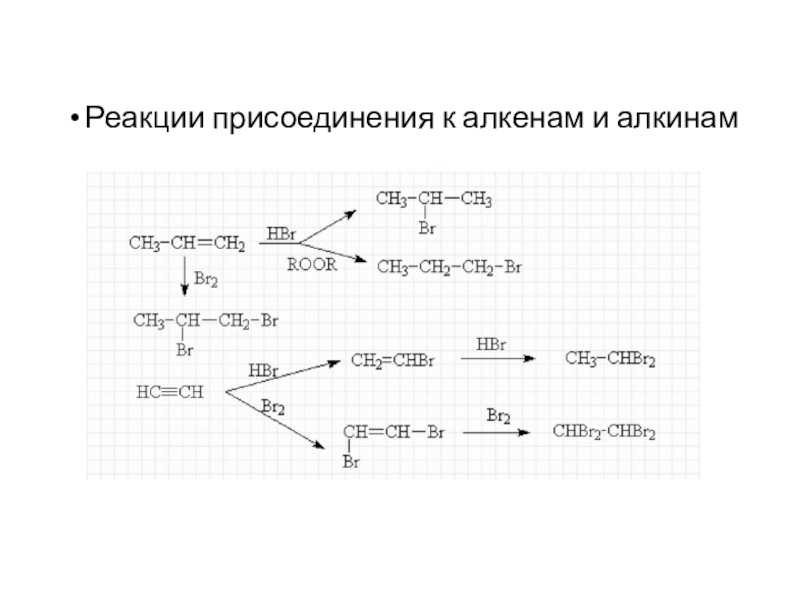
Слайд 22Реакции присоединения к алкенам и алкинам
Слайд 23Строение галогеналканов и реакционная способность
Замена атомов водорода на галоген делает
соединение химически активным, т.к. связь углерода с более электроотрицательным атомом
галогена является полярной и довольно реакционноспособной в реакциях ионного типа.
Полярность ковалентной связи, например С–Cl, приводит к смещению электронной плотности соседних связей в молекуле
Галогеналканы могут вступать в реакции, сопровождающиеся разрывом связи С-галоген и образованием галогенид-ионов.
Для галогенпроизводных характерно замещение галогена на другие группы атомов при действии воды, оснований и солей.
Эти реакции протекают по механизму нуклеофильного замещения (SN), так как положительно заряженный углеродный атом, связанный с галогеном, является центром атаки нуклеофильными реагентами (OH–, OR–, CN–, NH2–, H2O, CH3OH, NH3 и др.).
Слайд 24Химические свойства
Реакции замещения (нуклеофильное)
Под действием нуклеофильного реагента (донора пары электронов)
OH– происходит гетеролитический разрыв полярной связи С–Cl. Электронная пара этой
связи отходит к более электроотрицательному атому Cl, который превращается в анион Cl–
Для замещения галогена цианогруппой применяют цианиды щелочных металлов, реагентом для замещения нитрогруппой служат нитриты щелочных металлов или серебра.
Слайд 25Химические свойства
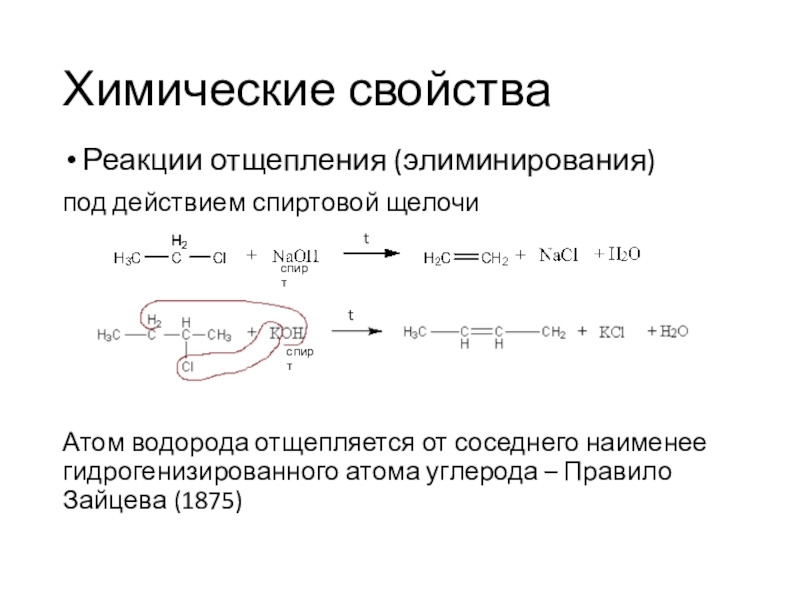
Реакции отщепления (элиминирования)
под действием спиртовой щелочи
Атом водорода отщепляется от
соседнего наименее гидрогенизированного атома углерода – Правило Зайцева (1875)
спирт
спирт
t
t
Слайд 26Важнейшие представители
Хлороформ (он же трихлорметан, метилтрихлорид, хладон 20) — органическое
химическое соединение с формулой CHCl3. При нормальных условиях — бесцветная
летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде, смешивается с большинством органических растворителей. Негорюч.
В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для наркоза хлороформ был применён при хирургических операциях шотландским врачом Симпсоном (1848 г.). В России хлороформ как средство для наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ используется для производства хлордифторметана — фреона (хладона-22):
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов. Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).