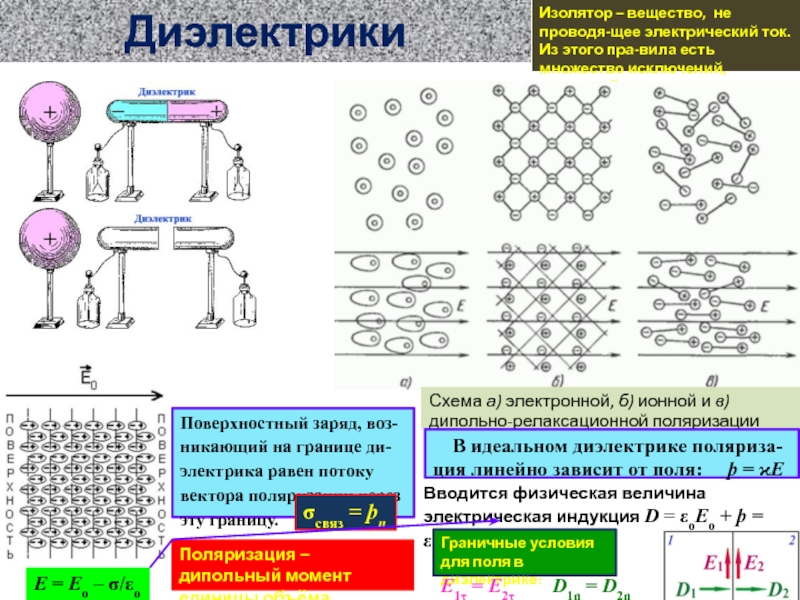
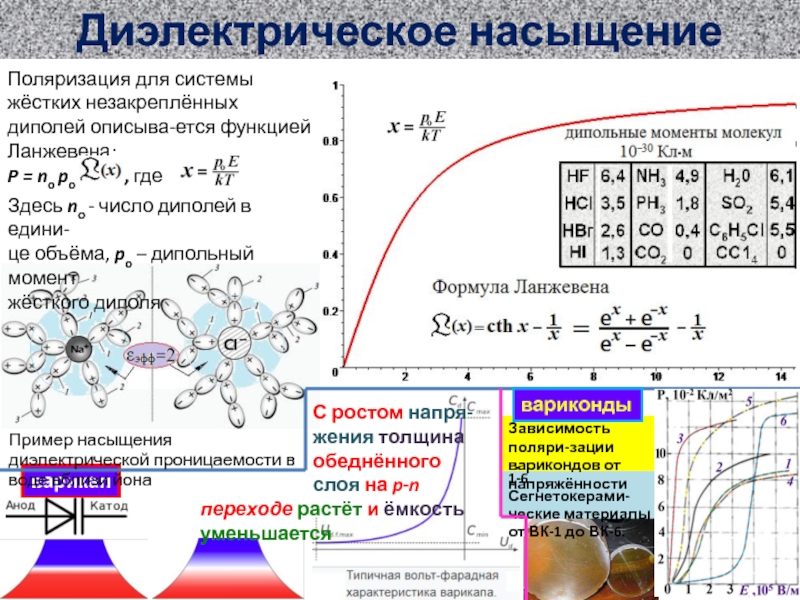
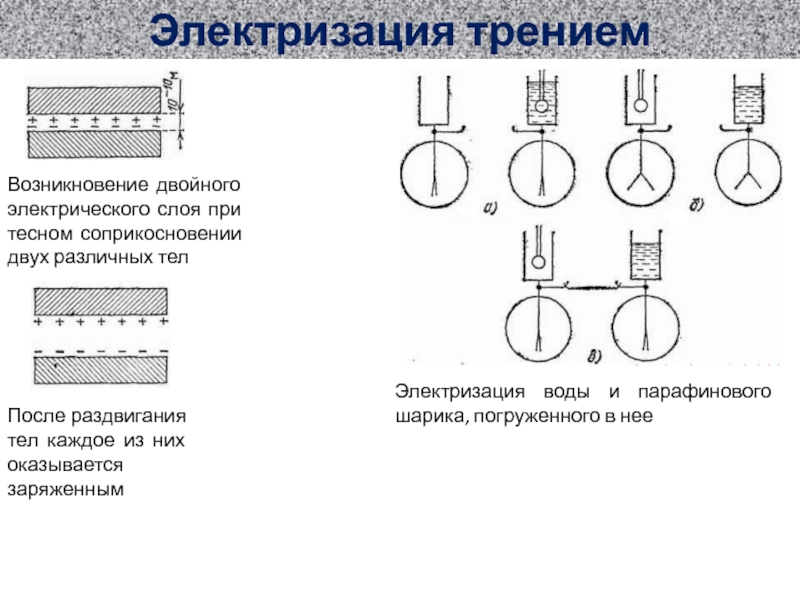
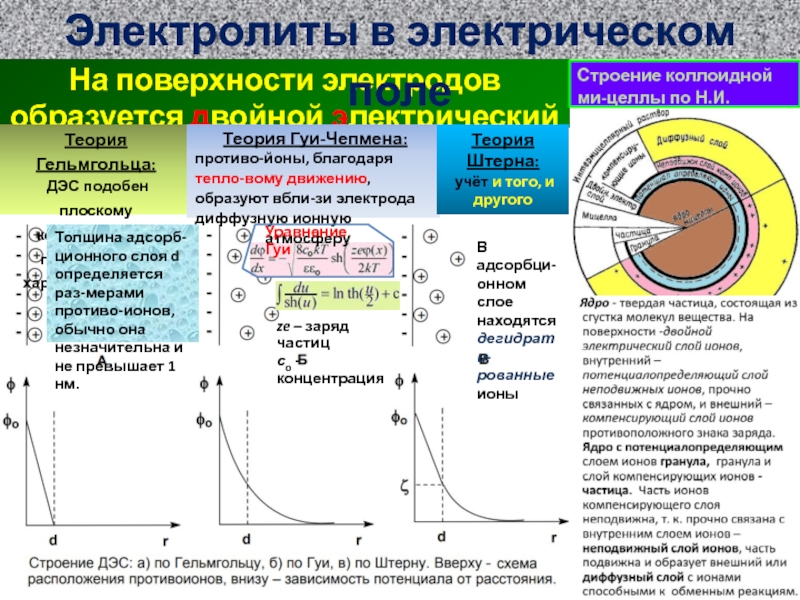
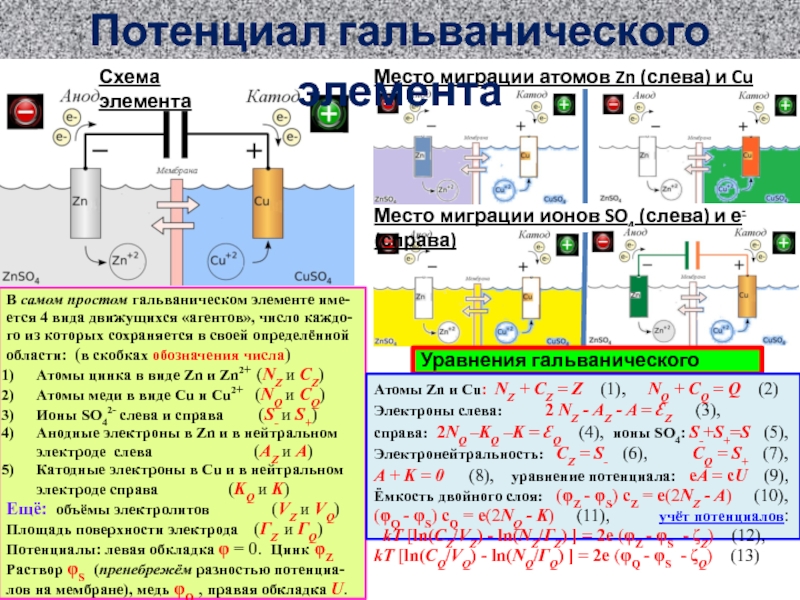
ионов SO4 (слева) и е- (справа)
В самом простом гальваническом элементе
име-ется 4 вида движущихся «агентов», число каждо-го из которых сохраняется в своей определённой области: (в скобках обозначения числа)
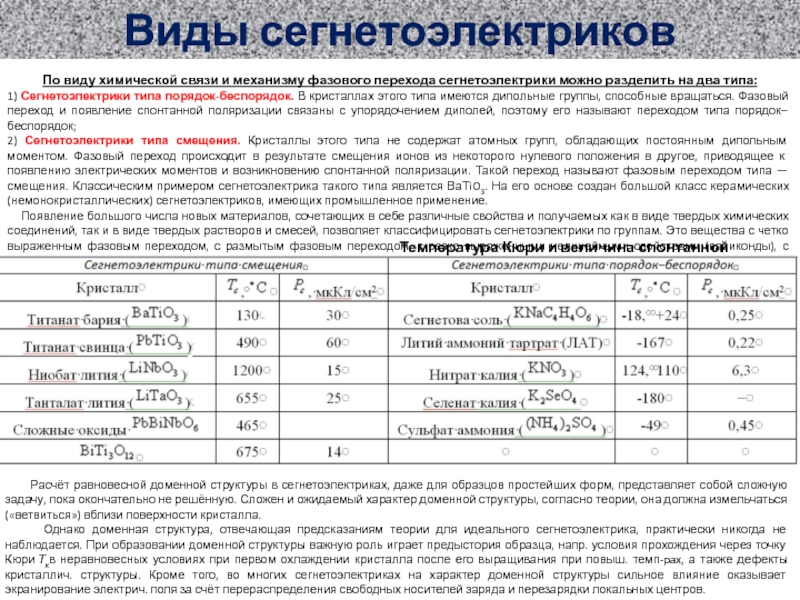
Атомы цинка в виде Zn и Zn2+ (NZ и CZ)
Атомы меди в виде Cu и Cu2+ (NQ и CQ)
Ионы SO42- слева и справа (S- и S+)
Анодные электроны в Zn и в нейтральном электроде слева (AZ и A)
Катодные электроны в Cu и в нейтральном электроде справа (KQ и K)
Ещё: объёмы электролитов (VZ и VQ)
Площадь поверхности электрода (ГZ и ГQ)
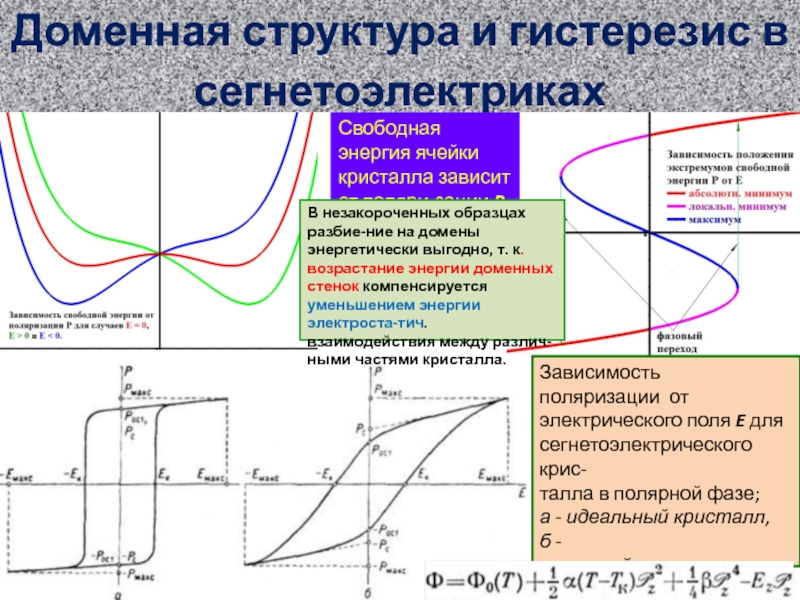
Потенциалы: левая обкладка φ = 0. Цинк φZ
Раствор φS (пренебрежём разностью потенциа-лов на мембране), медь φQ , правая обкладка U. Ёмкость конденсатора c, дв.эл.слоёв cZ и cQ
хим.потенциалы ζZ и ζQ
Уравнения гальванического элемента
Атомы Zn и Cu: NZ + CZ = Z (1), NQ + CQ = Q (2)
Электроны слева: 2 NZ - AZ - A = ƐZ (3),
справа: 2NQ –KQ –K = ƐQ (4), ионы SO4: S-+S+=S (5),
Электронейтральность: CZ = S- (6), CQ = S+ (7),
A + K = 0 (8), уравнение потенциала: eA = cU (9),
Ёмкость двойного слоя: (φZ - φS) cZ = e(2NZ - A) (10),
(φQ - φS) cQ = e(2NQ - K) (11), учёт потенциалов:
kT [ln(CZ/VZ) - ln(NZ/ГZ) ] = 2e (φZ - φS - ζZ) (12),
kT [ln(CQ/VQ) - ln(NQ/ГQ) ] = 2e (φQ - φS - ζQ) (13)
Потенциал гальванического элемента