Слайд 2Производство HNO3
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
Азотная кислота – один из важных продуктов
химической промышленности. По значению и объему производства она занимает второе
место после серной кислоты.
Примерно 75% азотной кислоты, которую получают в промышленности, используется для производства удобрений,
15% – для производства взрывчатых веществ и 10% – для других целей.
Промышленность выпускает разбавленную азотную кислоту нескольких сортов, массовая доля HNO3 в которых составляет от 45 до 60%, и концентрированную азотную кислоту с массовой долей HNO3 97-98%.
Мировое производство азотной кислоты оценивается в 750-800 млн. тонн. При этом только около 15-20% азотной кислоты поступает на рынок. Другая часть азотной кислоты используется предприятиями – продуцентами азотных удобрений, адипиновой кислоты и других химикатов.
Слайд 3Производство HNO3
Физико-химические основы производства азотной кислоты
Химические реакции, лежащие в основе
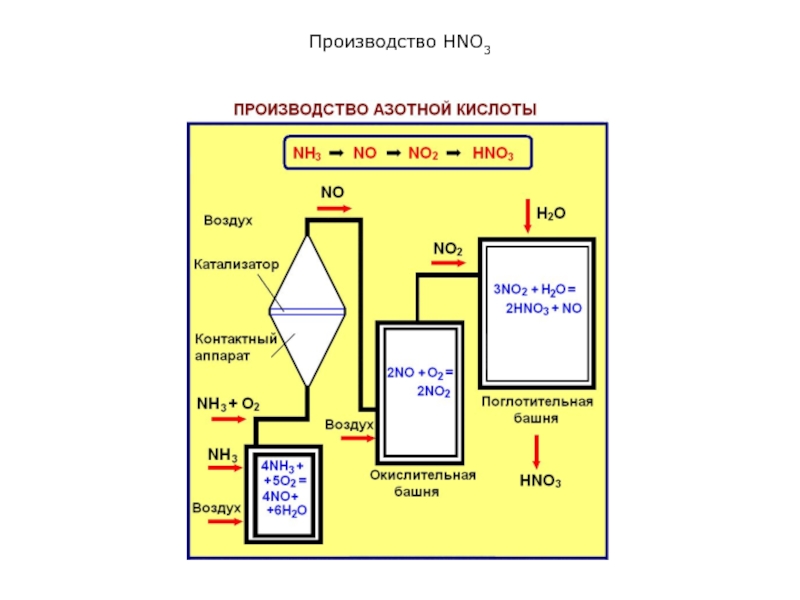
производства. На современных заводах азотную кислоту получают каталитическим окислением аммиака.
Процесс состоит из трех стадий:
1) окисление аммиака кислородом воздуха до NO:
4NH3 + 5O2 = 4NO + 6Н2О; ΔН = –907 кДж
2) окисление оксида азота (II) до оксида азота (IV):
2NO + О2 ⇄ 2NO2; ΔН = –112 кДж
3) абсорбция оксида азота (IV) водой с образованием разбавленной азотной кислоты:
3NO2 + H2O ⇄ 2HNO3 + NO; ΔH = –136 кДж
Каждое из приведенных уравнений является суммарным, потому что фактически процессы состоят из нескольких последовательных или параллельных реакций, то есть сложными.
Слайд 4Производство HNO3
Сырьем для производства азотной кислоты является синтетический аммиак, воздух
и вода.
К чистоте сырья предъявляются высокие требования.
Аммиак, поступающий из цеха
синтеза, предварительно очищают от катализаторной пыли и других примесей, чтобы предотвратить отравление катализатора на первой стадии окисления аммиака до оксида азота (II).
Воздух, использующийся для окисления аммиака, также очищают от пыли и газообразных примесей, попадающих в него из газовых выбросов цехов, расположенных на территории завода. Эти примеси являются каталитическим ядом на стадии окисления аммиака до оксида азота (II).
Воду, необходимую для абсорбции оксида азота (IV) и получения азотной кислоты, подвергают обессоливанию.
Слайд 5Производство HNO3
Первая стадия процесса – контактное окисление NH3. При окислении
аммиака, кроме основной реакции, происходящие и сопутствующие:
4NH3 + 5О2 =
4NO + 6Н2О; ΔН = –907 кДж
4NH3 + 4О2 = 2N2O + 6Н2О; ΔH = –1105 кДж
4NH3 + 3O2 = 2N2 + 6Н2О; ΔН = –1269 кДж
Для получения азотной кислоты необходимо как можно полнее окислять NH3 до NO. Чтобы осуществить именно эту реакцию и затормозить другие, используют катализатор, который проявляет селективное действие: он ускоряет только одну из трех возможных реакций. Наиболее селективным и активным является платиновый катализатор (сплав платины с палладием и родием). Чистая платина при высоких температурах быстрее разрушается.
Окисление NH3 – необратимый процесс, экзотермический, гетерогенно-каталитический.
Повышение температуры – эффективное средство увеличения скорости процесса, но при температуре выше 800-850°С, выход NO снижается, а выход азота и диссоциация NH3 растут. Итак, температуру поддерживают на уровне 800°С (Р = 0,1 МПа), а для систем, работающих под давлением, – 900°С (Р = 0,8МПа).
Повышение давления также ускоряет процесс окисления NH3 и увеличивает выход NO, но при этом возможно и повышение температуры. Кроме того, увеличивается расход катализатора в результате вынесения его мелких частиц с газами и повышаются требования к прочности аппаратуры, что ведет к ее удорожанию.

Слайд 6Производство HNO3
Вторая стадия процесса – окисление оксида азота (II) в
оксид азота (IV). Это самая медленная из всех реакций в
производстве азотной кислоты – она лимитирует общую скорость производственного процесса:
2NO + О2 ⇄ 2NO2; ΔH = –112кДж
Эта реакция обратимая, экзотермическая, гомогенная, некаталитической, происходит с уменьшением объема газа. Согласно принципу Ле Шателье для смещения химического равновесия вправо необходимо снижение температуры и повышение давления.
До 100°С реакция практически полностью идет в сторону образования NO2. При более высокой температуре равновесие смещается влево, а при температуре 700°С и выше реакция совсем не происходит.
Итак, горячие газы, выходящие из контактного аппарата, необходимо охладить до температуры, меньшей 100°С.
При повышенном давлении увеличивается степень превращения NO в NO2 и скорость реакции. На установках, работающих при повышенном давлении, NO практически полностью окисляетcя до NO2. При этом объем аппаратуры уменьшается в сотни раз по сравнению с процессом окисления при атмосферном давлении.
Слайд 7Производство HNO3
Третья стадия – абсорбция оксида азота (IV) водой.
При
взаимодействии NO2 с водой сначала образуется смесь азотной и азотистой
кислот:
2NO2 + H2O ⇄ HNO3 + HNO2; ΔH = –116 кДж
Азотистая кислота в кислых растворах неустойчива и разлагается:
3HNO2 ⇄ HNO3 + 2NO + H2O; ΔH = +76 кДж
Составляя уравнение, имеем:
3NO2 + Н2О ⇄ 2HNO3 + NO; ΔH = –136 кДж (1)
При избытке кислорода в газовой смеси (а он всегда есть) NO снова окисляется:
2NO + О2 ⇄ 2NO2; ΔH = –112 кДж (2)
Складывая уравнения (1) и (2), получаем:
4NO2 + 2Н2О + О2 ⇄ 4HNO3; ΔH = –59,5 кДж
Данная реакция обратимая, экзотермическая, гетерогенная, некаталитическая, для смещения равновесия вправо надо снижать температуру и повышать давление.
Слайд 8Производство HNO3
Производство разбавленной азотной кислоты
В зависимости от применяемого давления технологические
схемы производства разбавленной азотной кислоты делят на три группы:
а)
системы, работающие при атмосферном давлении;
б) системы, работающие при повышенном давлении;
в) комбинированные системы, в которых окисление аммиака осуществляют при низком давлении, а переработку оксидов азота в азотную кислоту – при повышенном.
Системы, работающие при атмосферном давлении, характеризуются малой интенсивностью процессов окисления NO и абсорбции NO2 и большими размерами абсорбционной аппаратуры.
Современными являются установки с повышенным давлением, особенно комбинированные. Сначала из тщательно очищенных воздуха и аммиака готовят аммиачно-воздушную смесь, учитывая, что при определенном содержании аммиака такая смесь является взрывоопасной. Так, при 18°С, если массовая доля NH3 в смеси составляет 16-28%, смесь становится взрывоопасной. В промышленных условиях работают с аммиачно-воздушной смесью, в которой содержание аммиака находится за пределами взрываемости. Чаще всего массовая доля NH3 в смеси 10-12%.

Слайд 9Производство HNO3
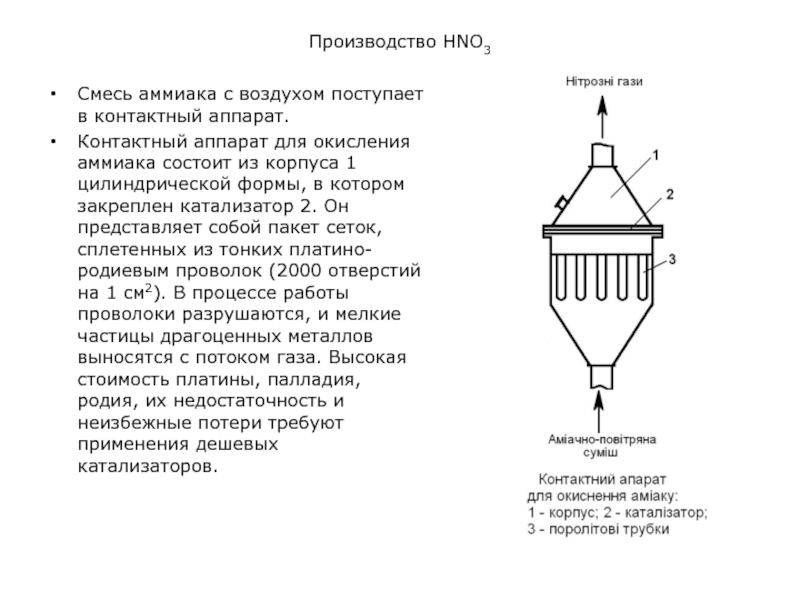
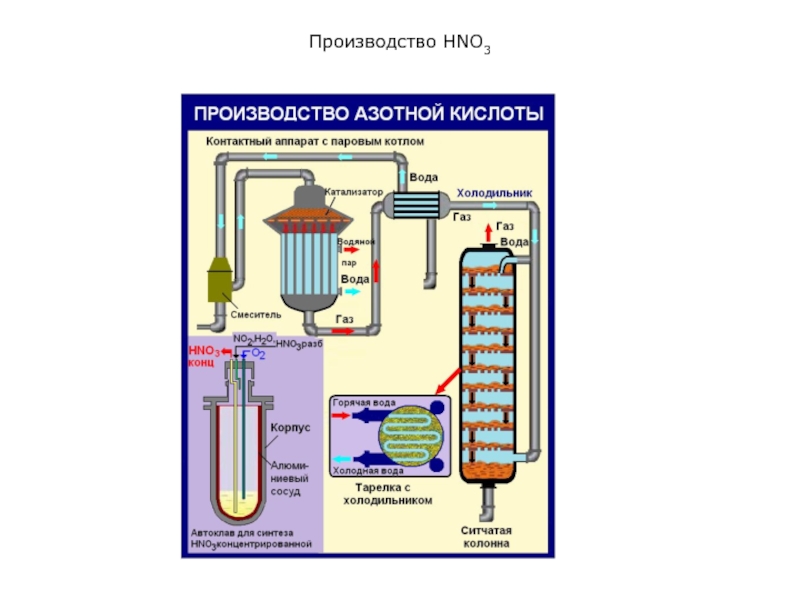
Смесь аммиака с воздухом поступает в контактный аппарат.
Контактный аппарат
для окисления аммиака состоит из корпуса 1 цилиндрической формы, в
котором закреплен катализатор 2. Он представляет собой пакет сеток, сплетенных из тонких платино-родиевым проволок (2000 отверстий на 1 см2). В процессе работы проволоки разрушаются, и мелкие частицы драгоценных металлов выносятся с потоком газа. Высокая стоимость платины, палладия, родия, их недостаточность и неизбежные потери требуют применения дешевых катализаторов.
Слайд 10Производство HNO3
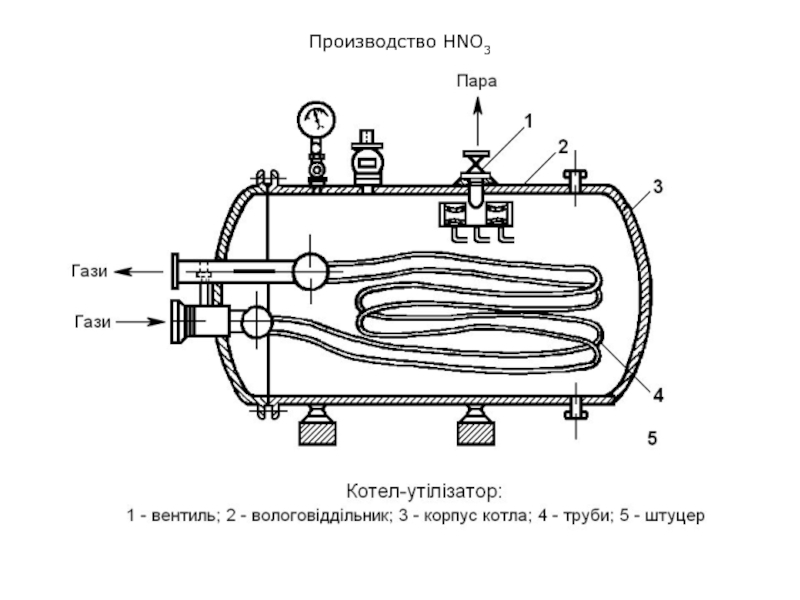
Горячие газы, выходящие из контактного аппарата, поступают в котел-утилизатор
на охлаждение и далее в окислительные и абсорбционные башни (барботажные
[барботаж – пропускание через жидкость газа или пара под давлением в специальный барботер] колонны).
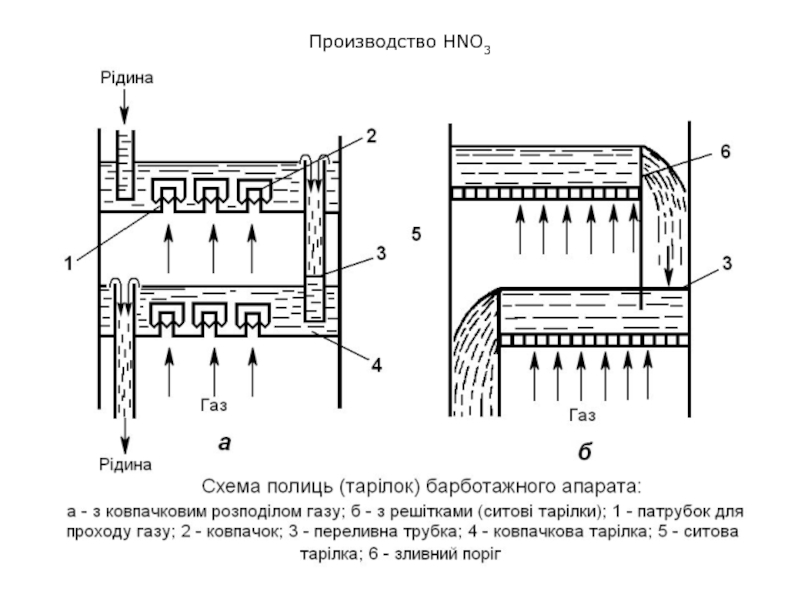
Здесь оксид азота (II) при наличии избытка кислорода превращается в оксид азота (IV), который при 0,8-1,0 МПа смешивают с водой с образованием азотной кислоты.
Оба процесса – окисление NО и абсорбция NО2 водой – осуществляются практически одновременно в той же аппаратуре.
В колонну сверху подается чистая вода. Она стекает по тарелкам вниз навстречу газам (принцип противотока), и образуется азотная кислота, массовая доля HNO3 в которой составляет примерно 60-62%.
Степень переработки оксидов азота составляет 98-99%. Объемная доля оксидов азота в отходящих газах – 1-2%.
Слайд 15Производство HNO3
Концентрированную азотной кислоты производят прямым синтезом NО с кислородом
и водой под давлением:
4NO + 3О2 + 2Н2О = 4HNО3
Кроме
прямого синтеза, применяют концентрирование разбавленной азотной кислоты способом перегонки ее с концентрированной серной кислотой, которая выполняет роль водопоглощающего средства.
Хранение и транспортировка азотной кислоты.
Разбавленную азотную кислоту (массовая доля в растворе 45-60%) хранят на складах в резервуарах из нержавеющей стали. Небольшие количества разбавленной азотной кислоты перевозят в стеклянных бутылях, которые упаковывают в корзины и обкладывают древесной стружкой, пропитанной огнеупорными веществами. Большие количества разбавленной азотной кислоты перевозят в железнодорожных цистернах из нержавеющей стали.
Концентрированную кислоту хранят в резервуарах и перевозят в железнодорожных цистернах из алюминия.
Слайд 16Производство HNO3
Цистерны для концентрированной азотной кислоты
Слайд 17Производство HNO3
Из истории производства азотной кислоты
Первый завод синтетической азотной кислоты,
которая производилась путем каталитического окисления аммиака (способ В. Оствальда), был
построен в Германии в 1909 p., позже – в других странах, но производство было несовершенным.
В Украине азотную кислоту производили из чилийской селитры. В годы первой мировой войны, когда спрос на азотную кислоту в связи с ее стратегическим значением начал расти, возникла необходимость в поисках способов получения кислоты без использования импортной селитры.
В 1915 г. инженер И.И. Андреев разработал совершенный способ каталитического окисления аммиака. В конце 1916 г. в Донецке (Юзовке) был построен первый завод, который производил азотную кислоту по этому способу. С развитием производства синтетического аммиака данный способ получил распространение во всех странах мира.
Но на первых азотнокислотных установках процесс проводился только под атмосферным давлением. При этом 90% NО окислялось, а 10% выбрасывалось в атмосферу с отходящими газами. Многие заводы до сих пор работают по такому способу. Отходящий газ – «лисий хвост» – очень вреден для всего живого.

Слайд 18Производство HNO3
Из истории производства азотной кислоты
Сейчас найден ряд химических способов
борьбы с «лисьими хвостами».
Например, оксиды азота отходящих газов разлагаются
на азот и кислород с помощью палладированного оксида алюминия как катализатора этого процесса:
2NО2 –(Al2O3, Pd) N2 + 2О2
Этот способ борьбы с загрязнением атмосферы применяют на многих современных установках. Если же процесс проводить при повышенном давлении, то удается почти полностью избавиться от оксидов азота в отходящих газах.
Слайд 19Производство HNO3
Основные направления совершенствования производства азотной кислоты
В связи с растущей
потребностью сельского хозяйства в минеральных удобрениях объем производства азотной кислоты
увеличивается.
Разрабатываются новые комбинированные системы большой мощности. Они проектируются на основе применения кислорода и концентрированных оксидов азота, которые дадут возможность значительно уменьшить размеры аппаратов и трубопроводов и соответственно снизить капиталовложения.
Важным направлением является разработка высокоактивных, селективных, термостойких, механически прочных неплатиновых катализаторов, а также поиски способов сокращения потерь платины и других драгоценных металлов с помощью их эффективного улавливания.