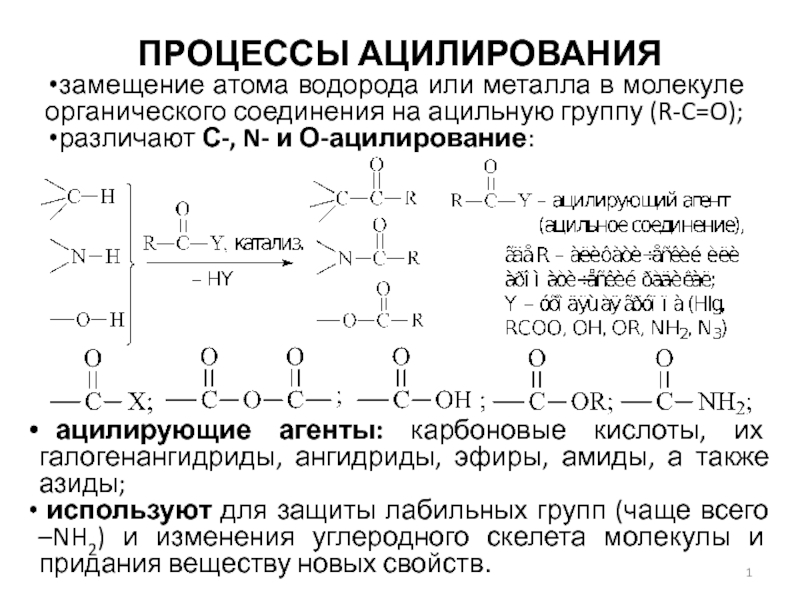
Слайд 1ПРОЦЕССЫ АЦИЛИРОВАНИЯ
замещение атома водорода или металла в молекуле органического соединения
на ацильную группу (R-C=O);
различают С-, N- и О-ацилирование:
ацилирующие
агенты: карбоновые кислоты, их галогенангидриды, ангидриды, эфиры, амиды, а также азиды;
используют для защиты лабильных групп (чаще всего –NH2) и изменения углеродного скелета молекулы и придания веществу новых свойств.
Слайд 2C-ацилирование аренов по Фриделю-Крафтсу (синтез ароматических кетонов)
Ацилирующие агенты: в основном,
карбоновые кислоты, их ангидриды и хлорангидриды.
Реакция родственна алкилированию по
Фриделю-Крафтсу.
Субстраты – активированные арены.
Механизм SE, но в отличие от алкилирования реакция ацилирования необратимая;
Катализаторы — те же вещества, что и при алкилировании: протонные и апротонные кислоты, оксид алюминия, силикагель и др.;
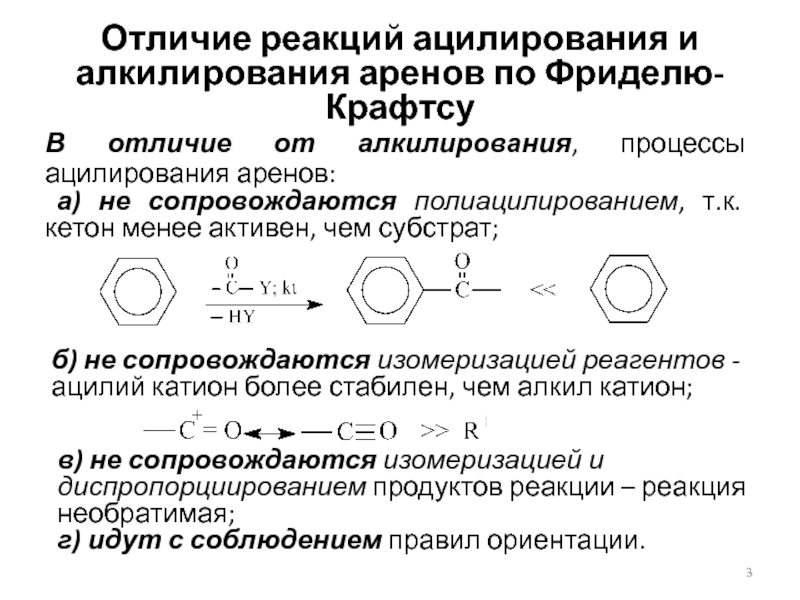
Слайд 3Отличие реакций ацилирования и алкилирования аренов по Фриделю-Крафтсу
В отличие от
алкилирования, процессы ацилирования аренов:
а) не сопровождаются полиацилированием, т.к. кетон
менее активен, чем субстрат;
б) не сопровождаются изомеризацией реагентов - ацилий катион более стабилен, чем алкил катион;
в) не сопровождаются изомеризацией и диспропорциированием продуктов реакции – реакция необратимая;
г) идут с соблюдением правил ориентации.
Слайд 4Механизм образования электрофильных частиц
В результате взаимодействия ацилирующих агентов с катализатором
образуются электрофильные частицы:
- во-первых, биполярный ион, который является более
слабым, но более вероятным реагентом, чем свободный ацилий-катион;
- во-вторых, катионы ацилия [RC+=O ↔ RC≡O+], которые значительно активнее комплекса и стабильнее, чем алкилкатионы (за счет более равномерного распределения электронного облака по частице и образования оксониевого катиона). Чаще всего ацилий катионы образуются при использовании ацилхлорида.
Слайд 5Количество кислоты Льюиса
должно быть не менее 1 моль на
моль субстрата, так как катализатор взаимодействует с образовавшимся кетоном и
выводится из сферы реакции вместе с продуктом в виде вторичной электрофильной частицы:
если кетон остается в сфере реакции, то вторичная электрофильная частица, образованная им с катализатором или ацилий катионом, способна реагировать с субстратом, что приводит к синтезу побочных продуктов реакции - спиртов:
Слайд 6С-ацилирование аренов хлорангидридами кислот
Хлорангидриды кислот — самые активные ацилирующие агенты,
но малодоступные, нестабильные, дорогие (легко разлагаются влагой воздуха, трудно сохранить,
поэтому их синтезируют перед использованием) и самые токсичные и агрессивные (выделяется HCl).
Условия реакции (температура, время, катализатор) зависят от активности субстрата и хлорангидрида.
Чаще всего синтез кетонов осуществляют в присутствии активного катализатора хлорида алюминия при низких температурах. При использовании хлорида цинка реакция идет в более жестких условиях.
Мало активированные арены, содержащие карбонильные, нитро-, циано-, сульфо-, карбоксильные и другие электроноакцепторные группы, а также пиридины и аналогичные циклы в реакцию не вступают.
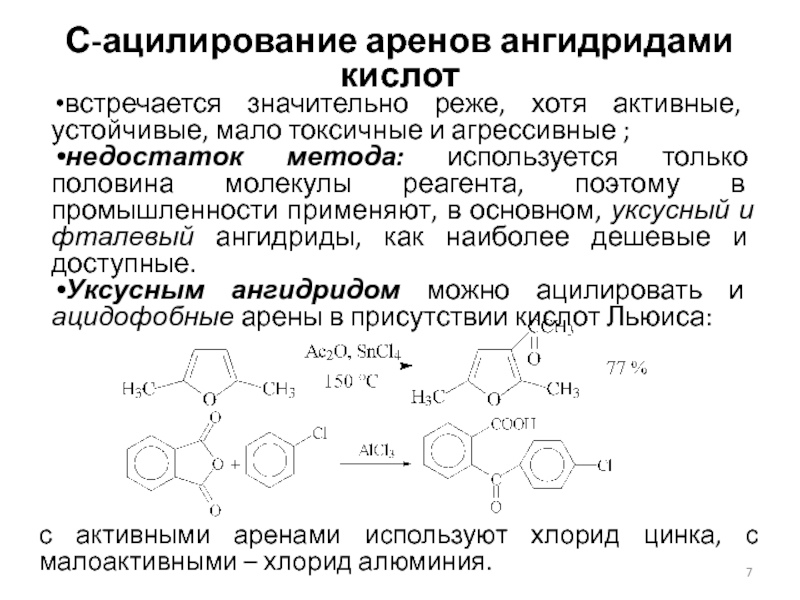
Слайд 7С-ацилирование аренов ангидридами кислот
встречается значительно реже, хотя активные, устойчивые, мало
токсичные и агрессивные ;
недостаток метода: используется только половина молекулы реагента,
поэтому в промышленности применяют, в основном, уксусный и фталевый ангидриды, как наиболее дешевые и доступные.
Уксусным ангидридом можно ацилировать и ацидофобные арены в присутствии кислот Льюиса:
с активными аренами используют хлорид цинка, с малоактивными – хлорид алюминия.
Слайд 8С-ацилирование карбоновыми кислотами
встречается редко из-за малой активности реагента, который наиболее
доступен, стабилен, дешев, наименее токсичный и агрессивный.
катализаторы - серная
кислота или кислоты Льюиса. Иногда предварительно уменьшают электроноакцепторные свойства заместителя в субстрате:
Далее рассмотрим реакции в которых реагент не является
хлорангидридом
Слайд 9Ацилирование аренов по Гаттерману-Коху (синтез альдегидов)
Хлорангидрид муравьиной кислоты нестабильное соединение
и в реакциях Фриделя-Крафтса не применяется. Однако при пропускании безводных
оксида углерода (II) и хлороводорода в смесь арена, хлоридов алюминия и меди (I) образуется соответствующий ему ацилий ион и реагирует с ареном по механизму SE:
Реагируют арены с активностью не ниже галогенбензолов. Фенолы не реагируют. В арен вступает лишь одна формильная группа, почти исключительно в п-положение к имеющемуся заместителю.
Выход альдегидов при 25—60 °С обычно около 50—60 %, но с увеличением давления он повышается до 90 %.
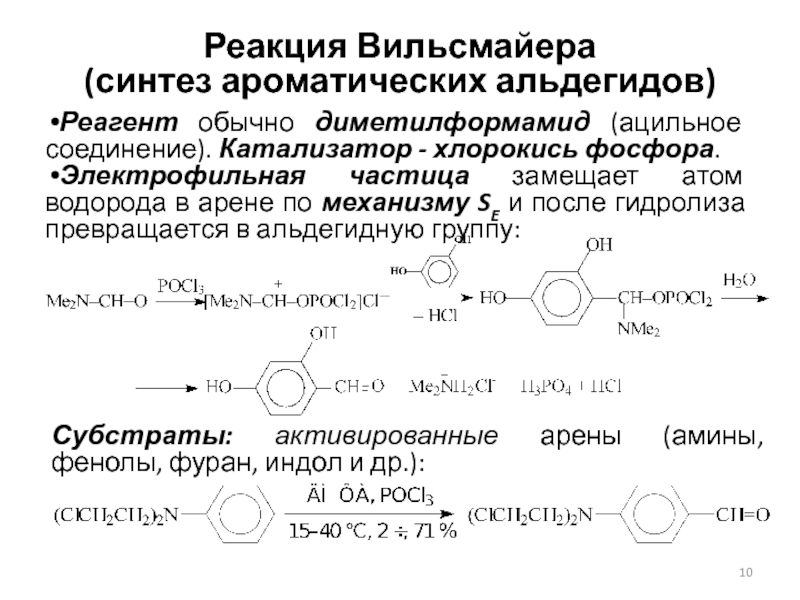
Слайд 10Реакция Вильсмайера
(синтез ароматических альдегидов)
Реагент обычно диметилформамид (ацильное соединение). Катализатор
- хлорокись фосфора.
Электрофильная частица замещает атом водорода в арене
по механизму SE и после гидролиза превращается в альдегидную группу:
Субстраты: активированные арены (амины, фенолы, фуран, индол и др.):
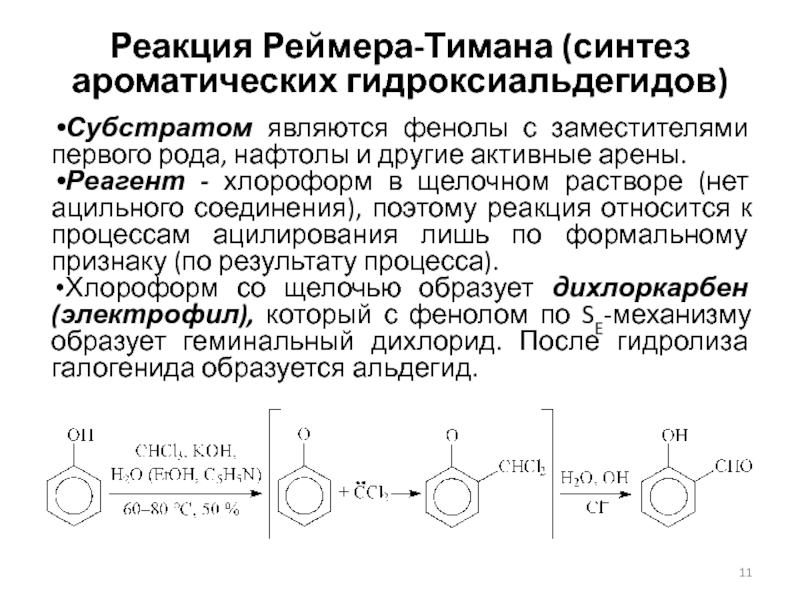
Слайд 11Реакция Реймера-Тимана (синтез ароматических гидроксиальдегидов)
Субстратом являются фенолы с заместителями первого
рода, нафтолы и другие активные арены.
Реагент - хлороформ в щелочном
растворе (нет ацильного соединения), поэтому реакция относится к процессам ацилирования лишь по формальному признаку (по результату процесса).
Хлороформ со щелочью образует дихлоркарбен (электрофил), который с фенолом по SE-механизму образует геминальный дихлорид. После гидролиза галогенида образуется альдегид.
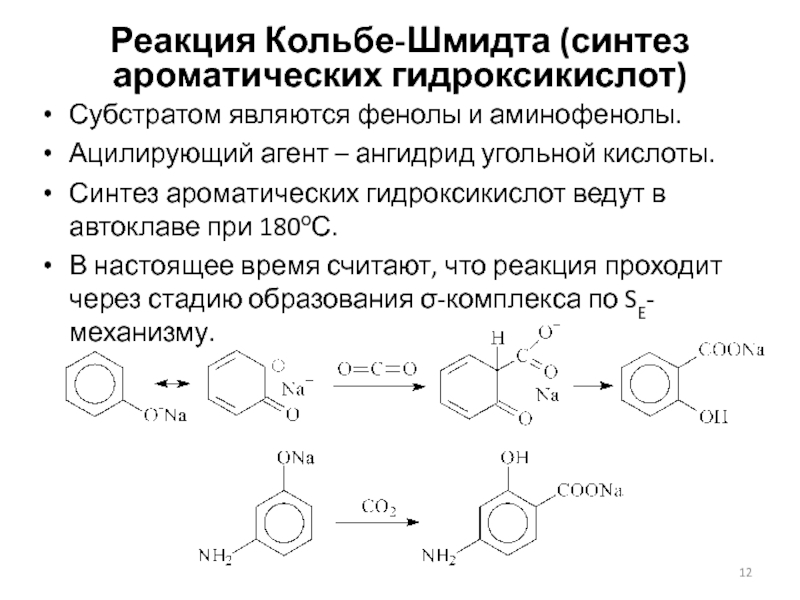
Слайд 12Реакция Кольбе-Шмидта (синтез ароматических гидроксикислот)
Субстратом являются фенолы и аминофенолы.
Ацилирующий
агент – ангидрид угольной кислоты.
Синтез ароматических гидроксикислот ведут в автоклаве
при 180оС.
В настоящее время считают, что реакция проходит через стадию образования -комплекса по SE-механизму.
Слайд 13N-ацилирование (синтез амидов кислот)
применяется как для получения нового соединения, так
и для защиты аминогруппы;
ацилирующие агенты: все ацильные производные карбоновых кислот;
обычно реакцию рассматривают как нуклеофильное замещение уходящей группы в ацильных соединениях в два этапа: присоединение — отщепление (SNAE):
скорость реакции ацилирования и условия ее проведения
в значительной мере зависят от строения ацилирующего
агента и субстрата.
Слайд 14Реакционная способность ацильных соединений
Определяется величиной положительного заряда на атоме углерода
карбонильной группы и способностью уходящей группы уходить.
Величина положительного заряда
Сd+=Оd- группы и, следовательно, активность реагента увеличивается с повышением электроноакцепторных свойств радикала (R). От этого фактора зависит и сила кислоты, поэтому сравнивая константы диссоциации кислот можно оценить и их ацилирующую активность. Так, сила кислот и ацилирующая активность увеличивается в ряду:
Слайд 15Влияние уходящей группы на d+ ацильной группы
В ацильных соединениях одной
и той же кислоты, величина d+ - результат взаимодействия электронных
облаков карбонильной и уходящей групп:
Величина d+ увеличивается при возрастании отрицательного индукционного эффекта и уменьшении положительного эффекта сопряжения.
Слайд 16Способность группы Y уходить
чем более сильным основанием является Y ,
тем хуже уходит. При определении силы основания обычно используют константу
диссоциации сопряженной с ним кислоты: чем сильнее кислота, тем слабее сопряженное с ней основание:
В связи с величиной заряда и способности группы Y уходить ацилирующая активность уменьшается от хлорангидрида кислоты к амиду.
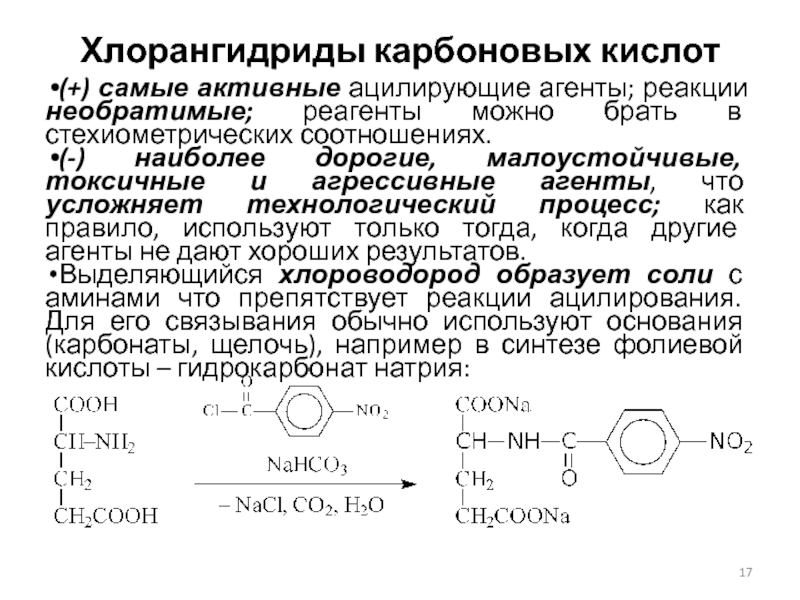
Слайд 17Хлорангидриды карбоновых кислот
(+) самые активные ацилирующие агенты; реакции необратимые; реагенты
можно брать в стехиометрических соотношениях.
(-) наиболее дорогие, малоустойчивые, токсичные
и агрессивные агенты, что усложняет технологический процесс; как правило, используют только тогда, когда другие агенты не дают хороших результатов.
Выделяющийся хлороводород образует соли с аминами что препятствует реакции ацилирования. Для его связывания обычно используют основания (карбонаты, щелочь), например в синтезе фолиевой кислоты – гидрокарбонат натрия:
Слайд 18Ангидриды карбоновых кислот
(+) активные ацилирующие агенты, реакции необратимы, используют стехиометрические
соотношения реагентов.
(-) дороже и токсичнее кислот и в реакциях
N-ацилирования используется только половина молекулы, поэтому в синтезах, в основном, встречается наиболее доступный и дешевый уксусный ангидрид:
Условия реакции (температура, время, катализатор и т.д.) зависят от активности субстрата. Иногда ангидрид используют для синтеза других ангидридов:
Слайд 19Карбоновые кислоты
(+) наиболее дешевые и доступные;
(-) значительно менее
активные реагенты, чем их ангидриды, образуют с аминами соли, которые
не ацилируются, реакция обратимая.
Для разрушения солей реакционную массу нагревают до образования достаточного количества исходного амина и кислоты:
Для смещения равновесия в сторону целевого продукта применяют избыток наиболее дешевого реагента (кислоты или амина) и/или выводят образующуюся воду из сферы реакции (отгоняют или связывают средствами, поглощающими воду). Для ускорения реакции используют минеральную кислоту в качестве катализатора.
Слайд 20Формилирование и ацетилирование аминов
проводят в избытке кислоты (с муравьиной
кислотой при 150 °С, с уксусной — при 110—115 °С);
используют не
только 100 %-ные кислоты, но и кислоты с меньшей концентрацией (например, 80 %-ную уксусную кислоту);
нередко реакцию проводят с добавлением бензола. Образующаяся вода отгоняется с избытком кислоты в виде азеотропной смеси с бензолом. Это позволяет проводить реакцию с почти количественным выходом.
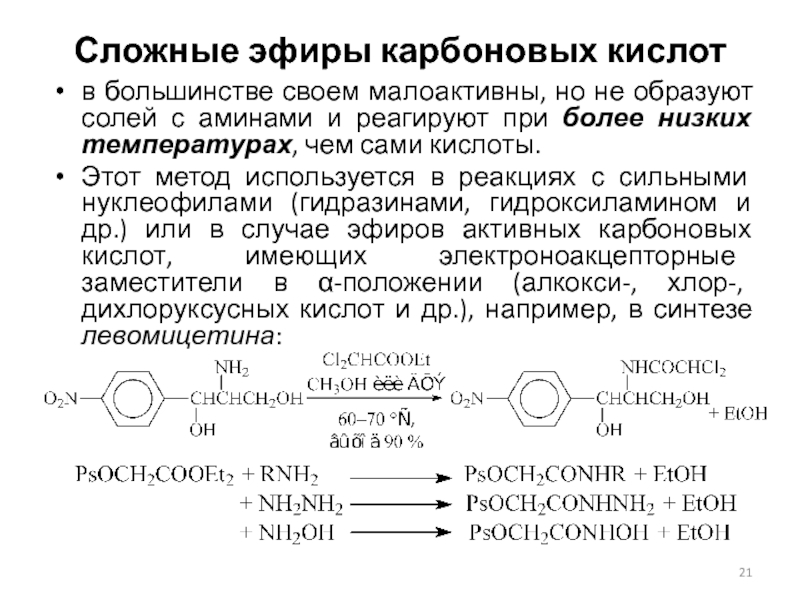
Слайд 21Сложные эфиры карбоновых кислот
в большинстве своем малоактивны, но не образуют
солей с аминами и реагируют при более низких температурах, чем
сами кислоты.
Этот метод используется в реакциях с сильными нуклеофилами (гидразинами, гидроксиламином и др.) или в случае эфиров активных карбоновых кислот, имеющих электроноакцепторные заместители в α-положении (алкокси-, хлор-, дихлоруксусных кислот и др.), например, в синтезе левомицетина:
Слайд 22N-ацилирование амидами карбоновых кислот
применяют очень редко из-за малой активности реагента.
Тем не менее, известны реакции, где применение амидов в качестве
ацилирующих агентов технологически и экономически оправдано.
Амид муравьиной кислоты, который получают из окиси углерода и аммиака, применяется для формилирования аминов:
Слайд 23О-Ацилирование (синтез сложных эфиров)
проводится реже, чем аминогрупп и идет менее
энергично.
Механизмы О- и N-ацилирования, обычно, одинаковые SNAE, поэтому активность
ацильных соединений изменяется также, как при N-ацилировании.
Условия реакции зависят от строения субстрата и реагента.
Слайд 24О-Ацилирование хлорангидридами кислот
Для связывания выделяющегося хлористого водорода применяют основания или
ведут реакцию в таких условиях (среда, температура), когда хлористый водород
удаляется из реакционной массы.
Основания используют также для активации малоактивных субстратов, например, фенолов
В ряде случаев гидроксисоединения ацилируют смесью кислоты и треххлористого фосфора (PCl3) или хлорокиси фосфора (POCl3). Вероятно, реакция протекает через стадию образования хлорангидрида кислоты (производство салола):
Слайд 25О-Ацилирование ангидридами кислот
используется только половина молекулы, поэтому в промышленности применяют,
в основном, уксусный и фталевый ангидриды.
в водно-щелочных растворах ацилирование
уксусным ангидридом проводят при температуре до 50 °С, так как в этих условиях уксусный ангидрид реагирует с гидроксисоединениями значительно быстрее, чем с водой.
в неводных растворителях ацилируют при температуре кипения реакционной массы.
для ускорения реакции уксусного ангидрида с гидроксисоединениями в ряде случаев используют кислоты (серную, фосфорную) или пиридин.
Слайд 26О-Ацилирование карбоновыми кислотами
наиболее дешевый и доступный реагент
но значительно менее
активный, чем ангидриды, не взаимодействует с фенолами,
реакции со спиртами
обратимые,
Реакцию этерификации обычно ведут в присутствии минеральных кислот (серной, соляной, фосфорной), с азеотропной отгонкой воды, в избытке одного из реагентов.
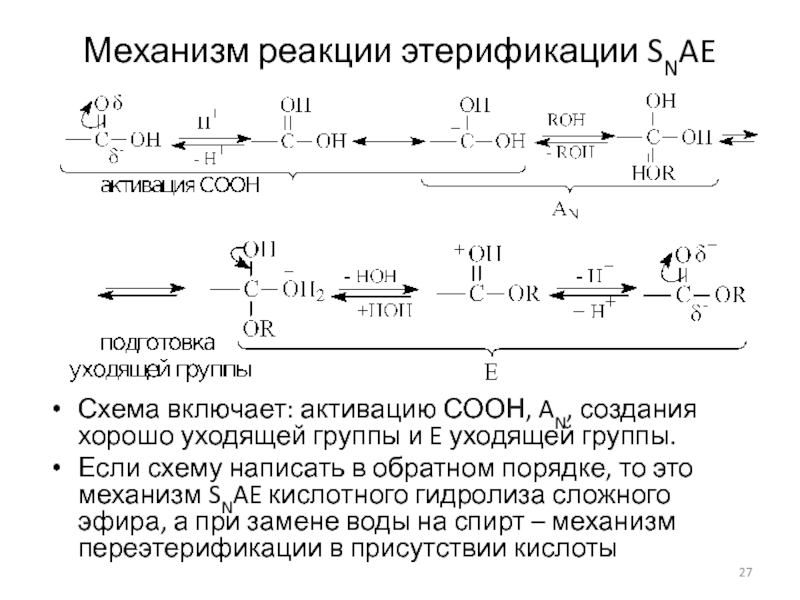
Слайд 27Механизм реакции этерификации SNAE
Схема включает: активацию СООН, AN, создания хорошо
уходящей группы и E уходящей группы.
Если схему написать в обратном
порядке, то это механизм SNAE кислотного гидролиза сложного эфира, а при замене воды на спирт – механизм переэтерификации в присутствии кислоты
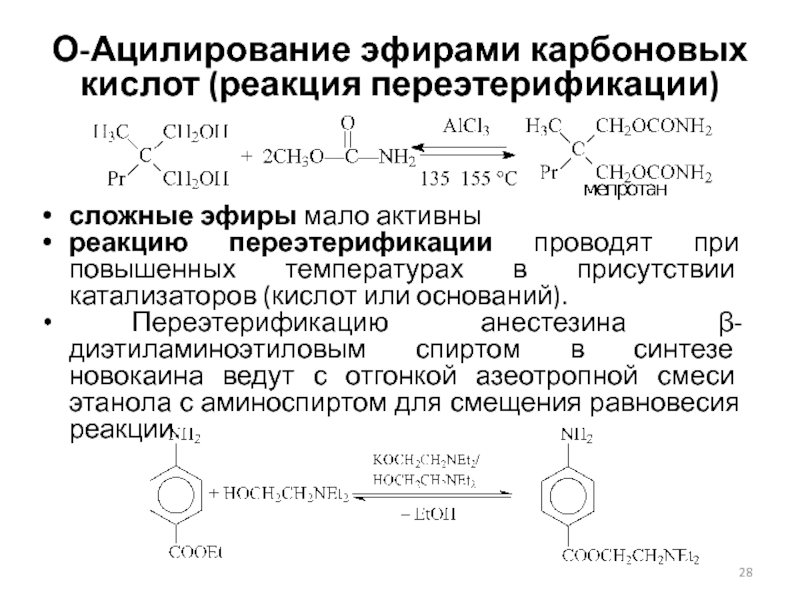
Слайд 28О-Ацилирование эфирами карбоновых кислот (реакция переэтерификации)
сложные эфиры мало активны
реакцию
переэтерификации проводят при повышенных температурах в присутствии катализаторов (кислот или
оснований).
Переэтерификацию анестезина β-диэтиламиноэтиловым спиртом в синтезе новокаина ведут с отгонкой азеотропной смеси этанола с аминоспиртом для смещения равновесия реакции.