Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы электролитов
Содержание
- 1. Растворы электролитов
- 2. Температуры кипения и замерзания растворов
- 3. Определение молярной массы вещества
- 4. ОсмосОсмос – самопроизвольный процесс перехода молекул растворителя
- 5. Осмотическое давлениеЗакон Вант-Гоффа:Осмотическое давление (π) равно силе,
- 6. Растворыгипотонический πраствора < πраствора клеткиизотонический πраствора =
- 7. Электролитывещества, расплавы и растворы которых проводят электрический ток
- 8. Электролитическая диссоциацияраспад электролитов на ионы при растворении
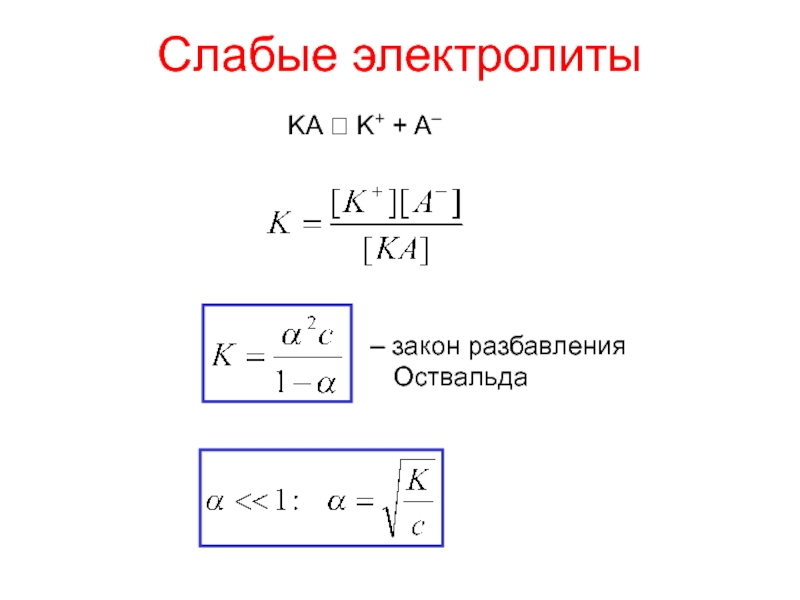
- 9. Слабые электролитыKA ⮀ K+ + A–– закон разбавления Оствальда
- 10. Слабые электролиты
- 11. Диссоциация кислотКислоты диссоциируют в воде на анион
- 12. Диссоциация основанийОснования диссоциируют на катион металла и
- 13. Протонная теория (Брёнстед, Лоури)Протолиз – процесс передачи
- 14. Амфолитывещества, способные быть и донорами и акцепторами
- 15. Автопротолиз водыH2O + H2O ⮀ H3O+ + OH–Kw = [H3O+][OH–] – ионное произведение воды
- 16. Реакция средыНейтральная среда: [H+] = [OH–] =
- 17. Расчет рН кислот и основанийЗадача 1. рН
- 18. Гидролизвзаимодействие веществ с водой, приводящее к изменению
- 19. Константы кислотности
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Осмос
Осмос – самопроизвольный процесс перехода молекул растворителя через полупроницаемую мембрану,
разделяющую растворы с разными концентрациями растворенного вещества
Слайд 5Осмотическое давление
Закон Вант-Гоффа:
Осмотическое давление (π) равно силе, приходящейся на единицу
поверхности мембраны, которую нужно приложить, чтобы предотвратить проникновение молекул растворителя
из раствора с меньшей концентрацией в раствор с большей концентрациейСлайд 6Растворы
гипотонический πраствора < πраствора клетки
изотонический πраствора = πраствора клетки
(физ. раствор:
0,9% NaCl)
гипертонический πраствора > πраствора клетки
Слайд 8Электролитическая диссоциация
распад электролитов на ионы при растворении в воде или
расплавлении
– степень диссоциации
сильные α > 30 %
HCl, HI, HBr, H2SO4,
HNO3, щелочи слабые α < 3 %
H2S, HCN, H2SiO3, гидроксиды d-металлов
средние 3 < α < 30 %
H3PO4, H2SO3, H2C2O4, HCOOH
Слайд 11Диссоциация кислот
Кислоты диссоциируют в воде на анион кислотного остатка и
катион водорода
H3PO4 ⮀ H+ + H2PO4– К1 = 7,11∙10–3
H2PO4– ⮀ H+ + HPO42– К2 = 6,34∙10–8
HPO42– ⮀ H+ + PO43– К3 = 4,4∙10–13
Слайд 12Диссоциация оснований
Основания диссоциируют на катион металла и гидроксид–ион
Fe(OH)3 ⮀ Fe(OH)2+
+ OH–
Fe(OH)2+ ⮀ Fe(OH)2+ + OH–
Fe(OH)2+ ⮀ Fe3+
+ OH– Слайд 13Протонная теория (Брёнстед, Лоури)
Протолиз – процесс передачи протона
Кислота (a)
– донор протонов
Основание (b) – акцептор протонов
HNO2 + H2O ⮀
H3O+ + NO2–к-та1 осн.1 к-та2 осн.2
a1 b1 a2 b2
NH3 + H2O ⮀ NH4+ + OH– осн.1 к-та1 к-та2 осн.2
b1 a1 a2 b2
Слайд 14Амфолиты
вещества, способные быть и донорами и акцепторами протонов
HSO3– +
H2O ⮀ SO32– + H3O+
HSO3– + H2O ⮀ H2SO3 +
OH–Слайд 16Реакция среды
Нейтральная среда: [H+] = [OH–] = 10-7 моль/л
Кислая среда:
[H+] > 10-7 моль/л; [OH–] < 10-7 моль/л
Щелочная среда: [H+]
< 10-7 моль/л; [OH–] > 10-7 моль/л рН = – lg[H+]
Кислая рН < 7
рН + рОН = 14
Щелочная рН > 7
Нейтральная рН = 7
Слайд 17Расчет рН кислот и оснований
Задача 1. рН раствора сильного электролита
Рассчитайте
рН раствора азотной кислоты концентрацией 0,001 М.
Задача 2. рН раствора
слабого электролитаВычислить рН 0,0025 М раствора аммиака.













![Растворы электролитов Автопротолиз водыH2O + H2O ⮀ H3O+ + OH–Kw = [H3O+][OH–] – ионное произведение воды Автопротолиз водыH2O + H2O ⮀ H3O+ + OH–Kw = [H3O+][OH–] – ионное произведение воды](/img/thumbs/0541d71a913192a91063d02cb0ad1dcd-800x.jpg)
![Растворы электролитов Реакция средыНейтральная среда: [H+] = [OH–] = 10-7 моль/лКислая среда: [H+] Реакция средыНейтральная среда: [H+] = [OH–] = 10-7 моль/лКислая среда: [H+] > 10-7 моль/л; [OH–] < 10-7](/img/thumbs/9636ad66ed2515b22543cef55a6ae26a-800x.jpg)






















