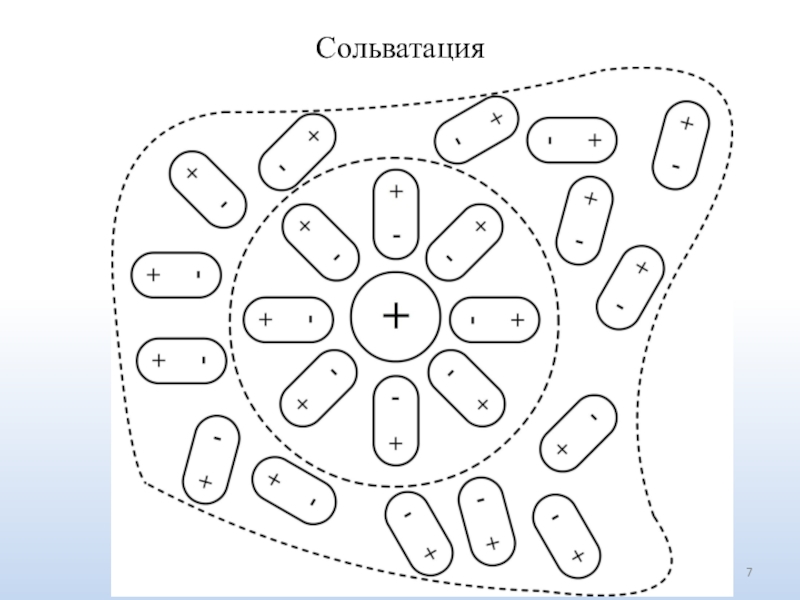
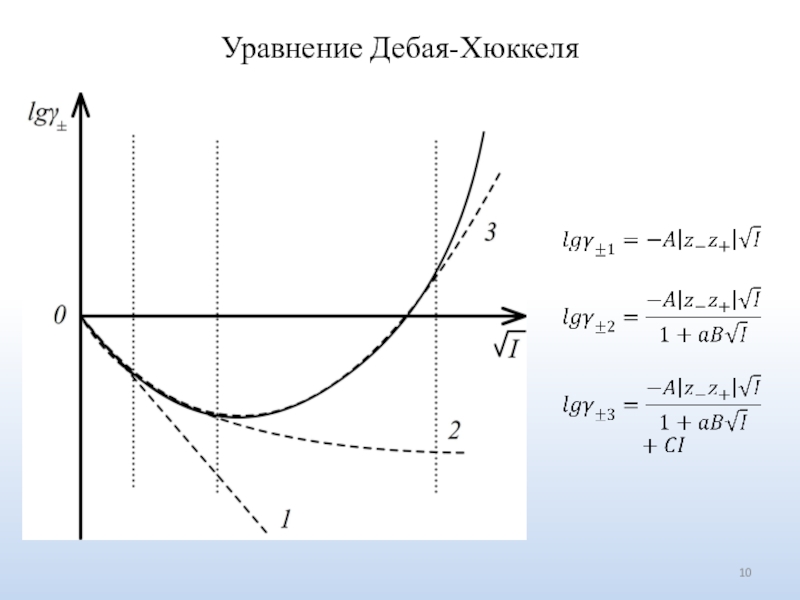
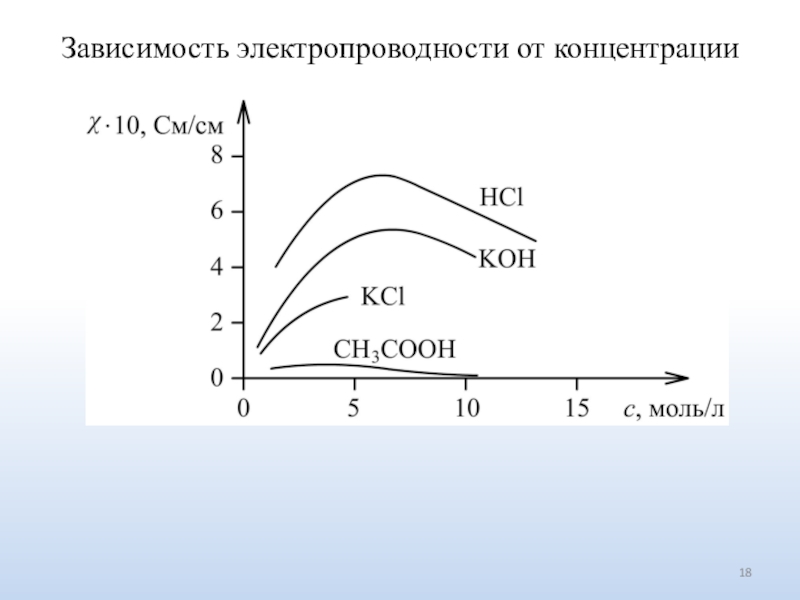
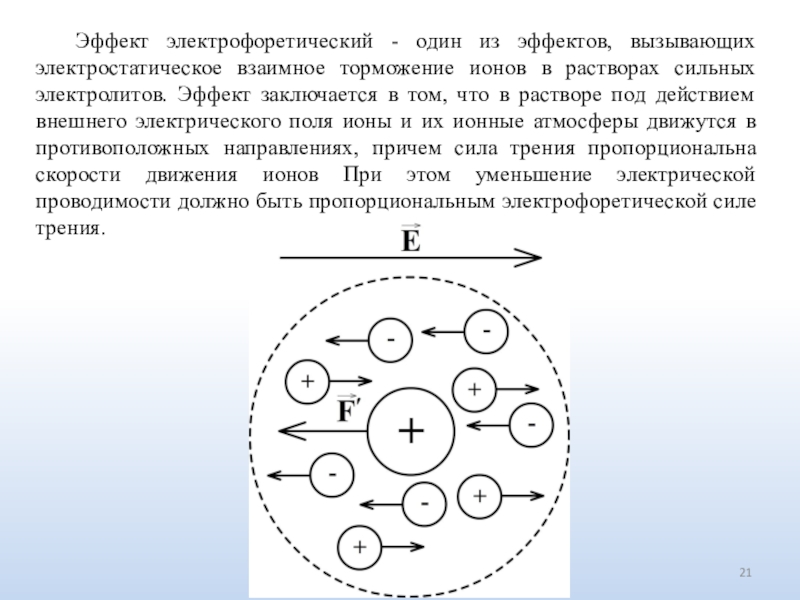
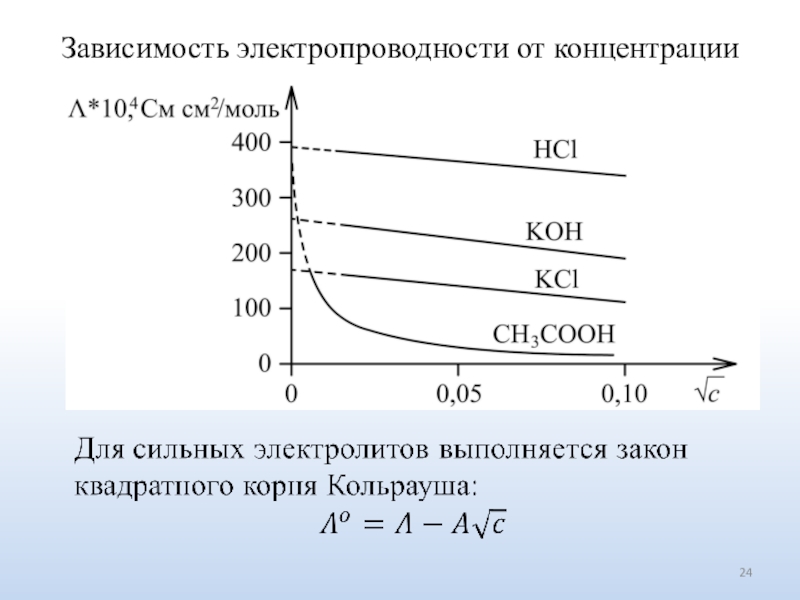
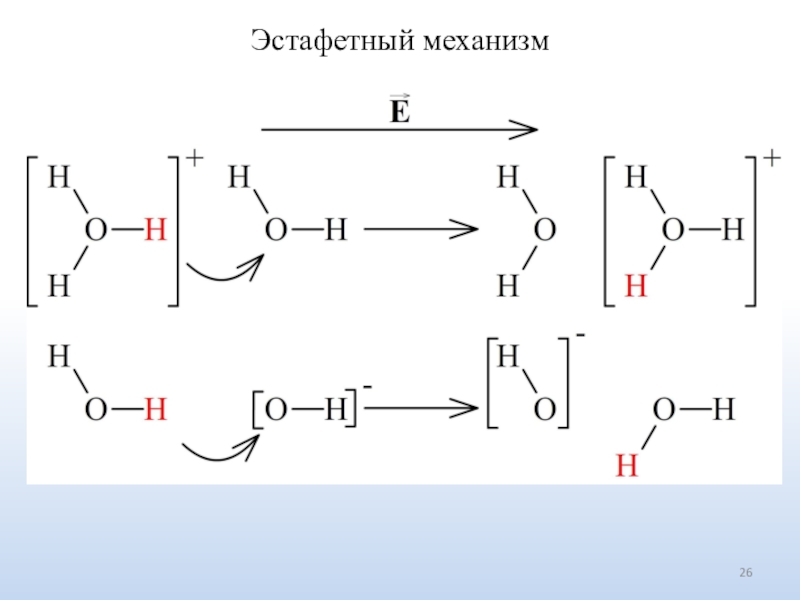
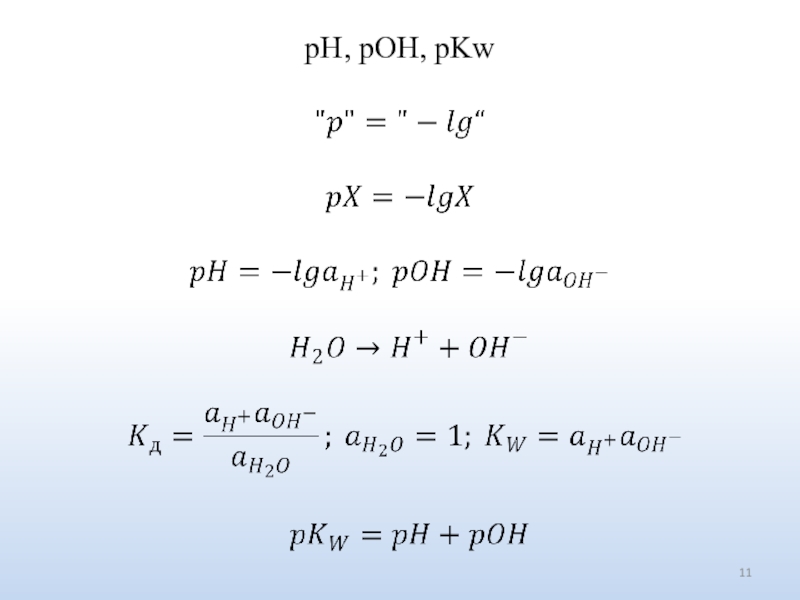Число ионов определяется природой электролита.
2. Диссоциация протекает не полностью.
3.
К процессу электролитической диссоциации применим закон действующих масс.Теория Аррениуса