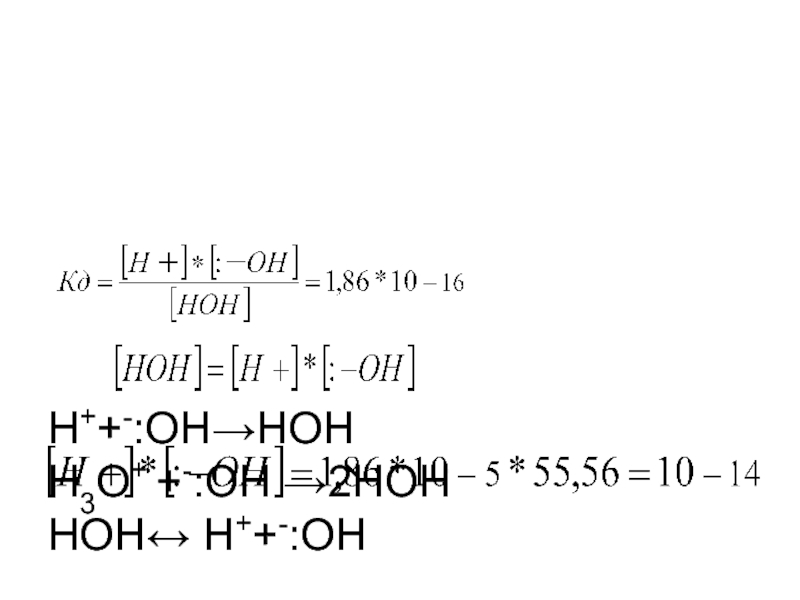Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакция нейтрализации
Содержание
- 1. Реакция нейтрализации
- 2. Слайд 2
- 3. КW=10-14-const(ионное
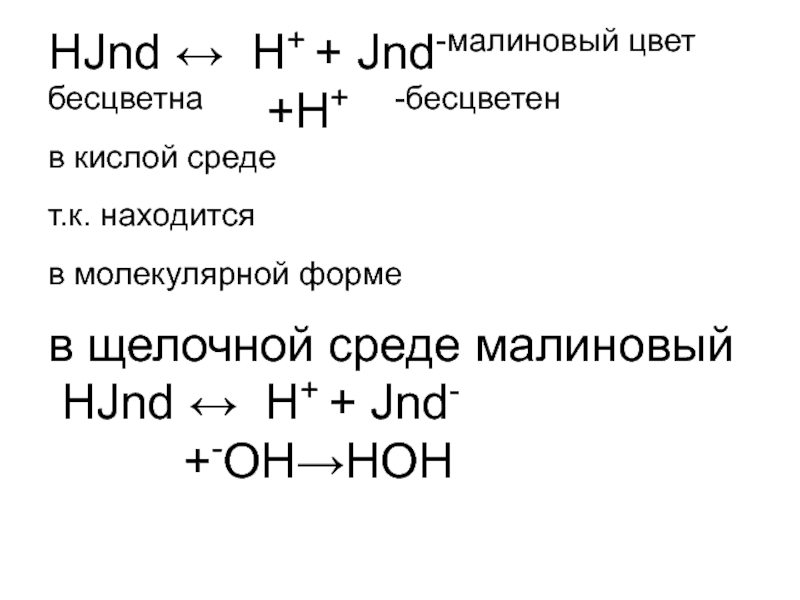
- 4. НJnd ↔ H+ + Jnd-малиновый цвет бесцветна
- 5. Т.к. находится в анионной форме. рТинд-ра =-lgKdинд-ра рТф-на = -lg10-9=9 рТметилоранжа= -lg5*10-4=4-0,7=3,3 Например:титруем уксусную кислоту NaOH.
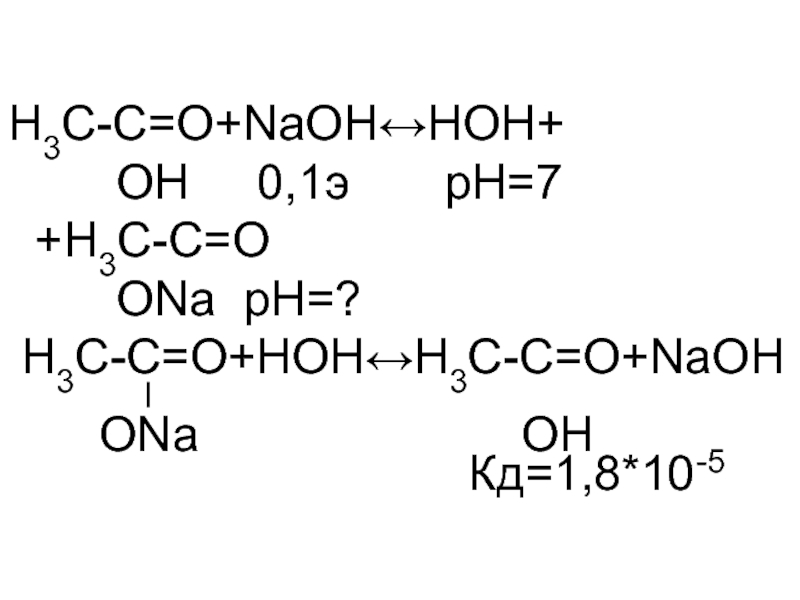
- 6. H3C-C=O+NaOH↔НОН+ OH
- 7. Согласно рН в точке эквивалентности 8,72 выбираем
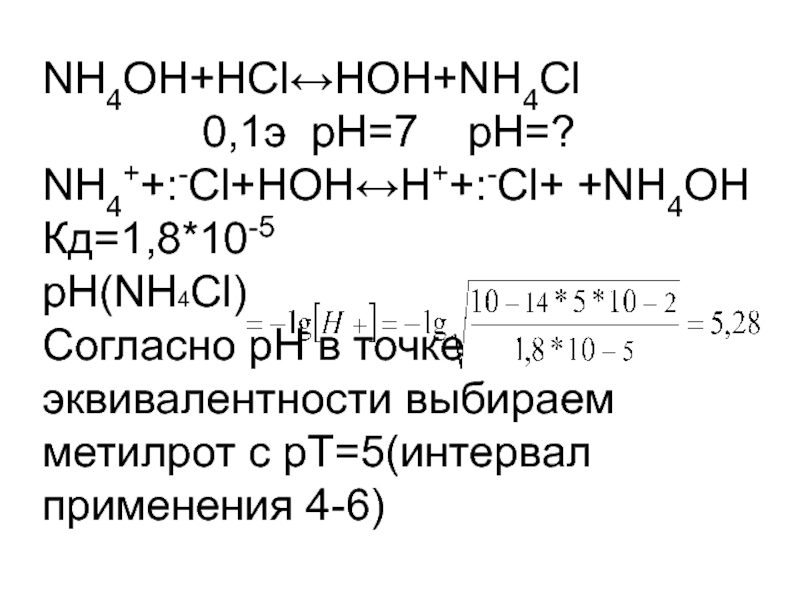
- 8. NH4OH+НCl↔НОН+NH4Cl
- 9. Скачать презентанцию
Н++-:ОН→НОН Н3О+ +-:ОН →2НОН НОН↔ Н++-:ОН Кд