Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
РЕГУЛЯЦИЯ МЕТАБОЛТИЗМА МИКРООРГАНИЗМОВ НА УРОВНЕ ИЗМЕНЕНИЯ АКТИВНОСТИ
Содержание
- 1. РЕГУЛЯЦИЯ МЕТАБОЛТИЗМА МИКРООРГАНИЗМОВ НА УРОВНЕ ИЗМЕНЕНИЯ АКТИВНОСТИ
- 2. ПЛАН
- 3. ФАКТОРЫ, РЕГУЛИРУЮЩИЕ АКТИВНОСТЬ ФЕРМЕНТОВ
- 4. СТРОЕНИЕ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ1. Апофермент – тело фермента
- 5. АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯВзаимодействие аллостерического фермента с субстратом и
- 6. КИНЕТИКА АЛЛОСТЕРИЧЕКИХ ФЕРМЕНТОВЗависимость активности аспартат-транскарбамилазы от концентрации
- 7. ДЕЙСТВИЕ АКТИВАТОРОВ И ИНГИБИТОРОВСвязывание субстрата с ферментом
- 8. Модель согласованной симметрии (равновесная модель), Моно и
- 9. Примером такого типа регулирования является ингибирование биосинтеза
- 10. АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯРегуляция разветвленных путей биосинтезаВыработалось несколько механизмов
- 11. Регуляция разветвленных путей биосинтеза – ингибирование по
- 12. Регуляция разветвленных путей биосинтеза – ингибирование по
- 13. КОНКУРЕНТНОЕ И НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕПо характеру действия ингибиторы
- 14. Конкурентный ингибитор конкурирует с субстратом за связывание
- 15. Неконкурентное ингибирование не может быть ослаблено или
- 16. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ МОЛЕКУЛУ бактерий обнаружены две системы
- 17. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ МОЛЕКУЛРегуляция активности глутаминсинтетазы E. coli
- 18. Присоединение остатка уксусной кислоты (ацетилирование) приводит к
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1РЕГУЛЯЦИЯ МЕТАБОЛТИЗМА МИКРООРГАНИЗМОВ НА УРОВНЕ ИЗМЕНЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
ТЕМА № 4
Лекция
для студентов специальности 020209.65 Микробиология
Слайд 2 ПЛАН ЛЕКЦИИ:
Факторы, регулирующие активность
ферментов.
Химическая модификация.
Аллостерическая регуляция.
Ингибирование по типу обратной связи.
Конкурентное ингибирование.
Неконкурентное ингибирование.
Слайд 3ФАКТОРЫ, РЕГУЛИРУЮЩИЕ АКТИВНОСТЬ ФЕРМЕНТОВ
Факторы, регулирующие активность
ферментов, разнообразны по своей природе:
1. Физические факторы (температура, давление, свет,
магнитное поле, электрические импульсы) оказывают менее специфическое действие, чем химические.2. В свою очередь действие химических факторов также может быть разделено на несколько типов.
А) Одни химические вещества связываются с активным центром фермента, например, субстраты, кофакторы, конкурентные ингибиторы, что приводит к изменению ферментативной активности.
Б) Другие вещества взаимодействуют со специальными участками на поверхности молекулы определенного типа фермента, не имеющими непосредственного отношения к центрам каталитической активности, но тем не менее приводящими к ее изменению.
В) Присоединение и отщепление остатка какого-либо вещества к/от фермента приводит к изменению ферментативной активности.
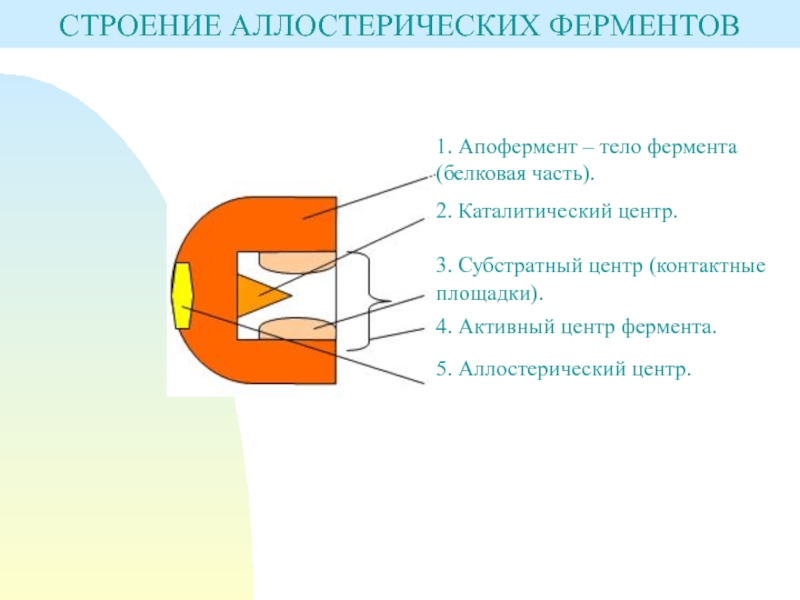
Слайд 4СТРОЕНИЕ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ
1. Апофермент – тело фермента (белковая часть).
2. Каталитический
центр.
3. Субстратный центр (контактные площадки).
4. Активный центр фермента.
5. Аллостерический центр.
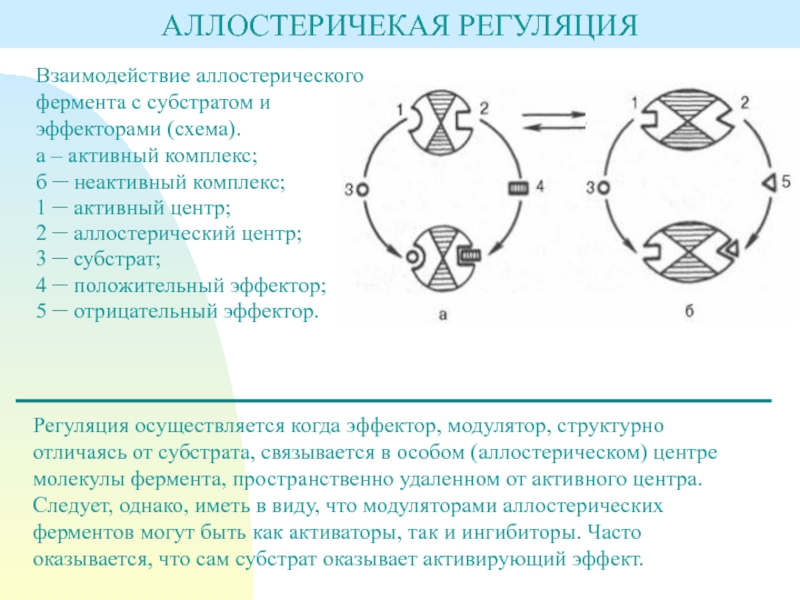
Слайд 5АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
Взаимодействие аллостерического фермента с субстратом и эффекторами (схема).
а –
активный комплекс;
б – неактивный комплекс;
1 – активный центр;
2 – аллостерический центр;
3 – субстрат;
4 – положительный эффектор;
5 – отрицательный эффектор.
Регуляция осуществляется когда эффектор, модулятор, структурно отличаясь от субстрата, связывается в особом (аллостерическом) центре молекулы фермента, пространственно удаленном от активного центра. Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект.
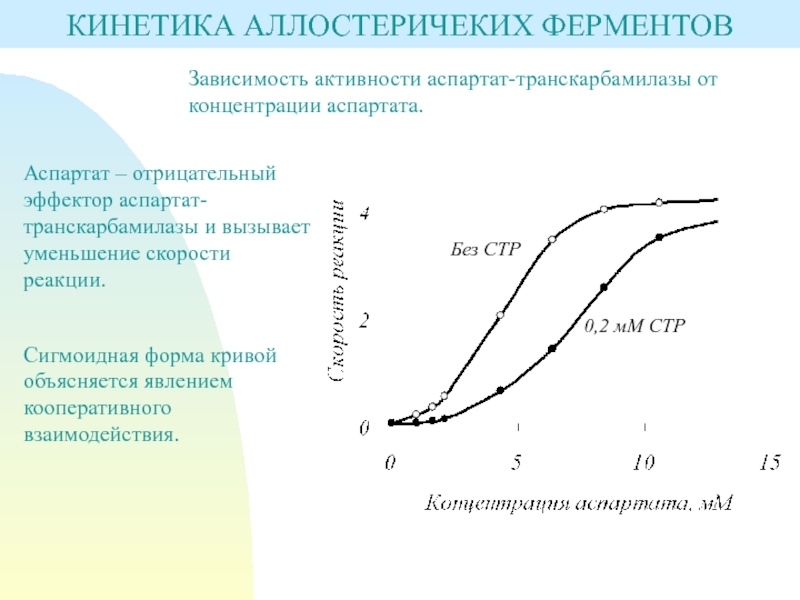
Слайд 6КИНЕТИКА АЛЛОСТЕРИЧЕКИХ ФЕРМЕНТОВ
Зависимость активности аспартат-транскарбамилазы от концентрации аспартата.
Аспартат – отрицательный
эффектор аспартат-транскарбамилазы и вызывает уменьшение скорости реакции.
Сигмоидная форма кривой объясняется
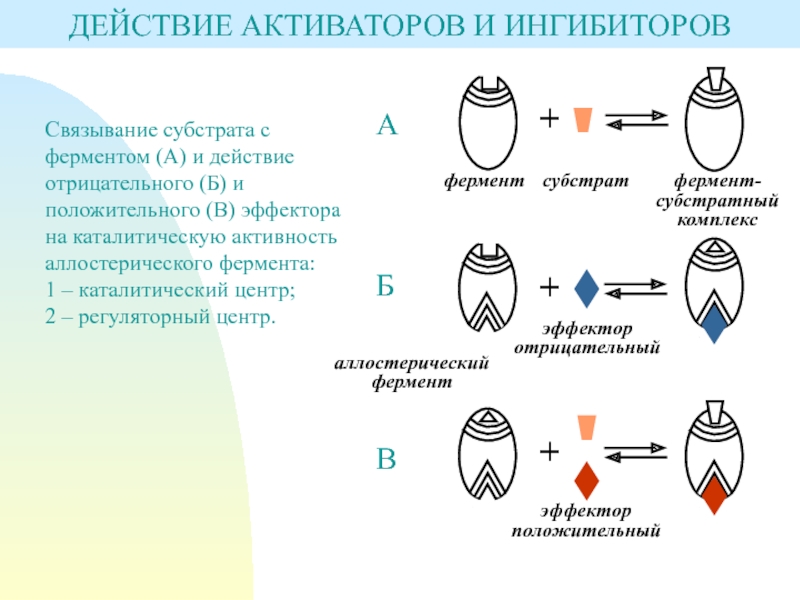
явлением кооперативного взаимодействия.Слайд 7ДЕЙСТВИЕ АКТИВАТОРОВ И ИНГИБИТОРОВ
Связывание субстрата с ферментом (А) и действие
отрицательного (Б) и положительного (В) эффектора
на каталитическую активность аллостерического фермента:
1
– каталитический центр;2 – регуляторный центр.
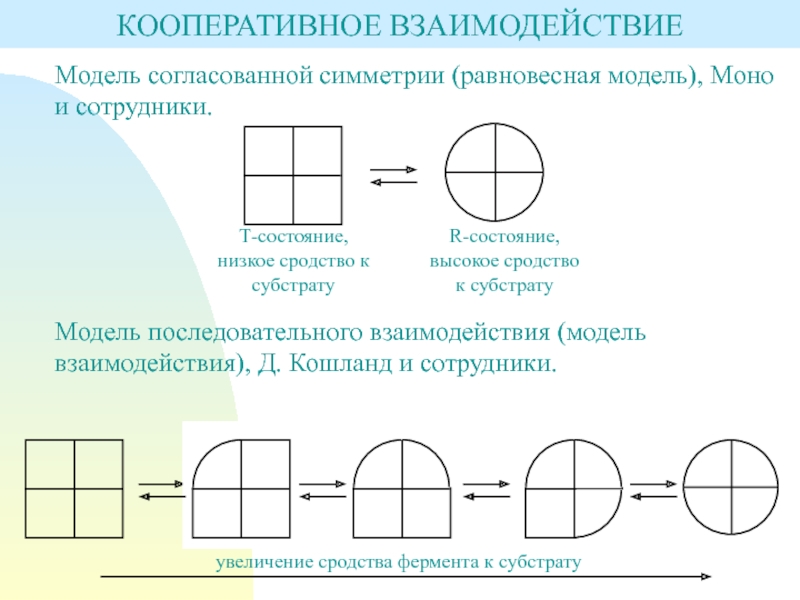
Слайд 8Модель согласованной симметрии (равновесная модель), Моно и сотрудники.
Модель последовательного взаимодействия
(модель взаимодействия), Д. Кошланд и сотрудники.
КООПЕРАТИВНОЕ ВЗАИМОДЕЙСТВИЕ
Т-состояние, низкое сродство
к субстратуR-состояние, высокое сродство к субстрату
Слайд 9Примером такого типа регулирования является ингибирование биосинтеза L-изолейцина. Предположим, что
в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется
собственным ферментом.Изолейцин, являющийся конечным продуктом синтеза, избирательно подавляет активность треониндегидратазы, катализирующей первую стадию последовательного процесса превращения треонина в изолейцин, насчитывающего пять ферментативных реакций:
Наиболее простой случай аллостерической регуляции – регуляция первого фермента неразветвленного биосинтетического пути его конечным продуктом. Если конечный продукт накапливается в избытке, он подавляет активность первого фермента в процессе, называемом ингибированием по принципу обратной связи:
АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
(ингибирование по типу обратной связи)
Слайд 10АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
Регуляция разветвленных путей биосинтеза
Выработалось несколько механизмов контроля по принципу
обратной связи применительно к разветвленным биосинтетическим путям. Они сводятся к
тому, что в этом случае в регулировании принимают участие все конечные продукты этих путей.I – регуляция первого фермента несколькими конечными продуктами;
II – регуляция конечными продуктами изоферментов.
Стрелками обозначены ферменты; параллельными стрелками – изоферменты; жирными стрелками – ингибирование конечными продуктами первого фермента или изоферментов;
А — исходный субстрат;
Б — промежуточный метаболит;
В, Г, Д — конечные продукты.
АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
(ингибирование по типу обратной связи)
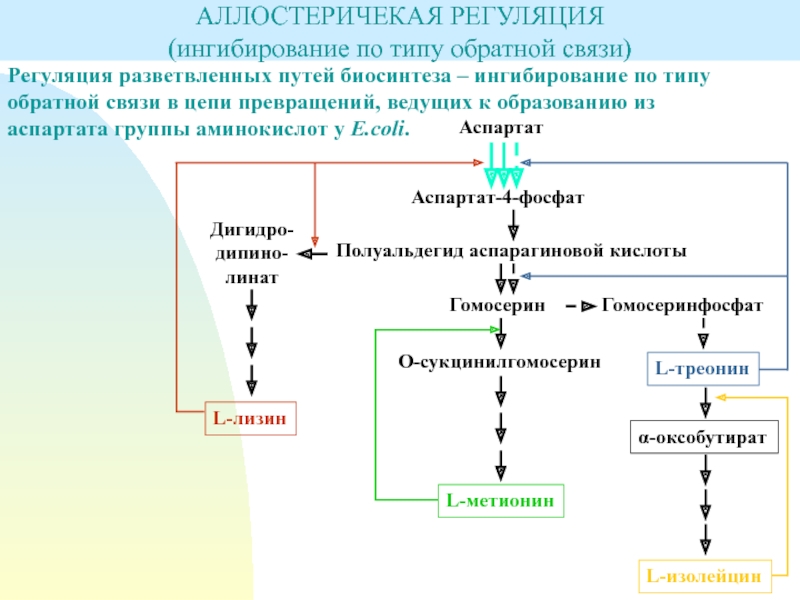
Слайд 11Регуляция разветвленных путей биосинтеза – ингибирование по типу обратной связи
в цепи превращений, ведущих к образованию из аспартата группы аминокислот
у E.coli.АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
(ингибирование по типу обратной связи)
Слайд 12Регуляция разветвленных путей биосинтеза – ингибирование по типу обратной связи
в цепи превращений ароматических аминокислот у E.coli.
АЛЛОСТЕРИЧЕКАЯ РЕГУЛЯЦИЯ
(ингибирование по типу
обратной связи)Слайд 13КОНКУРЕНТНОЕ И НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
По характеру действия ингибиторы могут быть обратимыми
и необратимыми. В основе этого деления лежит прочность соединения ингибитора
с ферментом.Обратимые ингибиторы делятся на группы, основываясь на характере места их связывания. Одни из них связываются с удаленным от активного центра месте (аллостерическая регуляция), а другие – с ферментом в активном центре.
Необратимое ингибирование связано со связыванием и блокированием функциональной группы молекулы фермента, необходимой для проявления его активности.
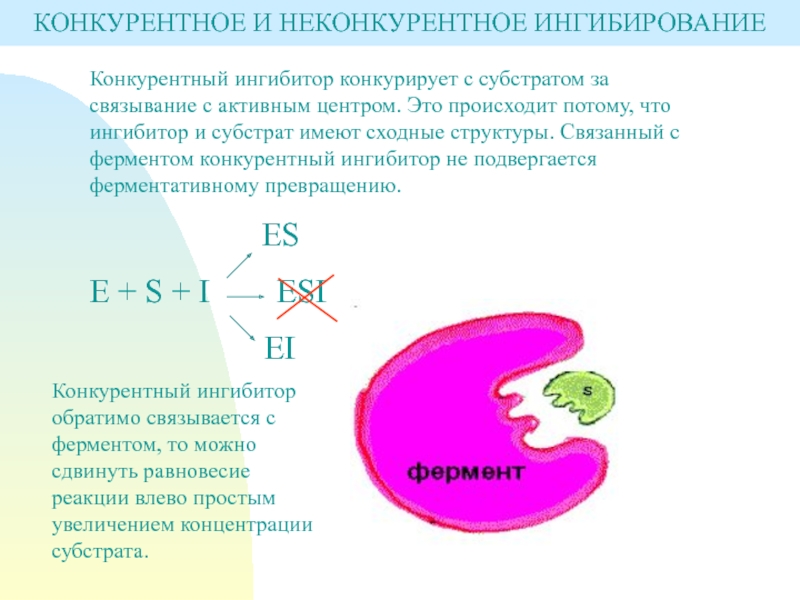
Слайд 14Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром.
Это происходит потому, что ингибитор и субстрат имеют сходные структуры.
Связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению.ES
E + S + I ESI
EI
Конкурентный ингибитор обратимо связывается с ферментом, то можно сдвинуть равновесие реакции влево простым увеличением концентрации субстрата.
КОНКУРЕНТНОЕ И НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Слайд 15Неконкурентное ингибирование не может быть ослаблено или устранено повышением концентрации
субстрата, так как эти ингибиторы присоединяются к ферменту не в
активном центре, а в регуляторном. Связывание приводит к изменению конформации фермента и нарушению комплементарности к субстрату.Неконкурентные ингибиторы могут обратимо связываться как со свободным ферментом, так и с комплексом ES.
КОНКУРЕНТНОЕ И НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Слайд 16ХИМИЧЕСКАЯ МОДИФИКАЦИЯ МОЛЕКУЛ
У бактерий обнаружены две системы ковалентной модификации ферментов:
1.
Присоединение/отщепление остатка адениловой кислоты (аденилирование/деаденилирование) приводит к изменению активности глутаминсинтетазы
Escherichia coli.2. Присоединение/отщепление остатка уксусной кислоты (ацетилирование/деацетилирование) приводит к изменению активности цитратлиазы у фотосинтетической бактерии Rhodopseudomonas gelatinosa.
Е–Х (активный) ↔ Е (неактивный) + Х
Е + Х (активный) ↔ Е–Х (неактивный)
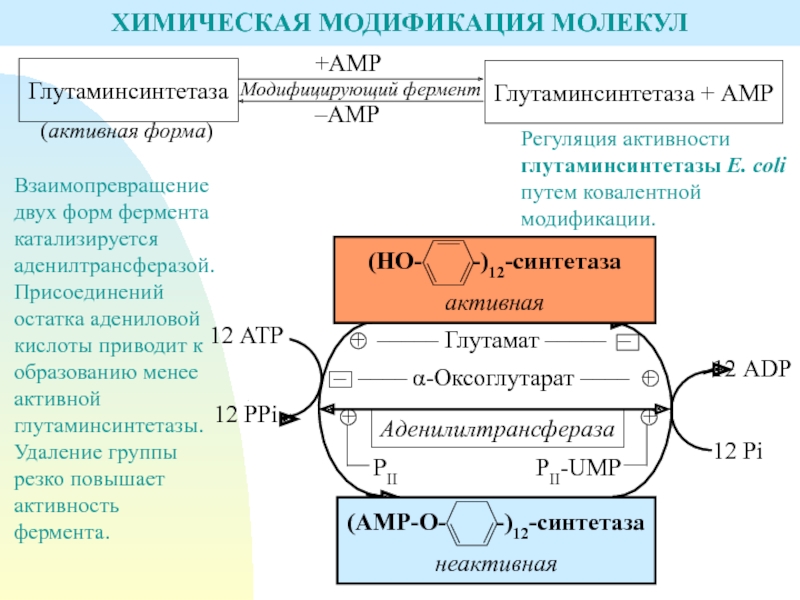
Слайд 17ХИМИЧЕСКАЯ МОДИФИКАЦИЯ МОЛЕКУЛ
Регуляция активности глутаминсинтетазы E. coli путем ковалентной модификации.
Взаимопревращение
двух форм фермента катализируется аденилтрансферазой.
Присоединений остатка адениловой кислоты приводит к
образованию менее активной глутаминсинтетазы. Удаление группы резко повышает активность фермента.Слайд 18Присоединение остатка уксусной кислоты (ацетилирование) приводит к повышению активности цитратлиазы
у фотосинтетической бактерии Rhodopseudomonas gelatinosa, а ее отщепление (деацетилирование) приводит
к потере активности.ХИМИЧЕСКАЯ МОДИФИКАЦИЯ МОЛЕКУЛ