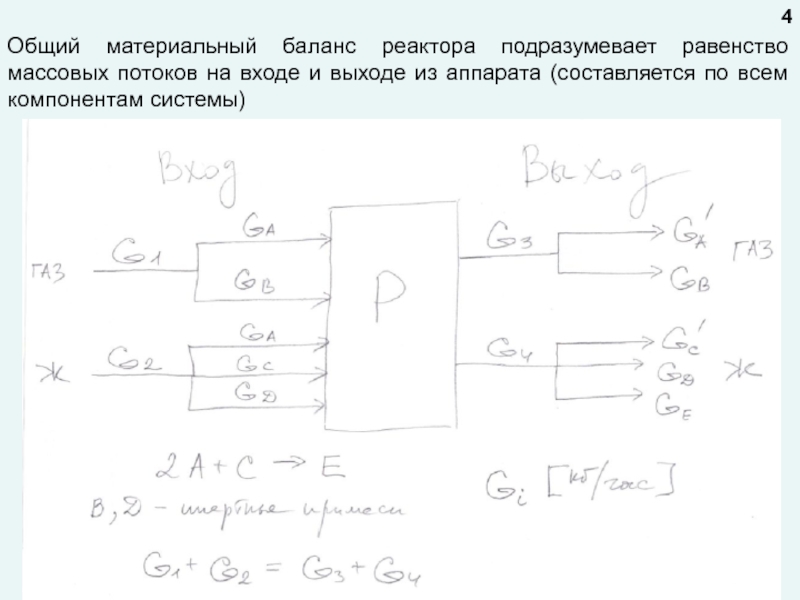
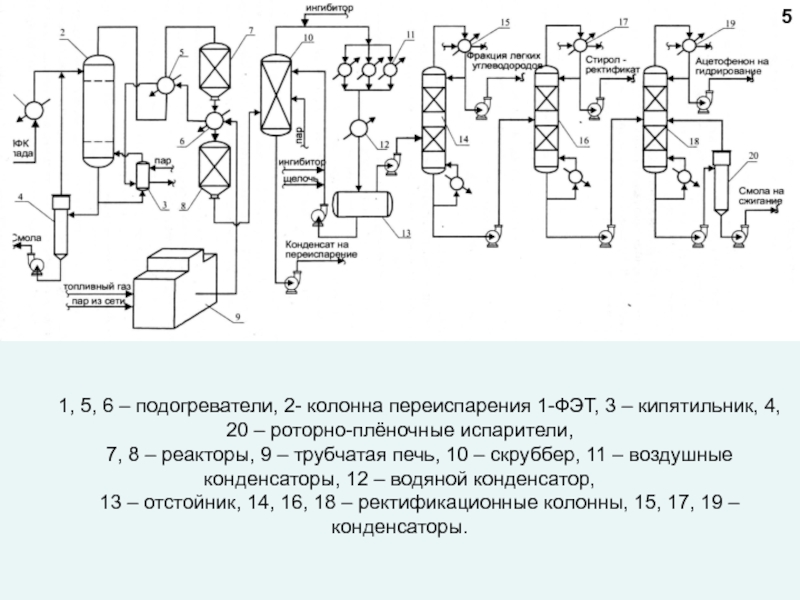
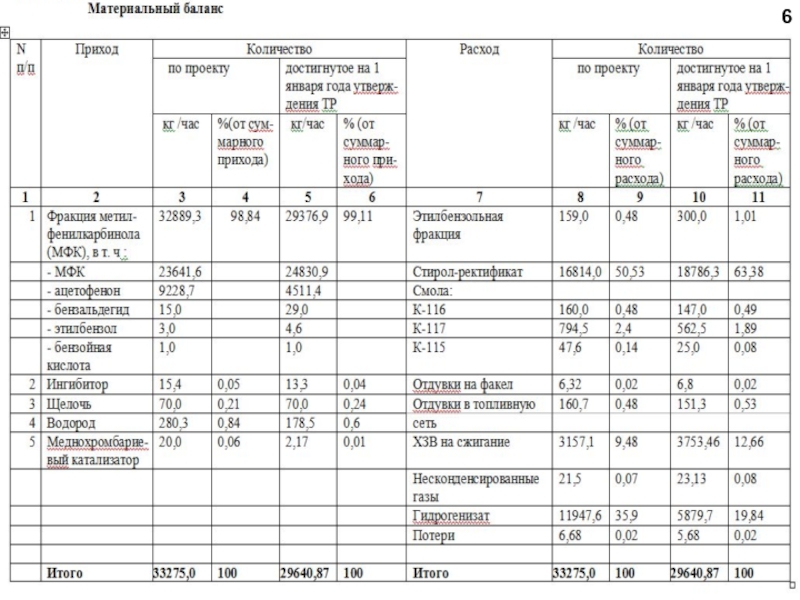
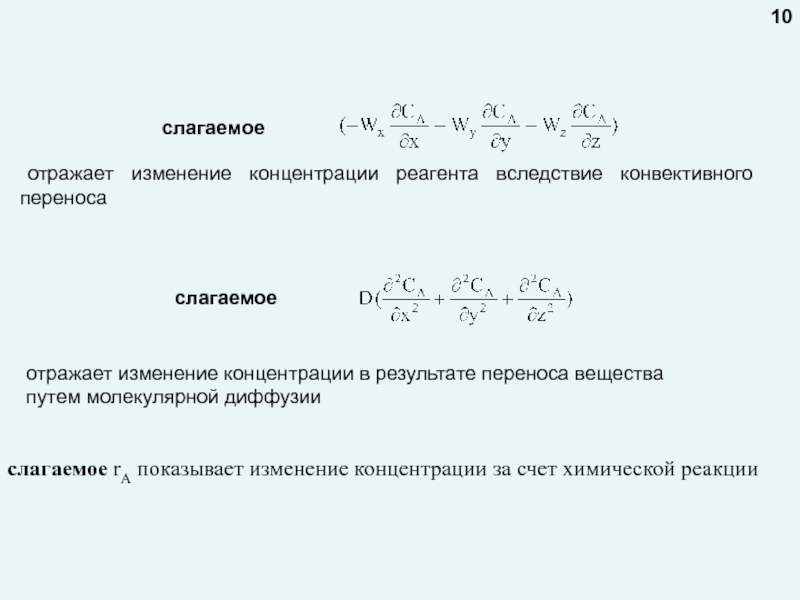
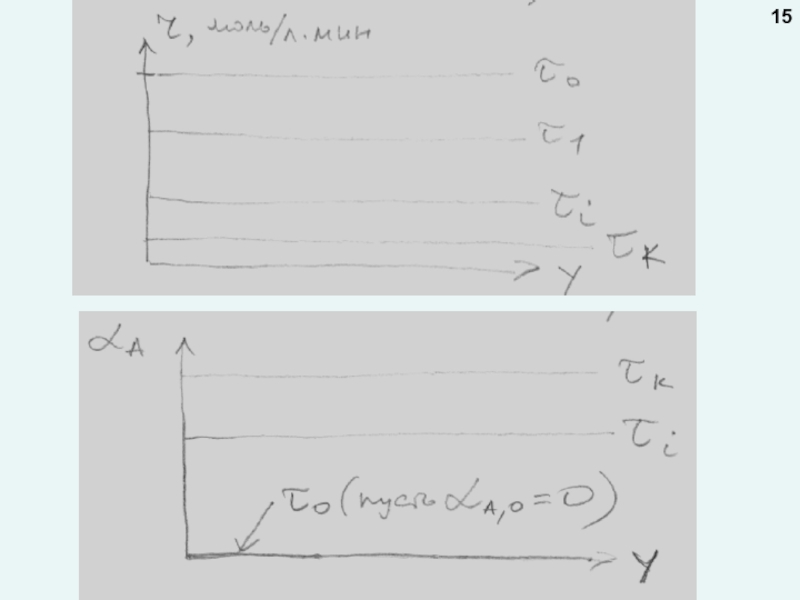
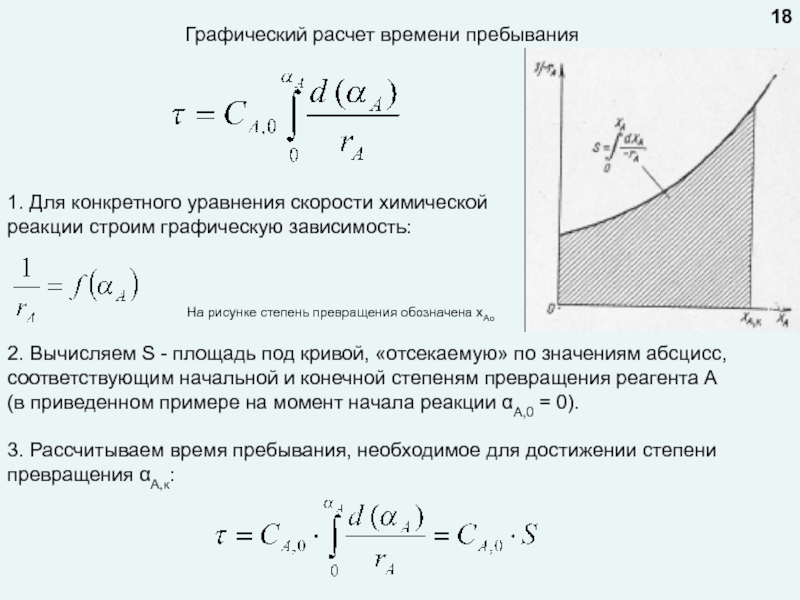
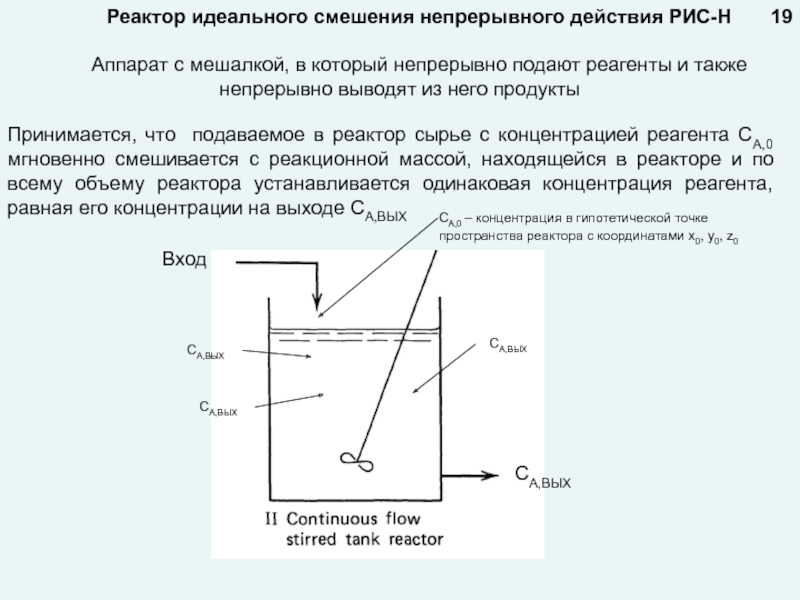
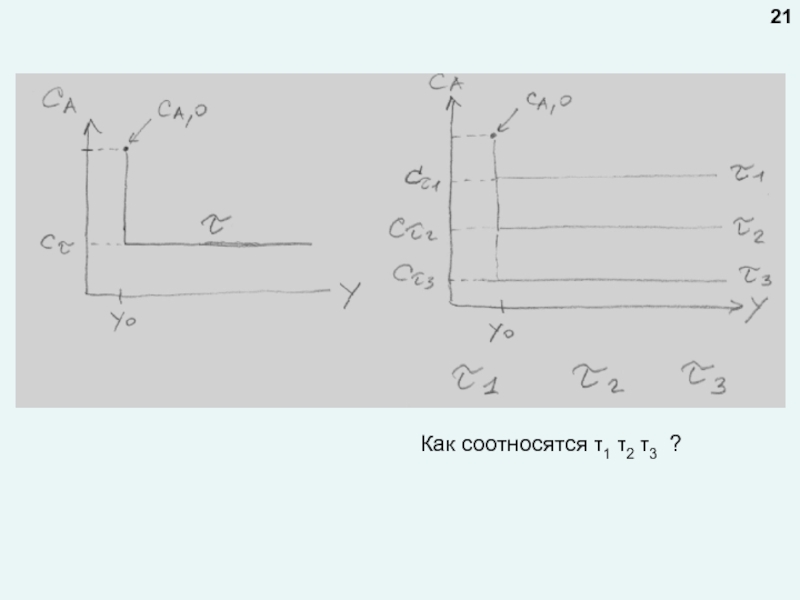
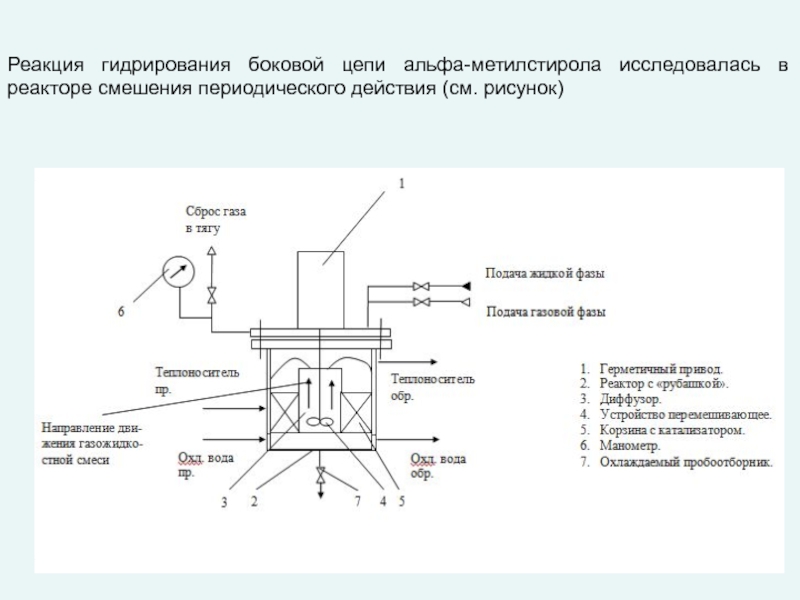
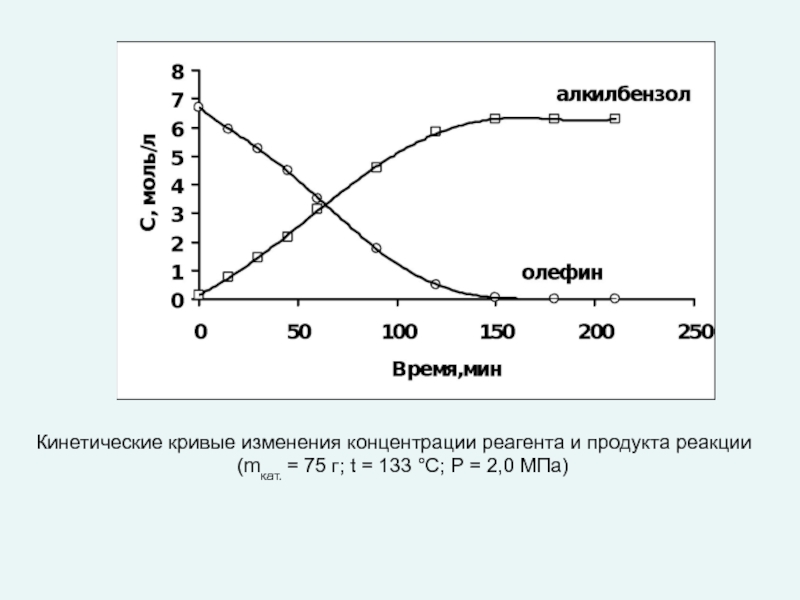
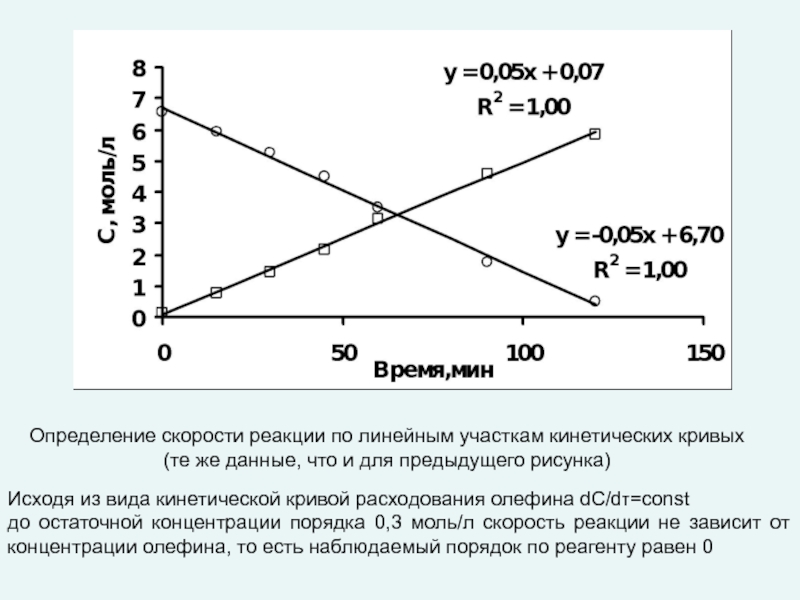
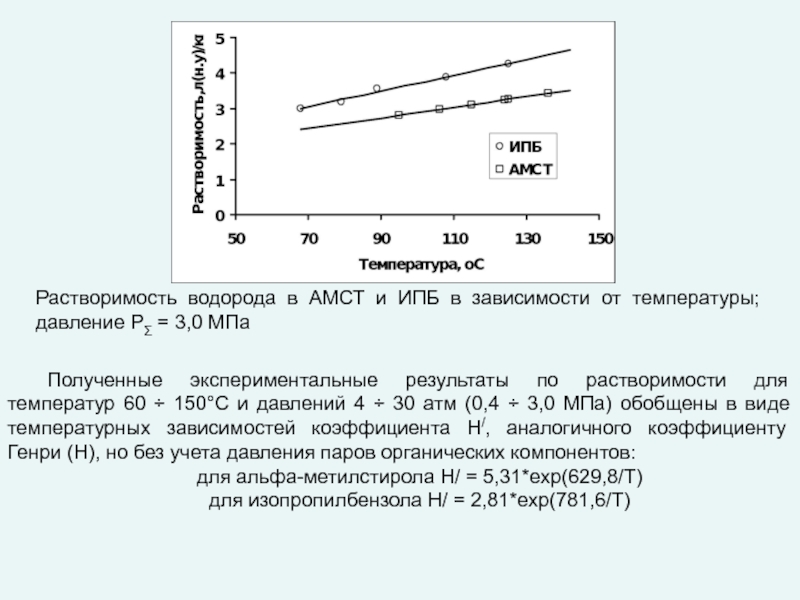
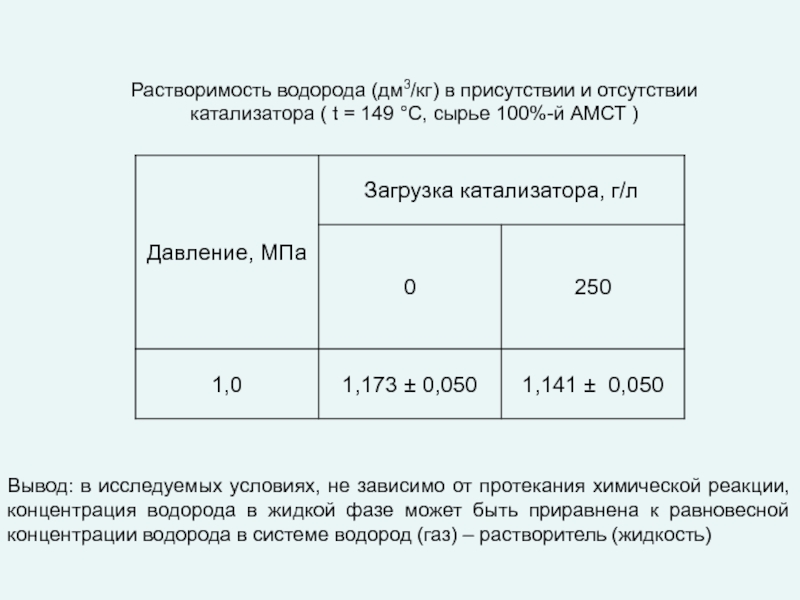
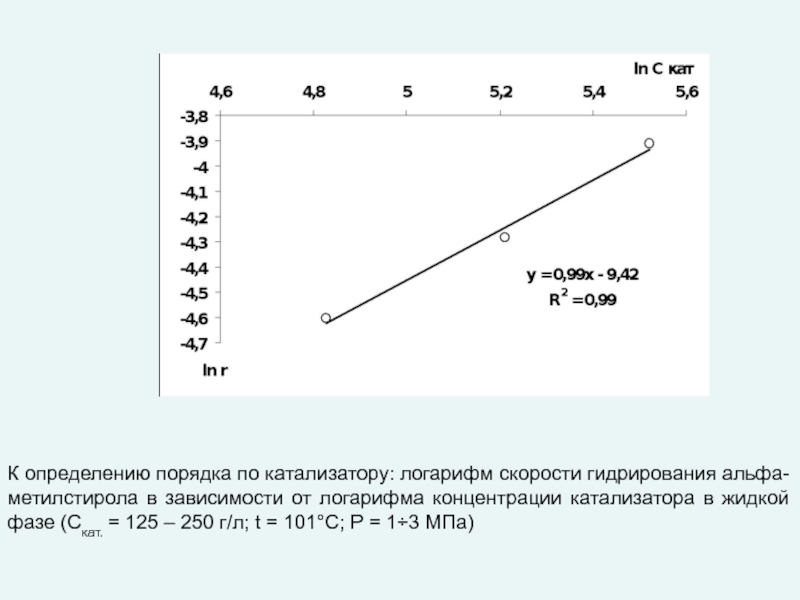
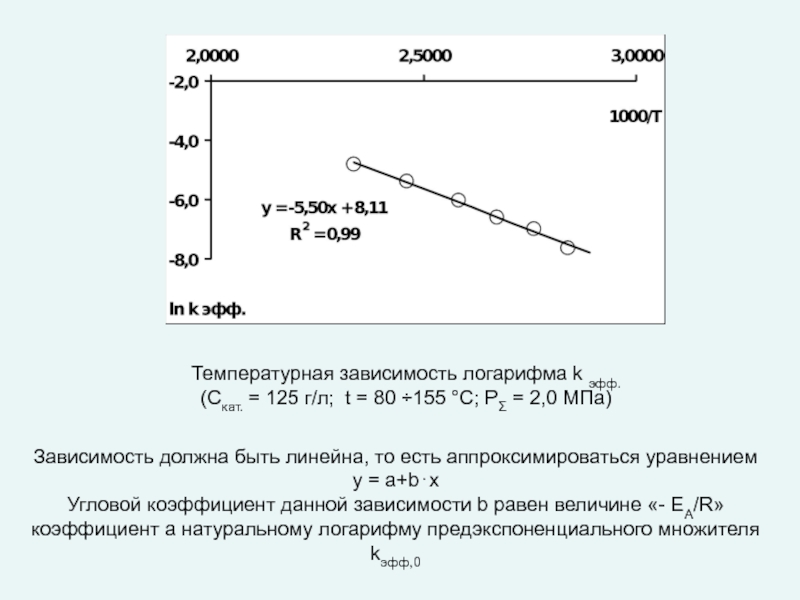
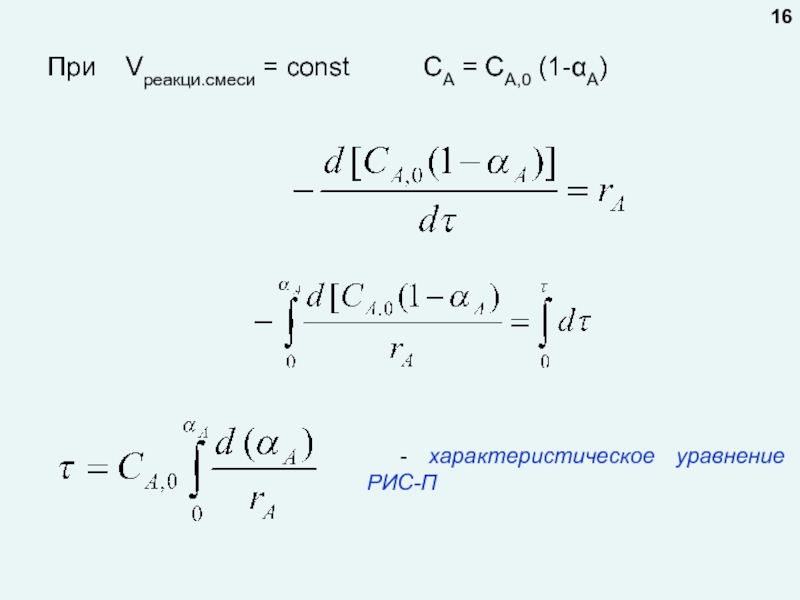любой точке реактора во времени не происходит изменения концентрации и
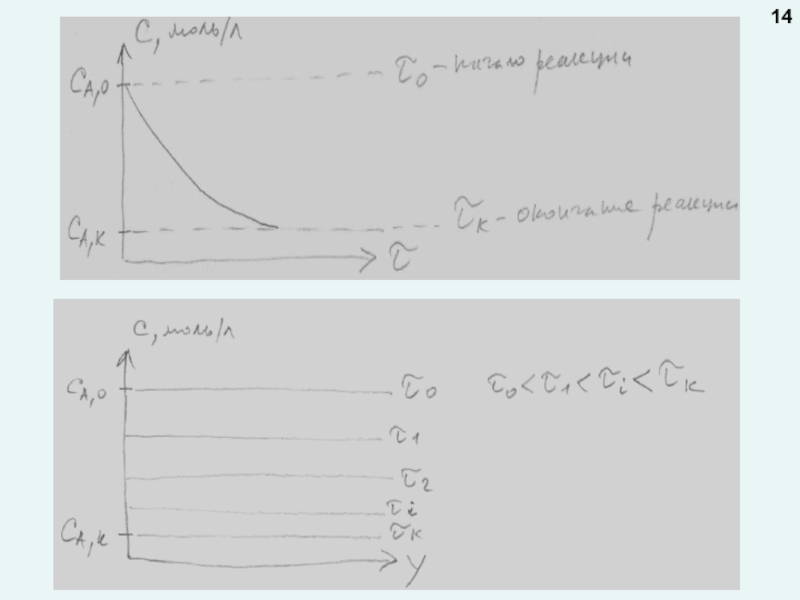
температурыПри нестационарном режиме концентрация и температура в любой точке реактора меняются во времени:
Стационарный режим реализуется в реакторах непрерывного действия.
Нестационарный в периодических реакторах, и в непрерывных реакторах во время пуска или остановки реактора.
1