Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕРМОДИНАМИКА РАБОТА И ТЕПЛОПЕРЕДАЧА Рассмотрим газ, находящийся в
Содержание
- 1. ТЕРМОДИНАМИКА РАБОТА И ТЕПЛОПЕРЕДАЧА Рассмотрим газ, находящийся в
- 2. Если газ, расширяясь, передвигает поршень на расстояние
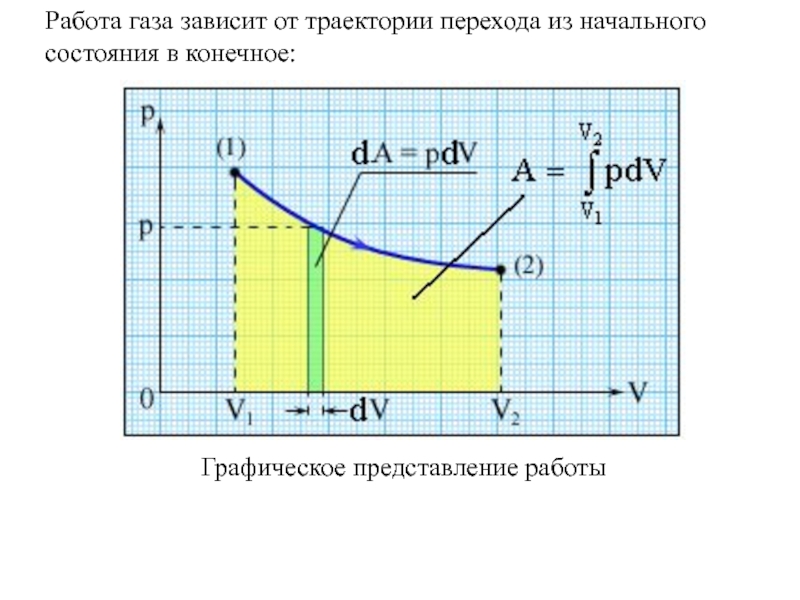
- 3. Графическое представление работыРабота газа зависит от траектории перехода из начального состояния в конечное:
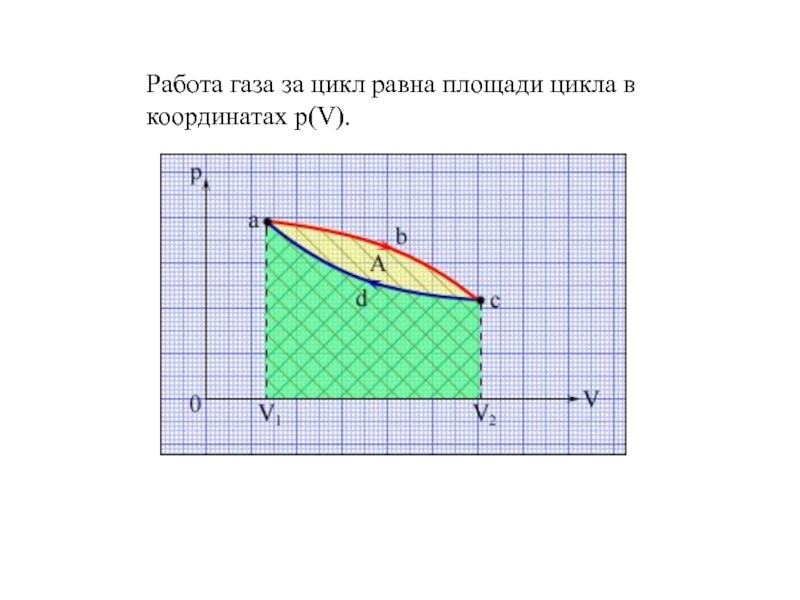
- 4. Работа газа за цикл равна площади цикла в координатах p(V).
- 5. Теплопередача - процесс обмена энергией между системой
- 6. Выражение для средней энергии молекул E =
- 7. Число степеней свободы материального объекта - это
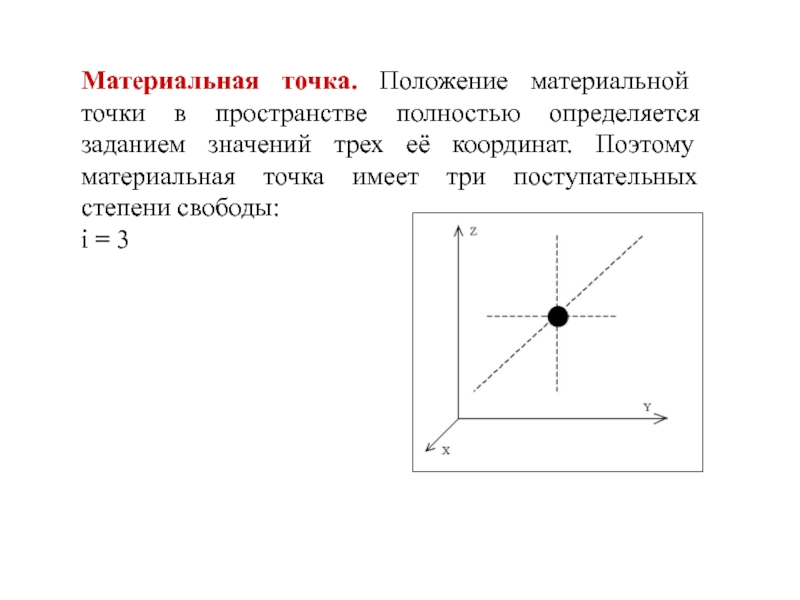
- 8. Материальная точка. Положение материальной точки в пространстве
- 9. Две материальные точки с жесткой связью. Такая
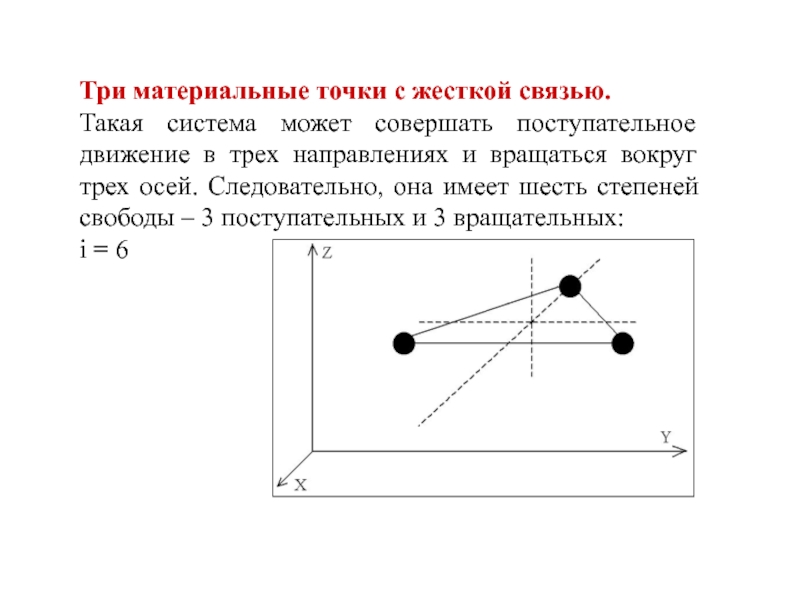
- 10. Три материальные точки с жесткой связью. Такая
- 11. Две материальные точки с упругой связью.
- 12. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ
- 13. На колебательную степень свободы приходится удвоенная энергия,
- 14. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА.Энергия, связанная с внутренними
- 15. Определим внутреннюю энергию идеального газа:Внутренняя энергия - функция температуры.
- 16. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИI начало термодинамики говорит о
- 17. I начало термодинамики в дифференциальной форме:
- 18. Изобарический процесс: Q = dU +
- 19. Изохорический процесс: Q = dU
- 20. Изотермический процесс: Q = A
- 21. ТЕПЛОЕМКОСТЬ
- 22. Удельной теплоемкостью вещества называется физическая величина, численно
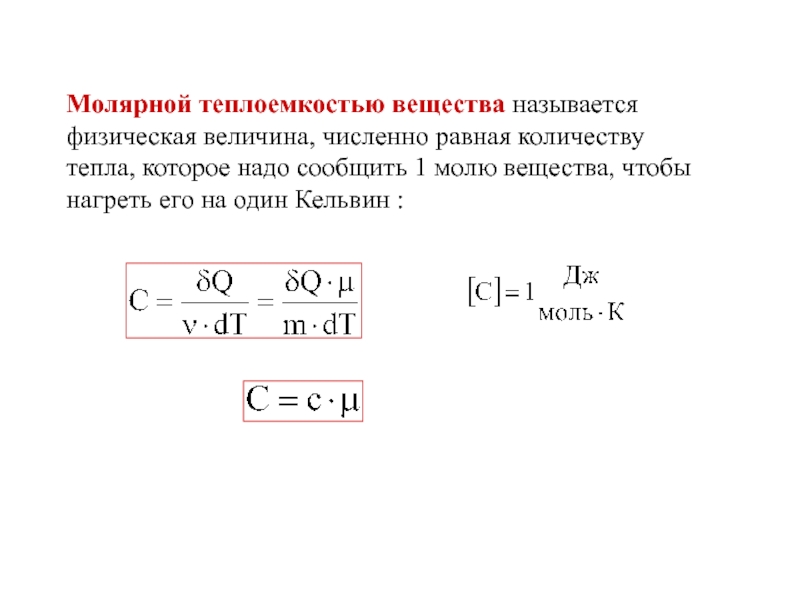
- 23. Молярной теплоемкостью вещества называется физическая величина, численно
- 24. Различают теплоемкость для случаев, когда нагревание
- 25. Тогда молярная теплоемкость при постоянном объеме равна:
- 26. Теплоемкость при постоянном давлении. Если нагревание газа
- 27. Определим соотношение между теплоемкостями при постоянном давлении и объеме:
- 28. для одноатомного газа для двухатомного газа
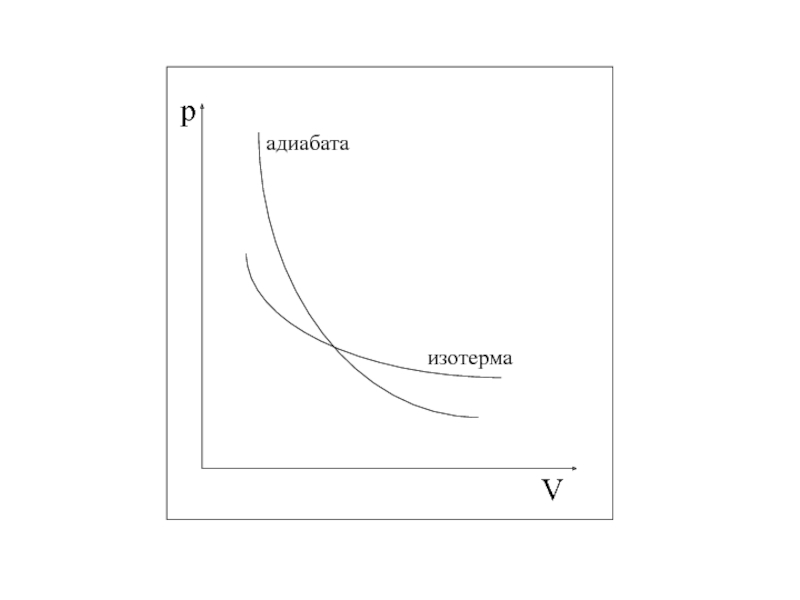
- 29. АДИАБАТИЧЕСКИЙ ПРОЦЕСС
- 30. показатель адиабаты или коэффициент Пуассона: Из уравнения можно получить:
- 31. Уравнение Пуассона(или уравнение адиабатного процесса)Уравнение, связывающее параметры идеального газа при адиабатном процессе.
- 32. Слайд 32
- 33. Определим работу газа в ходе адиабатного процесса:0
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ТЕРМОДИНАМИКА
РАБОТА И ТЕПЛОПЕРЕДАЧА
Рассмотрим газ, находящийся в цилиндрическом сосуде, и отделенный
от атмосферы поршнем площадью S
Слайд 2Если газ, расширяясь, передвигает поршень на расстояние dL, то он
производит над ним работу:
где dV = SdL - изменение объема
газа. Слайд 3Графическое представление работы
Работа газа зависит от траектории перехода из начального
состояния в конечное:
Слайд 5Теплопередача - процесс обмена энергией между системой и окружающими ее
телами, не сопровождающийся изменением внешних параметров состояния системы. Это процесс
передачи энергии неупорядоченного движения от одних тел к другим.Энергия, получаемая или отдаваемая системой в процессе теплопередачи называется количеством тепла Q (1 Дж).
Передача энергии от системы к внешним телам с изменением внешних макроскопических параметров называется работой.
Слайд 6Выражение для средней энергии молекул E = 3/2 kT учитывает
только энергию поступательного движения молекул. Однако наряду с поступательным движением
возможны так же вращение молекулы и колебания атомов, входящих в состав молекул.СТЕПЕНИ СВОБОДЫ СИСТЕМЫ. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ ХАОТИЧЕСКОГО ДВИЖЕНИЯ МОЛЕКУЛ ПО СТЕПЕНЯМ СВОБОДЫ.
Слайд 7Число степеней свободы материального объекта - это число независимых координат,
которые однозначно задают положение объекта в пространстве (или число независимых
движений, которые однозначно определяют энергию объекта):i = iпост. + iвращ. + iколеб.
Слайд 8Материальная точка. Положение материальной точки в пространстве полностью определяется заданием
значений трех её координат. Поэтому материальная точка имеет три поступательных
степени свободы:i = 3
Слайд 9Две материальные точки с жесткой связью.
Такая система может совершать
поступательное движение в трех направлениях и вращаться вокруг двух осей.
Следовательно, она имеет пять степеней свободы – 3 поступательных и 2 вращательных:i = 5
Слайд 10Три материальные точки с жесткой связью.
Такая система может совершать
поступательное движение в трех направлениях и вращаться вокруг трех осей.
Следовательно, она имеет шесть степеней свободы – 3 поступательных и 3 вращательных:i = 6
Слайд 11
Две материальные точки с упругой связью. Такая система имеет
шесть степеней свободы: 3 поступательных, 2 вращательных и 1 колебательную.
Слайд 12ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛ
Выражение
для средней энергии молекул E = 3/2 kT учитывает
только энергию поступательного движения молекул.Энергия, приходящаяся на каждую поступательную степень свободы равна:
Слайд 13На колебательную степень свободы приходится удвоенная энергия, так как колеблющаяся
частица обладает как потенциальной, так и кинетической энергией, средние значения
которых одинаковы и равны kT/2.Средняя энергия хаотического теплового движения одной молекулы равна:
Закон Больцмана о равномерном распределении энергии по степеням свободы:
На каждую поступательную и вращательную степень свободы приходится в среднем энергия kT/2, а на каждую колебательную степень свободы - энергия kT.
Слайд 14ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА.
Энергия, связанная с внутренними движениями частиц системы
и их взаимодействиями между собой, называется внутренней энергией системы. Под
внутренней энергией идеального газа понимают энергию хаотического движения его молекул.Слайд 16ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
I начало термодинамики говорит о сохранении полной энергии.
Количество
тепла, сообщенное системе, расходуется на приращение внутренней энергии системы и
на совершение системой работы: Q = U + AКоличество теплоты Q - мера переданной энергии при теплообмене.
Слайд 17 I начало термодинамики в дифференциальной форме:
dQ = dU
+ dA
dQ и dA нельзя рассматривать как приращения величин Q
и A.Для записи элементарного количества тепла и элементарной работы будем использовать другие символы Q и A соответственно: Q = dU + A
Слайд 18Изобарический процесс: Q = dU + A
Подводимое к газу
тепло затрачивается на изменение внутренней энергии системы и на совершение
им работы.Рассмотрим применение I начала термодинамики к изопроцессам в газах:
Слайд 19Изохорический процесс: Q = dU (A =
0, т.к. V = const)
При изохорическом процессе подводимое к
газу тепло затрачивается на изменение внутренней энергии газа. Работа расширения равна нулю.Слайд 20Изотермический процесс: Q = A (dU = 0,
т.к. T = const)
Подводимое к газу тепло при изотермическом
процессе затрачивается только на совершение работы.Слайд 22Удельной теплоемкостью вещества называется физическая величина, численно равная количеству тепла,
которое надо сообщить 1 кг вещества, чтобы нагреть его на
один Кельвин :Слайд 23Молярной теплоемкостью вещества называется физическая величина, численно равная количеству тепла,
которое надо сообщить 1 молю вещества, чтобы нагреть его на
один Кельвин :Слайд 24
Различают теплоемкость для случаев, когда нагревание происходит при постоянном
объеме (СV) или при постоянном давлении (CP) .
Теплоемкость при постоянном
объеме. Если нагревание происходит при постоянном объеме, система не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
Q = dU + A А = 0 Q = dU