Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
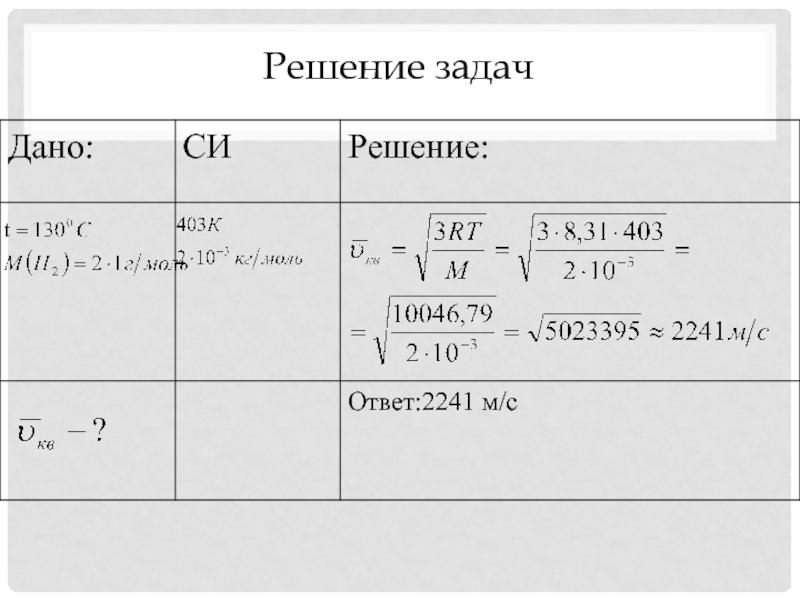
Решение задач
Содержание
- 1. Решение задач
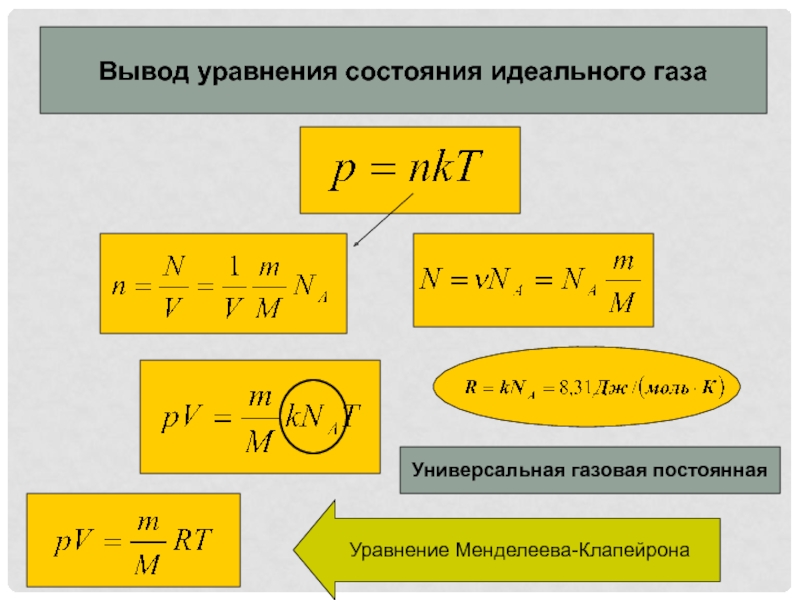
- 2. Вывод уравнения состояния идеального газаУниверсальная газовая постояннаяУравнение Менделеева-Клапейрона
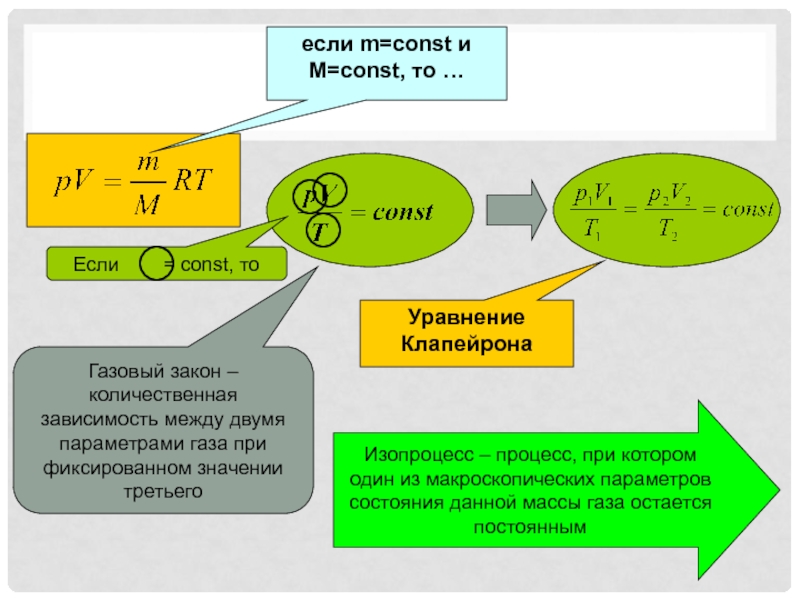
- 3. если m=const и M=const, то …Уравнение КлапейронаГазовый
- 4. Соотношение было открыто в 1662 г. Робертом
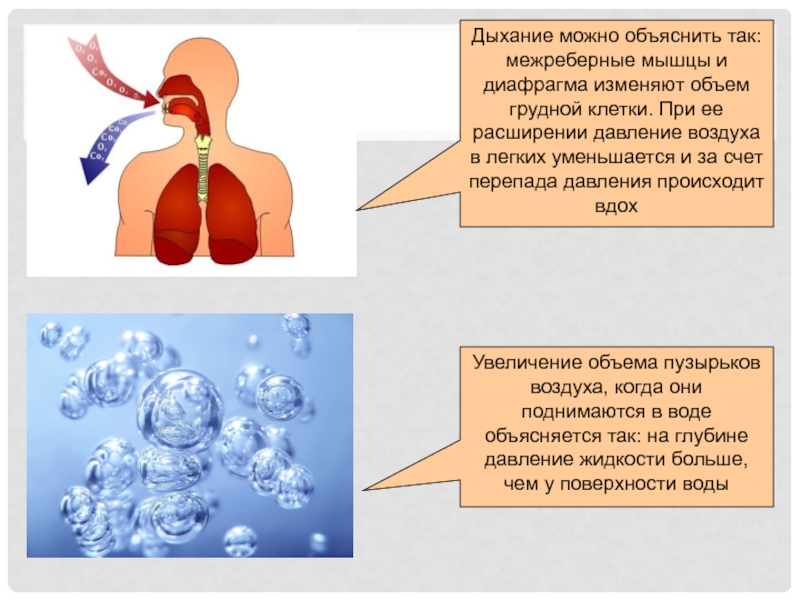
- 5. Дыхание можно объяснить так: межреберные мышцы и
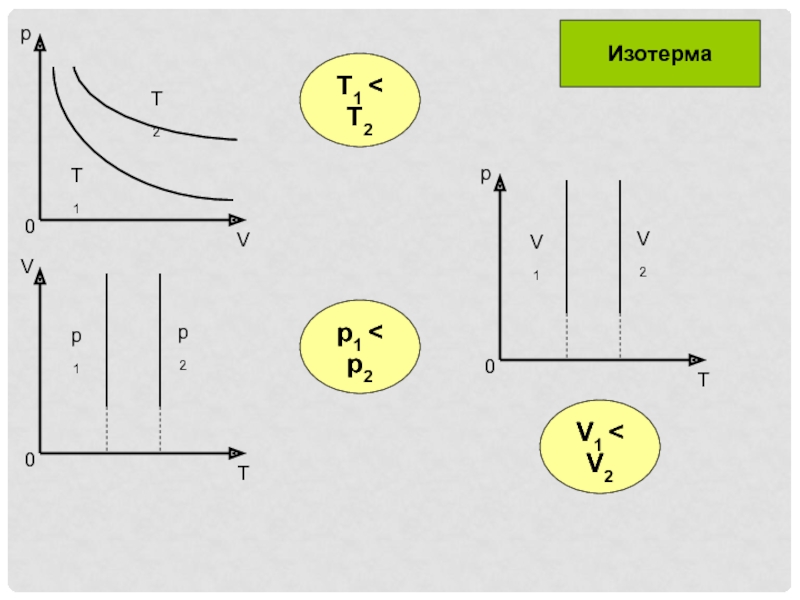
- 6. T1 < T2p1 < p2V1 < V2Изотерма
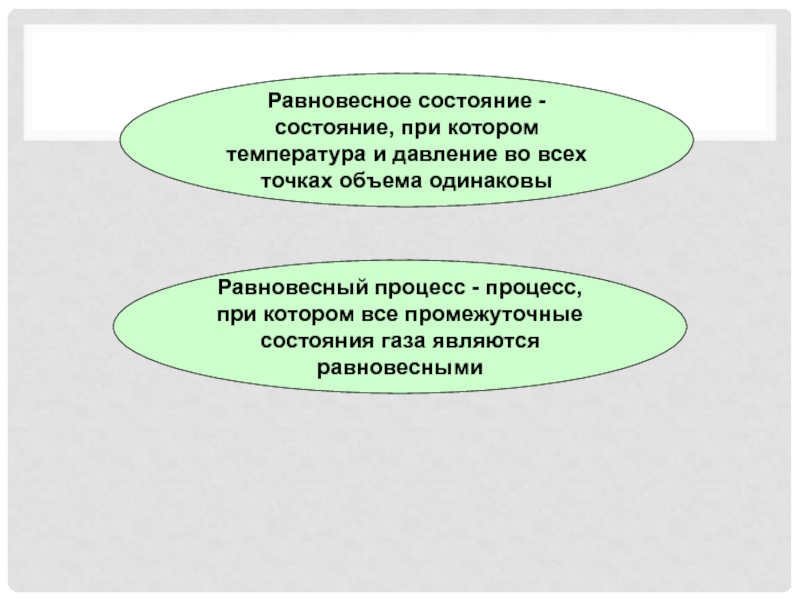
- 7. Равновесное состояние - состояние, при котором температура
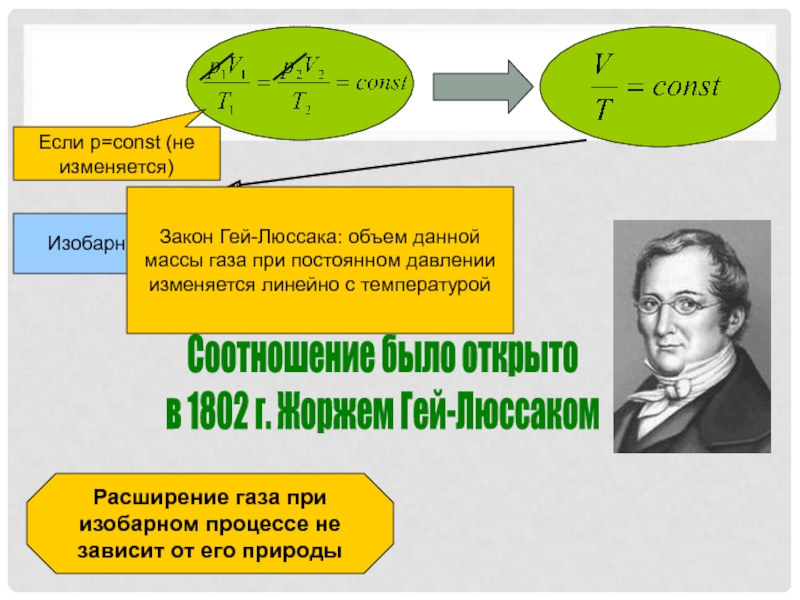
- 8. Соотношение было открыто в 1802 г. Жоржем
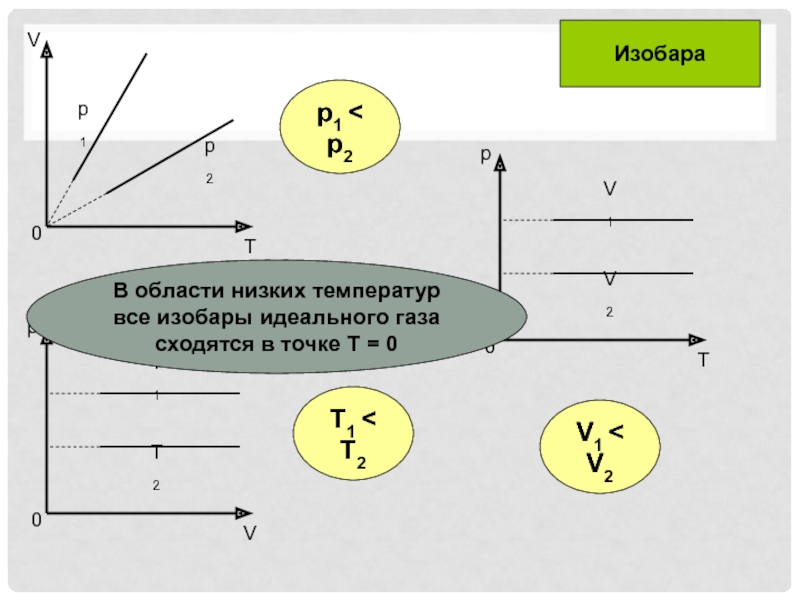
- 9. T1 < T2p1 < p2V1 < V2ИзобараВ
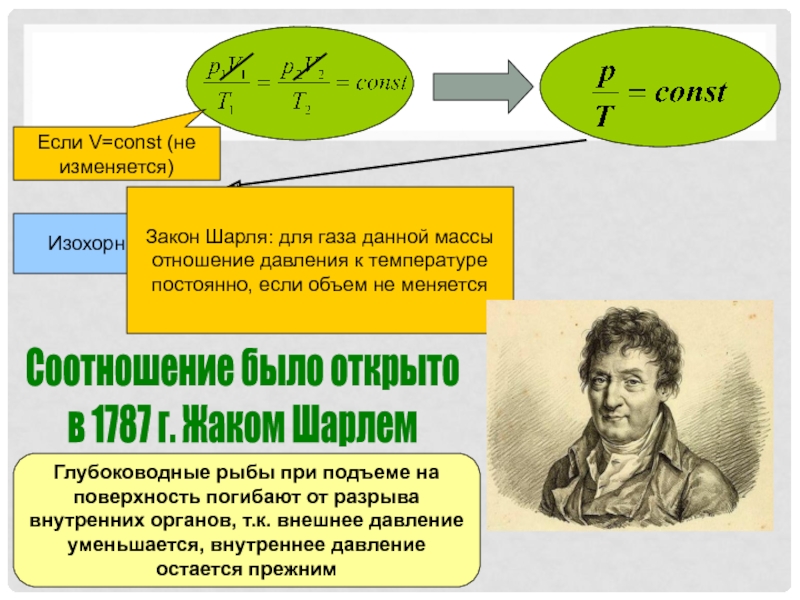
- 10. Соотношение было открыто в 1787 г. Жаком
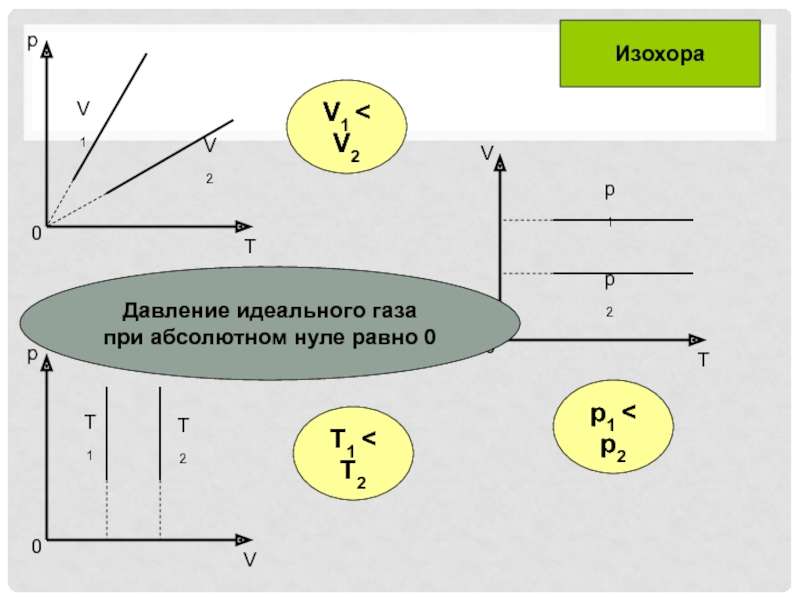
- 11. T1 < T2p1 < p2V1 < V2ИзохораДавление идеального газа при абсолютном нуле равно 0
- 12. Скачать презентанцию
Вывод уравнения состояния идеального газаУниверсальная газовая постояннаяУравнение Менделеева-Клапейрона
Слайды и текст этой презентации
Слайд 2Вывод уравнения состояния идеального газа
Универсальная газовая постоянная
Уравнение Менделеева-Клапейрона
Слайд 3если m=const и M=const, то …
Уравнение Клапейрона
Газовый закон – количественная
зависимость между двумя параметрами газа при фиксированном значении третьего
процесс, при котором один из макроскопических параметров состояния данной массы газа остается постояннымСлайд 4Соотношение было открыто
в 1662 г. Робертом Бойлем
Переоткрыто в 1676
г. Эдмоном Мариоттом
Если T=const (не изменяется)
Изотермический процесс
При изотермическом процессе плотность
газа изменяется прямо пропорционально давлениюСлайд 5Дыхание можно объяснить так: межреберные мышцы и диафрагма изменяют объем
грудной клетки. При ее расширении давление воздуха в легких уменьшается
и за счет перепада давления происходит вдохУвеличение объема пузырьков воздуха, когда они поднимаются в воде объясняется так: на глубине давление жидкости больше, чем у поверхности воды