Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера и её соединения Керченский Профессиональный Лицей Сферы
Содержание
- 1. Сера и её соединения Керченский Профессиональный Лицей Сферы
- 2. Положение в Периодической системе:Сера:Порядковый номер № 16Период : 3 периодГруппа: VI группа, главная подгруппа
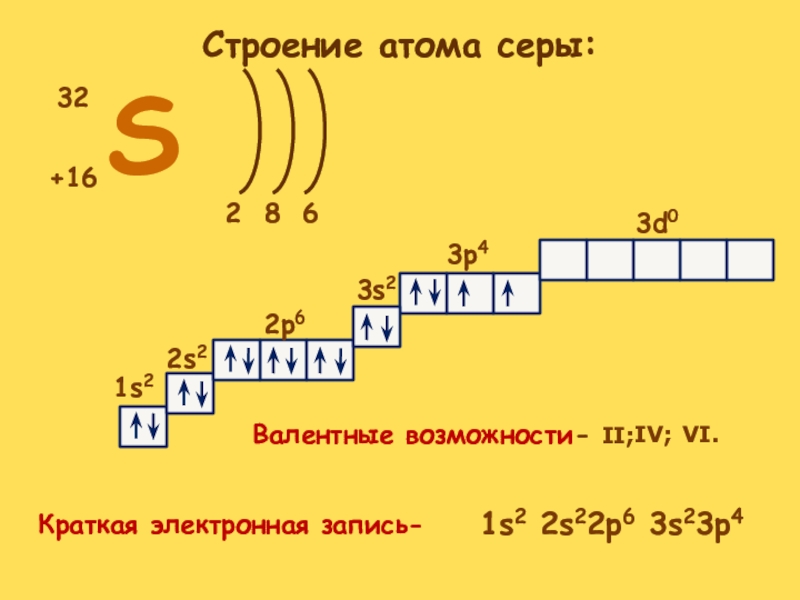
- 3. S+16322681s22s2
- 4. Твердое кристаллическое вещество. При плавлении Сера превращается
- 5. Слайд 5
- 6. Самородная сера, серный колчедан FeS2, медный колчеданCuFeS2,
- 7. Сера не только не растворяется, но и
- 8. Взаимодействие с металлами. 2 Na + S
- 9. Взаимодействие с галогенами: S + Cl2 =
- 10. Техника безопасности при работе с серной кислотойСерная
- 11. Na2SO4 + 2C = Na2S + 2CO2Na2S
- 12. №2№1№3№4BaCl2AgNO3метилоранжBaSO4белый осадокBaSO4белый осадокAgClбелый творожистый осадокAgIжелтый творожистый осадокоранжевыйрозовый
- 13. №1№3№2№4BaCl2AgNO3м/о№1 и №4 сульфаты№2 и №3 галогениды№1№4№2№3№1
- 14. Нахождение серы в природеСера самородная (S)Цинковая обманка(сфалерит
- 15. Сера самородная
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Аллотропия серыАллотропия – явление, когда один химический
- 21. Аллотропия серыкристаллическаяпластическая
- 22. Сера ромбическаяСера пластическая Сера моноклиннаяЦвет –
- 23. Применение серыПроизводство спичек МедицинаБорьба с вредителями
- 24. Спасибо за внимание!!!!!!!!!!
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Сера
и её соединения
Керченский Профессиональный Лицей Сферы Обслуживания
Презентацию подготовила
Учащейся 411группы
Бортник
Вита
Слайд 2Положение в Периодической системе:
Сера:
Порядковый номер № 16
Период : 3 период
Группа:
VI группа, главная подгруппа
Слайд 3S
+16
32
2
6
8
1s2
2s2
2p6
3s2
3p4
3d0
Краткая электронная запись-
Валентные возможности- II;
IV;
VI.
Строение атома серы:
1s2 2s22p6 3s23p4
Слайд 4Твердое кристаллическое вещество.
При плавлении Сера превращается в подвижную желтую
жидкость, которая выше 160 °С буреет.
Сера - плохой проводник
тепла и электричества. В воде она практически нерастворима. Хорошо растворяется в безводном аммиаке, сероуглероде.
Физические свойства
Слайд 6
Самородная сера, серный колчедан FeS2, медный колчеданCuFeS2, свинцовый блеск PbS
с цинковой обманкой ZnS
АнгидритCaSO4, гипс CaSO4∙2H2O и гипс пластинчатый
Соединения
Слайд 7Сера не только не растворяется, но и не смачивается водой.
Неудивительно, что с древности сера считалась символом сухости (и горючести.)
При
высокой температуре сера взаимодействует с перегретым водяным паром:3S + 2H2O =2H2S +SO2
Отношение к воде
Слайд 8Взаимодействие с металлами.
2 Na + S = Na2S
Zn
+ S = ZnS
Горение серы
S + O2 = SO2
Взаимодействие
с водородом:H2+ S = H2S
Химические свойства
Слайд 9Взаимодействие с галогенами:
S + Cl2 = SCl2
Взаимодействие с
ртутью.
Hg + S = HgS
Взаимодействие со сложными веществами.
S
+2H2SO4 =3SO2 = 2H2O; 3S + 6NaOH = Na2SO3 + 2 Na2S + 3H2O
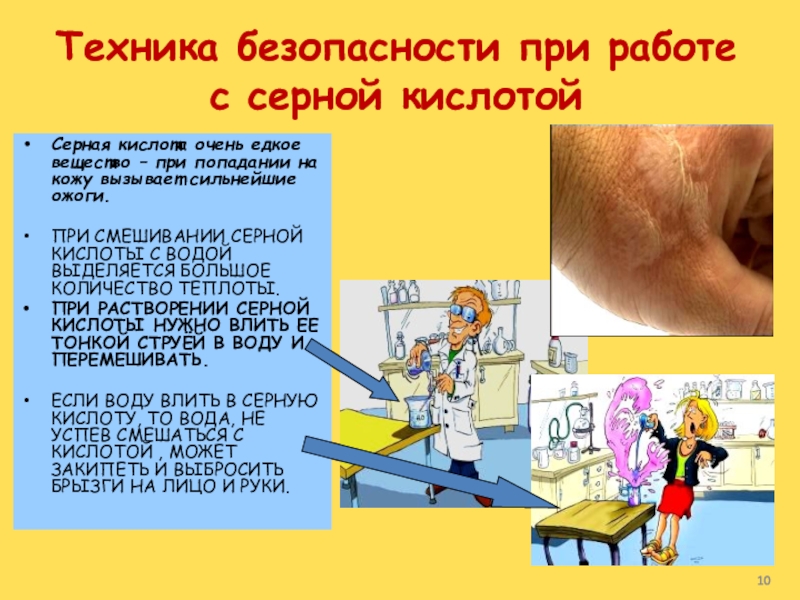
Слайд 10Техника безопасности при работе с серной кислотой
Серная кислота очень едкое
вещество – при попадании на кожу вызывает сильнейшие ожоги.
ПРИ СМЕШИВАНИИ
СЕРНОЙ КИСЛОТЫ С ВОДОЙ ВЫДЕЛЯЕТСЯ БОЛЬШОЕ КОЛИЧЕСТВО ТЕПЛОТЫ.ПРИ РАСТВОРЕНИИ СЕРНОЙ КИСЛОТЫ НУЖНО ВЛИТЬ ЕЕ ТОНКОЙ СТРУЁЙ В ВОДУ И ПЕРЕМЕШИВАТЬ.
ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ СМЕШАТЬСЯ С КИСЛОТОЙ , МОЖЕТ ЗАКИПЕТЬ И ВЫБРОСИТЬ БРЫЗГИ НА ЛИЦО И РУКИ.
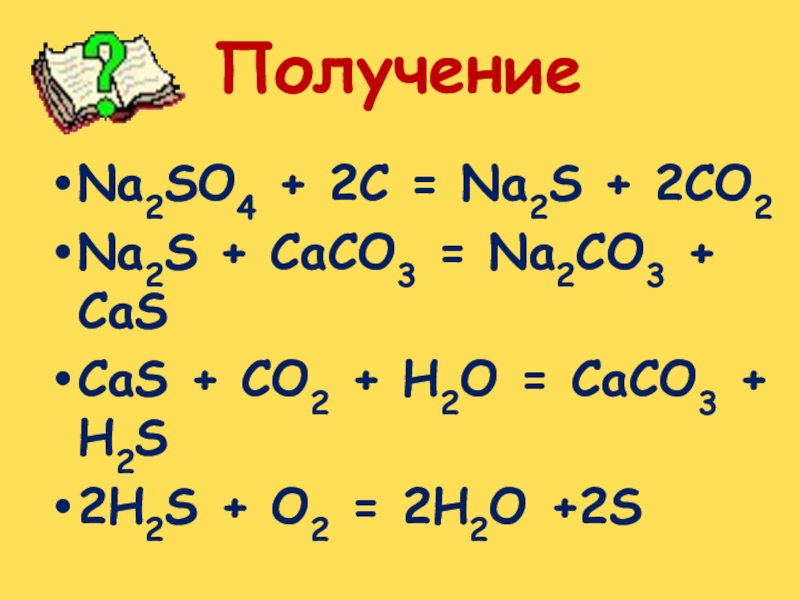
Слайд 11Na2SO4 + 2C = Na2S + 2CO2
Na2S + CaCO3 =
Na2CO3 + CaS
CaS + CO2 + H2O = CaCO3
+ H2S2H2S + O2 = 2H2O +2S
Получение
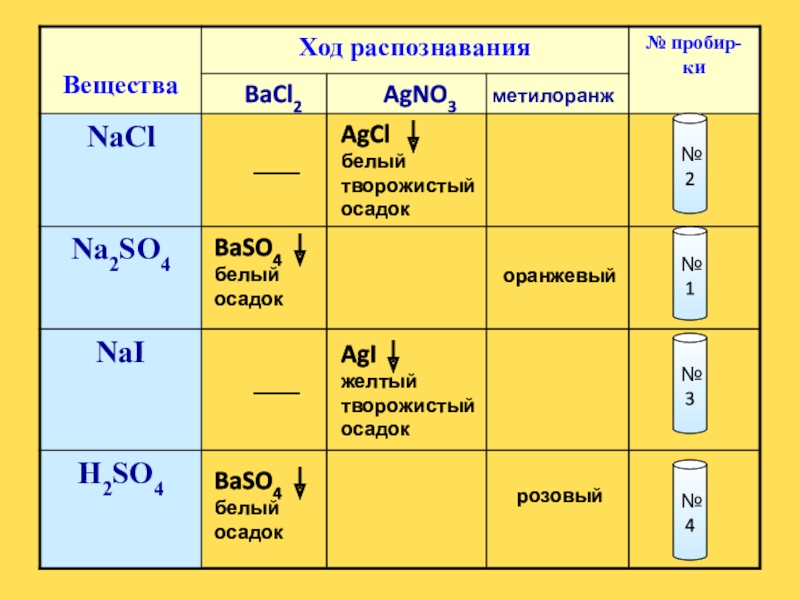
Слайд 12№2
№1
№3
№4
BaCl2
AgNO3
метилоранж
BaSO4
белый осадок
BaSO4
белый осадок
AgCl
белый творожистый осадок
AgI
желтый творожистый осадок
оранжевый
розовый
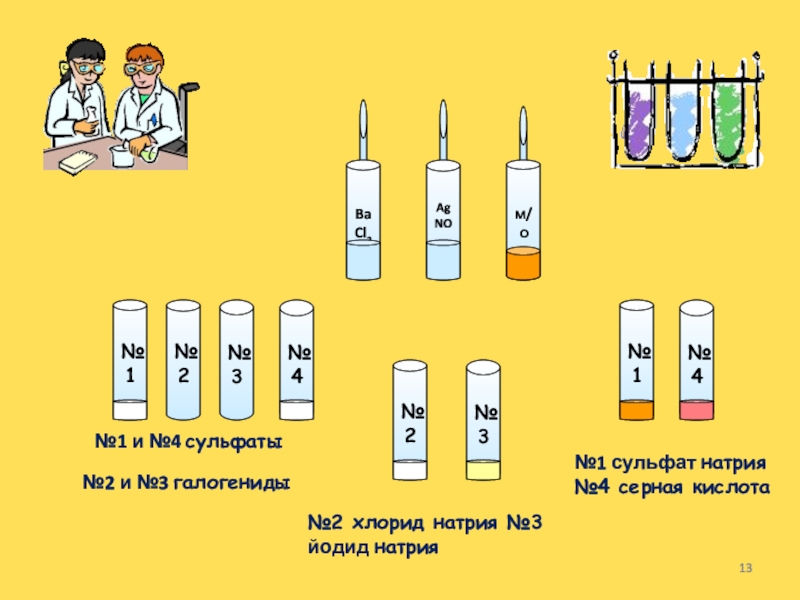
Слайд 13№1
№3
№2
№4
BaCl2
AgNO3
м/о
№1 и №4 сульфаты
№2 и №3 галогениды
№1
№4
№2
№3
№1 сульфат натрия №4
серная кислота
№2 хлорид натрия №3 йодид натрия
Слайд 14Нахождение серы в природе
Сера самородная (S)
Цинковая обманка
(сфалерит ZnS)
Киноварь (HgS)
Свинцовый блеск
(галенит
PbS)
Серный колчедан
(пирит FеS2)Слайд 20Аллотропия серы
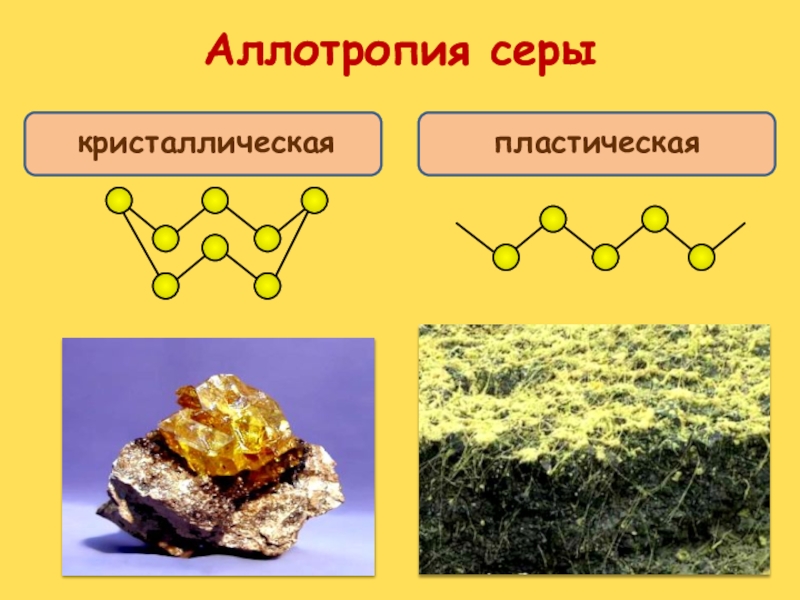
Аллотропия – явление, когда один химический элемент образует несколько
простых веществ.
Сами простые вещества, образованные одним химическим элементом называются
аллотропными
модификациями или аллотропными видоизменениями.
Для серы характерно явление аллотропии.
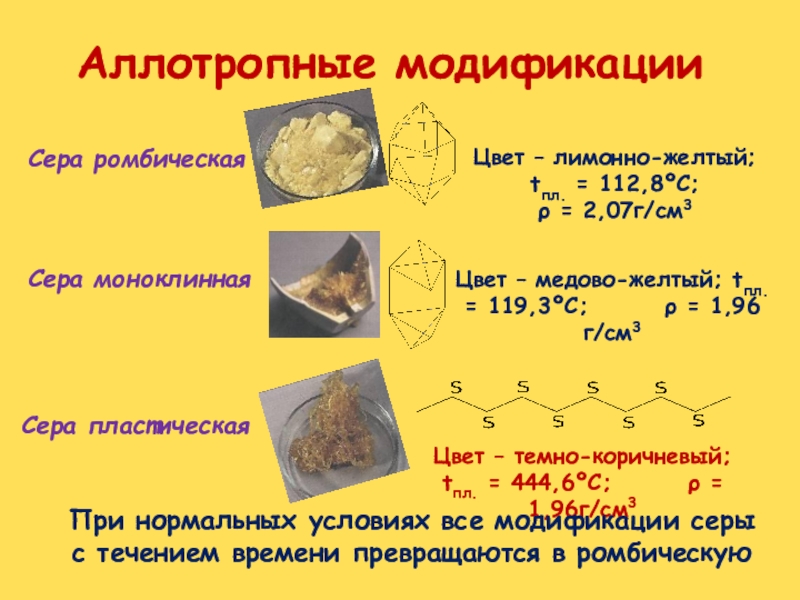
Слайд 22Сера ромбическая
Сера пластическая
Сера моноклинная
Цвет – лимонно-желтый; tпл. =
112,8ºС;
ρ = 2,07г/см3Цвет – медово-желтый; tпл. = 119,3ºС; ρ = 1,96г/см3
Цвет – темно-коричневый; tпл. = 444,6ºС; ρ = 1,96г/см3
При нормальных условиях все модификации серы с течением времени превращаются в ромбическую
Аллотропные модификации