Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли их классификация и свойства
Содержание
- 1. Соли их классификация и свойства
- 2. Цели урока:1)Познакомить учащихся с понятием соли, изучить
- 3. Что такое соли? Соли – это
- 4. Классификация солейПо растворимости в водеРастворимые
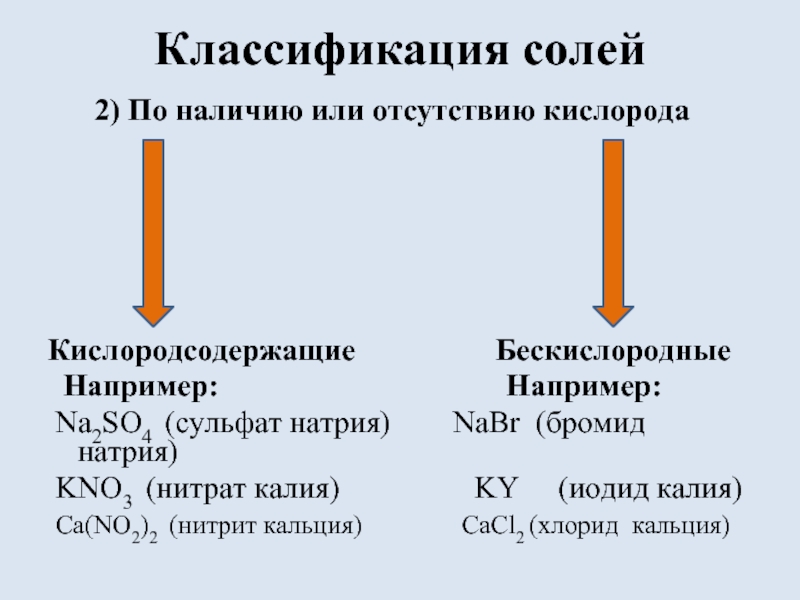
- 5. Классификация солей 2) По наличию
- 6. Разновидности солейСоли бывают:Средние соли – это продукты
- 7. Разновидности солей 2) Кислые соли –
- 8. Разновидности солей 3) Основные соли –
- 9. Типичные реакции средних солейСоль + кислота =
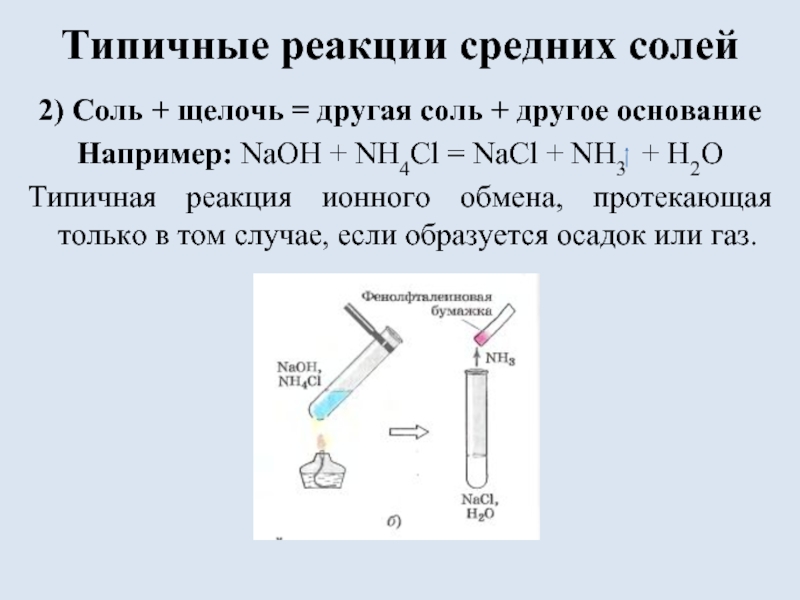
- 10. Типичные реакции средних солей2) Соль + щелочь
- 11. Типичные реакции средних солей
- 12. Типичные реакции средних солей4) Соль + металл
- 13. Обобщение темыТест «Как я запомнил тему»:1) Выберите
- 14. .4) К какому типу солей относится данная
- 15. Ответы:1. в2. г3. б4. б 5. в
- 16. Домашнее задание:§ 41 Упр. 2, 3.
- 17. Список источников 1) Габриелян О.С. Химия. 8
- 18. Скачать презентанцию
Цели урока:1)Познакомить учащихся с понятием соли, изучить основные классификации солей;2)Изучить основные химические свойства солей;3)Продолжить формирование умений составлять уравнения химических реакций;4)Продолжить воспитывать культуру работы с реактивами;
Слайды и текст этой презентации
Слайд 2Цели урока:
1)Познакомить учащихся с понятием соли, изучить основные классификации солей;
2)Изучить
основные химические свойства солей;
3)Продолжить формирование умений составлять уравнения химических реакций;
4)Продолжить
воспитывать культуру работы с реактивами;Слайд 3Что такое соли?
Соли – это класс химических соединений,
состоящих из ионов металла и ионов кислотного остатка.
(Например:
NaCl, NH4NO3, AgY)Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
(Например: K3PO4 = 3K+ + PO43- )
Слайд 4Классификация солей
По растворимости в воде
Растворимые
Нерастворимые
МалорастворимыеАммиачная селитра
NH4NO3 Сульфат кальция
Фосфат железа
FePO4
CaSO4
Слайд 5Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na2SO4 (сульфат натрия) NaBr (бромид натрия)
KNO3 (нитрат калия) KY (иодид калия)
Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Слайд 6Разновидности солей
Соли бывают:
Средние соли – это продукты полного замещения атомов
водорода в кислоте на металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)Диссоциация средних солей:
Na2CO3 = 2Na+ + CO32-
Слайд 7Разновидности солей
2) Кислые соли – это продукты неполного
замещения атомов водорода в кислоте на металл.
Например:
NaHCO3 (гидрокарбонат натрия)Mg(HSO4)2 (гидросульфат магния)
Диссоциация кислых солей:
Ca(HSO4)2 = Ca2+ + 2HSO4-
Слайд 8Разновидности солей
3) Основные соли – это продукты неполного
замещения гидроксогрупп в основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))AlOHCl2 (гидроксохлорид алюминия)
Диссоциация основных солей:
AlOHCl2 = AlOH2+ + 2Cl-
Слайд 9Типичные реакции средних солей
Соль + кислота = другая соль +
другая кислота
Например: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.Слайд 10Типичные реакции средних солей
2) Соль + щелочь = другая соль
+ другое основание
Например: NaOH + NH4Cl = NaCl + NH3
+ H2OТипичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 11Типичные реакции средних солей
3) Соль1
+ соль2 = соль3 + соль4
Например: Na2SO4 + BaCl2
= BaSO4 +2NaClТипичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Слайд 12Типичные реакции средних солей
4) Соль + металл = другая соль
+ другой металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) +
CuПравила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Слайд 13Обобщение темы
Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б)
Ca(OH)2
в) Na2SO4 г) MgО
2) Какая из приведенных солей растворима в воде:
а)
AgCl б) MgSв) FePO4 г) CuSO4
3) Какая из приведенных солей бескислородная:
а) CаSO4 б) KBr
в) NH4NO3 г) Na2CO3
Слайд 14.
4) К какому типу солей относится данная соль - AlOHCl2:
а)
средняя б) основная
в) кислая г) ни к одной из этих
5) Какая реакция
не является типичной реакцией для средних солей:а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь
Слайд 17Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для
общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. –
М.: Дрофа, 2010.-270 с., [2]с.: ил.Использованы фотографии:
http://ru.wikipedia.org/wiki/Фосфат железа (III)
фосфат железа
http://www.freetorg.ru/lead/ammiachnaya-selitra-azotno-fosforno-kalijnoe-udobrenie-npk,1506202.html
аммиачная селитра
http://www.freetorg.com.ua/lead/prodam-kalcij-sernokislyj,2478523.html
сульфат кальция
Теги