Слайд 1Электронные состояния в твердых телах.
Рассмотрим прежде всего
изменение энергетических уровней отдельного атома при наложении на него внешней
или возмущающей силы.
Если возмущающая сила оказывает воздействие на электроны атома, то энергетические уровни электронов смещаются, поскольку при этом изменяется полная энергия электронов.
Электронные уровни могут при наложении возмущающей силы расщепиться на уровни с несколько различными по величине энергиями.
Причина этого расщепления заключается в том, что электроны, находящиеся в различных квантовых состояниях, но обладающие одинаковой энергией, могут по-разному взаимодействовать с возмущающей силой.
Слайд 2 Когда атомы сближаются друг с другом, образуя твердое
тело, взаимодействие между ними оказывает возмущающее действие на первоначальные атомные
энергетические уровни.
В результате при достаточно сильном сближении симметрия электронных состояний, существовавшая в изолированных атомах, нарушается, вследствие чего уровни расщепляются.
Тогда единственный энергетический уровень твердого тела с большим расстоянием между атомами в решетке превращается в большое число близко расположенных друг к другу уровней твердого тела с малым межатомным расстоянием, образуя полосу (зону) энергетических уровней.
Слайд 3 Некоторые свойства полос энергетических уровней совершенно очевидны.
Во-первых, энергия связи твердого тела должна обусловливаться сдвигом энергетических
уровней электронов, подобно тому, что происходит при образовании химической связи.
Следовательно, при образовании твердого тела энергетические уровни должны в среднем смещаться вниз.
Во-вторых, больше всего подвержены возмущающему действию соседних атомов наиболее удаленные от ядра, или валентные электроны, так как они расположены ближе всех остальных электронов к соседним атомам.
В-третьих, равновесное расстояние между атомами решетки должно соответствовать минимуму энергии, поскольку при дальнейшем сближении атомов энергетические уровни начинают смещаться вверх.
В-четвертых, состояния исходной системы при сближении атомов должны деформироваться непрерывным образом.
Слайд 4 Чтобы уяснить физическое происхождение энергетической структуры кристалла, следует
детально рассмотреть по крайней мере три задачи:
1)
природу сил притяжения между атомами;
2) природу сил отталкивания, действующих при слишком тесном сближении атомов друг с другом;
3) степень расщепления энергетических уровней вследствие взаимодействий между атомами.
Ответ на первый вопрос дать трудно, поскольку он различен для разных структур твердого тела.
Слайд 5 Атомы отталкиваются при сближении друг с другом в
основном потому, что каждому данному электронному состоянию соответствует вполне определенная
область пространства.
Принцип запрета Паули утверждает, что одинаковые волновые функции различных атомов не могут локализоваться в одной и той же области пространства, так как в этом случае они описывали бы одно и то же состояние.
Если атомы сближаются так, что пространственная область, в которой определены волновые функции, становится все меньше и меньше.
Происходит пространственное перекрытие волновых функций и возникают условия, в которых принцип Паули не может удовлетворяться и в силу действия принципа неопределенности энергия системы возрастает.
Слайд 6 Таким образом, когда атомы оказываются слишком близко друг
к другу, их полная энергия возрастает.
Это эквивалентно
действию отталкивающей силы.
Третий вопрос является предметом положения о том, что электроны в зоне энергетических уровней подвижны, а не локализуются на индивидуальных атомах.
Подвижность электронов в твердых телах можно объяснить, рассматривая изменения волновой функции, возникающие при сближении изолированных атомов, когда происходит перекрытие волновых функций.
Перекрытие появляется уже при каком-то конечном расстоянии между атомами, однако оно становится заметным тогда, когда межатомное расстояние достигает величины порядка 10 ангстрем или менее.
Слайд 7 Для электрона, находящегося в какой-то момент времени на
орбите одного из атомов, существует конечная вероятность того, что он
будет захвачен соседним атомом.
Чем больше степень перекрытия, тем больше вероятность миграции электрона от атома к атому.
При межатомном расстоянии, соответствующем реальным кристаллическим решеткам, перекрытие волновых функций весьма велико, так что электрон не может долго находиться на орбите данного атома и легко переходит к соседнему атому.
Поскольку переходы электронов от атома к атому происходят быстро, рассматриваемые электроны следует считать принадлежащими всему коллективу атомов кристалла, а не отдельным атомам
Слайд 8 Волновые функции электронов, расположенных ниже валентной оболочки, сильнее
локализованы вблизи ядра, чем волновые функции валентных электронов, поэтому степень
перекрытия этих функций значительно меньше.
Следовательно, внутренние электроны не участвуют заметным образом в процессах перехода от атома к атому.
Слайд 9Кристаллическое и аморфное состояние вещества.
Вещество в окружающем
нас трехмерном мире может находиться в четырех агрегатных состояниях: жидком,
твердом, газообразном и в виде плазмы (плюс пятое - наносостояние).
Согласно классическому определению в твердом состоянии вещество с трудом изменяет объем и форму (ничтожно мало сжимается и деформируется), в жидком - с трудом изменяет объем, но легко изменяет форму (ничтожно мало сжимается, но легко деформируется), в газообразном легко изменяет и объем, и форму.
В этих трех состояниях химическая целостность и индивидуальность атомов сохраняются.
В плазменном состоянии атомы полностью ионизованы и химическую индивидуальность утрачивают.
Слайд 10 С точки зрения микроэлектроники и наноэлектроники наиболее интересным
и перспективным является твердое агрегатное состояние вещества, поскольку даже теоретики
пока не додумались делать жидкие или газообразные микросхемы, не говоря уже о плазменных.
Все твердые тела делятся на две неравные группы: кристаллические и аморфные.
Существует также небольшая группа соединений, соединяющих свойства аморфных и кристаллических веществ и получившая название аморфно-кристаллических. К ней относятся, например, ситаллы.
Слайд 11 До недавнего времени принято было считать, что только
кристаллическая структура может претендовать на гордое название твердого тела.
К концу тысячелетия вдруг выяснилось, что кристаллическая структура не самый распространенный и далеко не самый интересный тип твердого тела.
Однако рассмотрим ее все же первой. Кристаллы - это вещества, в которых составляющие их частицы (атомы, молекулы) расположены строго периодически, образуя геометрически закономерную кристаллическую структуру.
Каждое кристаллическое вещество отличается от других кристаллических веществ по его атомной структуре.
Слайд 12 Особенностью строения кристаллических веществ является наличие корреляции во
взаимном расположении атомов (молекул) на расстояниях больших, чем средние межатомные
расстояния - это так называемая упорядоченность дальнего порядка.
Можно привести еще определение Вульфа - кристаллом называется тело, ограниченное в силу своих внутренних свойств плоскими поверхностями - гранями.
Все кристаллы в отношении хотя бы некоторых свойств являются анизотропными, т.е. их свойства зависят от направления в кристалле.
Слайд 13 Кристаллическое состояние рассматривается большинством исследователей как частный, и
далеко не самый интересный случай твердого тела.
Подавляющее большинство окружающих
нас веществ представляет собой неупорядоченные системы, в которых отсутствует дальний порядок, но в то же время существует ближний порядок в расположении атомов.
К ним относятся жидкие металлы и полупроводники, стекло, аморфные металлические сплавы, большинство органических структур.
Слайд 14 Аморфные твердые тела, подобно кристаллическим, могут быть диэлектриками,
полупроводниками и металлами.
Одни из аморфных тел весьма
сложны по составу (обычное стекло), другие же представляют собой простые химические соединения, например стекловидный кварц.
Обычное стекло - наиболее характерный пример аморфного тела, поэтому в настоящее время принято в определенных научных кругах твердое тело в аморфном состоянии называть стеклообразным.
Изотропия аморфного вещества проявляется, например, в том, что оно не дает плоской поверхности расщепления, как кристалл, обладающий спайностью, а дает неправильный излом.
Слайд 15 Полученные экспериментальные данные свидетельствуют о существовании в аморфных
твердых телах, так же как и в кристаллах, разрешенных и
запрещенных участков энергетического спектра, т.е. о наличии разрешенных и запрещенных зон.
Однако в запрещенной зоне аморфных веществ имеются какие-то разрешенные состояния, отчасти подобные обычным локальным уровням в кристаллических твердых телах.
Обусловлены они могут быть разными причинами, которые до настоящего времени служат поводом для плодотворной и хорошо оплачиваемой дискуссии между теоретиками.
Слайд 16 Аморфные диэлектрики, стекла и керамика имеют исключительно перспективное
будущее.
Достаточно сказать, что в списке двадцати наивысших
научных достижений человеческой цивилизации по докладу Н. Армстронга в Национальной Инженерной Академии США в каждом пункте присутствуют стеклянные, стеклоподобные и керамические материалы, и далеко не на последнем месте.
Более 22% мировых патентов выдаются именно в области этих материалов, а в США объемы производства новых только керамических материалов составляют всего 1,5%, а по стоимости - 18% от стоимости поставок всех материалов, что превышает 100 млрд. долл.
Слайд 17 Если интерес к аморфным диэлектрикам носит ошеломляющий характер,
то интерес к новому классу материалов - аморфным металлам, называемым
также металлическими стеклами, носит характер уже патологический.
Создана прогрессивная технология получения аморфных металлов, в основе которой лежит быстрое (со скоростью больше 106 К/с) охлаждение тонкой струи расплавленного металла.
Формирование аморфных слоев облегчается, если к металлу добавить некоторое количество примесей.
Еще более благоприятные условия для получения металлического стекла создаются при осаждении сплавов "металл-металл" и "металл-металлоид".
Полученные таким путем металлические стекла обладают весьма интересными свойствами, обусловленными их атомной структурой.
Слайд 18 При нагревании в аморфных металлах происходят структурные изменения.
В отличие от обычных оксидных стекол, которые при
нагреве размягчаются и переходят в расплав, а при охлаждении расплава вновь образуется стекло, металлические стекла при повышении температуры кристаллизуются.
Металлические аморфные сплавы обладают очень высокой коррозионной стойкостью, особенно сплавы железа и никеля, содержащие хром.
По электропроводности аморфные металлы ближе к жидким металлам, чем к кристаллическим.
Слайд 19Энергия связи в кристаллической решетке.
Проблема связи атомов
в твердых телах вследствие одинаковой природы сил взаимодействия между атомами
аналогична проблеме связи атомов в молекуле.
Рассмотрим два атома, А и В. При достаточно большом расстоянии друг от друга они ведут себя, естественно, как свободные.
Энергия такой системы, состоящей из двух изолированных атомов, равна сумме энергий этих атомов, которую можно произвольно принять за нуль.
Слайд 20 Атомы не взаимодействуют друг с другом до тех
пор, пока расстояние r между ними велико по сравнению с
величиной (ra+rb), где ra и rb - радиусы атомов А и В.
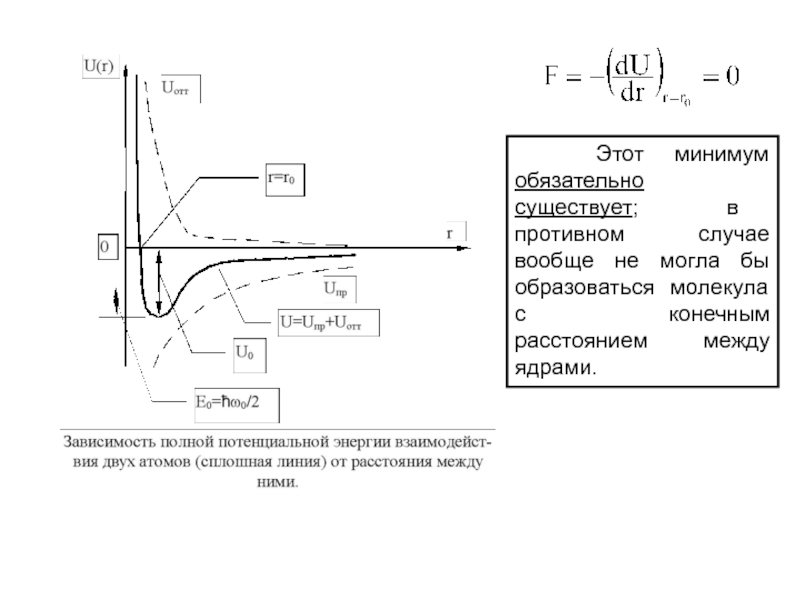
Отметим, что если при уменьшении расстояния между атомами энергия системы понижается по сравнению с суммарной энергией изолированных атомов, то между атомами возникает сила притяжения.
Это соответствует уменьшению потенциальной энергии системы U(r).
При некотором расстоянии r = r0 энергия U(r) достигает минимального значения, которое соответствует силе F:
Слайд 21
Этот минимум обязательно существует; в противном случае вообще
не могла бы образоваться молекула с конечным расстоянием между ядрами.
Слайд 22 При дальнейшем сближении атомов между ними начинают действовать
силы отталкивания, которые быстро возрастают с уменьшением r , что
сопровождается возрастанием потенциальной энергии U(r).
Смена притяжения отталкиванием может быть приближенно описана путем представления полной потенциальной энергии взаимодействия в виде суммы двух членов, из которых один член (отрицательный) соответствует энергии сил притяжения, а другой (положительный) - энергии сил отталкивания:
Слайд 23 При расстоянии r = r0, соответствующем минимуму энергии
системы, силы притяжения уравновешиваются силами отталкивания.
При этом
образуется молекула АВ с наиболее стабильной конфигурацией, в которой ядра атомов совершают колебания с собственной частотой ω0.
Вблизи положения равновесия форма кривой U = U(r) близка к параболе, как это видно из разложения U(r) в ряд Тейлора в окрестности r = r0
Слайд 24 Из данного выражения следует, что при не слишком
больших отклонениях атома от положения равновесия (когда третьим членом можно
пренебречь) возвращающая сила пропорциональна расстоянию и атомы колеблются как гармонические осцилляторы.
Энергетические уровни такого осциллятора, как это следует из квантовой механики, могут быть получены из следующего выражения:
(n=0,1,2,3...)
Слайд 25 За начальное состояние системы обычно принимают такое состояние,
когда частицы (атомы, молекулы, ионы) находятся друг от друга на
достаточно больших расстояниях и не взаимодействуют между собой, так что можно положить U1 = 0.
U = U1−U2
Глубина минимума U0 равна энергии связи атомов в молекуле. Энергия связи, или энергия сцепления, равна разности потенциальной энергии системы в начальном (1) и конечном (2) состояниях.
Слайд 26 Конечное состояние отвечает равновесному расположению частиц системы при
Т = 0 К.
Для оценки энергии связи,
необходимо знать хотя бы в общем виде зависимости потенциалов притяжения и отталкивания от расстояния между взаимодействующими атомами.
Конкретный вид этих зависимостей определяется природой взаимодействующих атомов. Исходя из электростатического характера сил притяжения их потенциал можно представить в виде степенной функции:
Uпр = −a/rm
где а - положительная константа; m - показатель степени r, имеет также положительное значение.
Слайд 27 При m = 1 потенциал сил притяжения соответствует
обычному кулоновскому взаимодействию между противоположно заряженными ионами, а при m
= 6 потенциалу притяжения между атомами инертных газов.
Для потенциала сил отталкивания, который обусловлен прежде всего отталкиванием ядер взаимодействующих атомов и зависит от экранировки ядер окружающими их электронами, Борн и Ланде, исходя из классических представлений, получили выражение:
Uотт = b/rn где b,n > 0 − постоянные, r − расстояние между центрами взаимодействующих атомов.
Слайд 28 При выводе формулы для потенциала сил отталкивания Борном
и Ланде была выбрана статическая модель атома, в которой электроны
в 8 - электронной оболочке размещены по вершинам куба.
Совершенно очевидно, что при взаимодействии таких атомов потенциал сил отталкивания должен зависеть от их взаимной ориентации, чего однако никогда не наблюдается в эксперименте.
Вообще-то нормальному уму крайне трудно представить атом, имеющий форму кубика с острыми углами, особенно в свете планетарной модели Бора или модели электронных оболочек.
Слайд 29 Квантово − механический расчет, выполненный Борном и Майером,
привел для потенциала сил отталкивания к полуэмпирическому выражению, которое лучше
согласуется с экспериментом:
Uот = be−r/ρ где b и ρ − постоянные. Хотя формула Борна Майера и лучше описывает реальность, однако предпочитают пользоваться формулой Борна Ланде, поскольку это значительно упрощает расчеты, т.е. ищут не там где потеряли, а там, где светлее и удобнее - под фонарем.
Выражение для полной потенциальной энергии взаимодействия двух атомов запишем в виде:
Для того, чтобы функция U в этом выражении имела минимум, необходимо, чтобы показатель степени потенциала отталкивания был больше показателя степени потенциала притяжения, т.е. чтобы выполнялось условие: n > m.
Слайд 30 Зависимость энергии связи в кристаллах от межатомного расстояния
r, так же как и в молекулах, определяется двумя главными
членами:
1) притяжением атомов, обусловленным взаимодействием валентных электронов, и
2) кулоновским отталкиванием внутренних оболочек атомных остовов и отталкиванием ядер.
Для устойчивого равновесного состояния (U0, r0) обязательно наличие минимума энергии на суммарной кривой энергий притяжения и отталкивания, который соответствует определенной стабильной конфигурации в расположении атомов кристаллической решетки.
Слайд 31Энергия связи (или энергия сцепления) кристалла представляет собой энергию, которая
необходима для разделения тела на составные части.
В
зависимости от типа твердого тела составными частями могут быть молекулы и атомы в молекулярных кристаллах, атомы в ковалентных и металлических кристаллах, положительно и отрицательно заряженные ионы в ионных кристаллах.
Слайд 32Молекулярная связь и молекулярные решетки.
К молекулярным кристаллам
относят твердые тела, в узлах кристаллической решетки которых располагаются либо
одинаковые молекулы с насыщенными связями, либо атомы инертных газов.
В молекулярных кристаллических решетках наблюдается локальная анизотропия связей: внутримолекулярные силы очень велики по сравнению с межмолекулярными.
Такие связи встречаются у элементов, в которых электронная конфигурация в малой степени допускает переходы электронов между атомами.
Количественной характеристикой внутримолекулярных сил является энергия диссоциации молекул на атомы (D), количественной характеристикой межмолекулярных сил является энергия испарения (сублимации) 1 моля (S). В молекулярных решетках D > S, причем на несколько порядков.
Слайд 33 В молекулярных кристаллах частицы удерживаются вместе слабыми силами
Ван-Дер-Ваальса (В-Д-В).
Энергия сцепления весьма мала, порядка 0,02
- 0,15 эВ, поэтому обычно температура плавления таких кристаллов очень низкая (например, сахар).
Силы В-Д-В обусловлены возможностью атома или молекулы поляризоваться под влиянием электрического поля, причем даже два нейтральных изотропных атома индуцируют друг в друге малые дипольные электрические моменты.
Слайд 34 В среднем распределение заряда в изолированном атоме имеет
сферическую симметрию, атом электронейтрален и центры зарядов лежат в центре
ядра.
При сближении атомов облако электронов одного из них в какой-то момент может оказаться смещенным, так что центры положительных и отрицательных зарядов уже не будут совпадать и возникнет мгновенный электрический диполь.
Такая флуктуация может возникать вследствие увеличения энергии атома (например, столкновение с другой частицей, квантом или фононом).
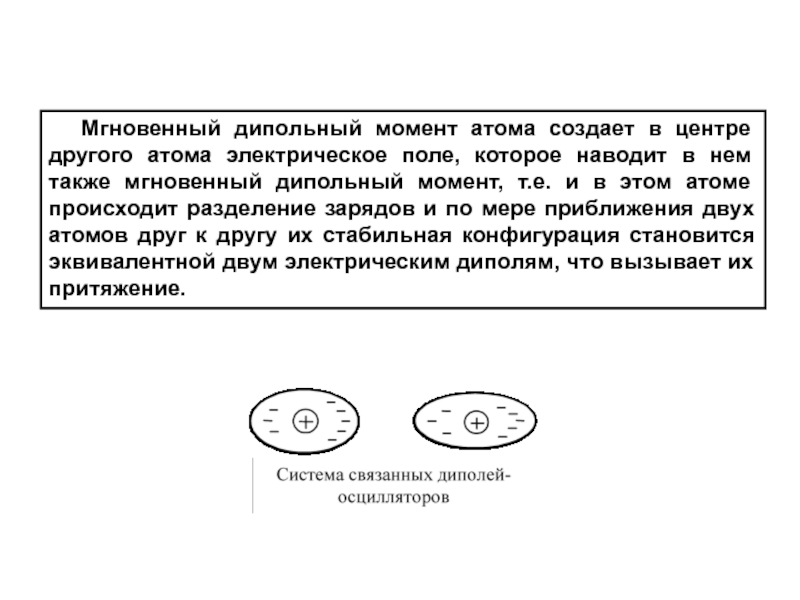
Слайд 35 Мгновенный дипольный момент атома создает в центре другого
атома электрическое поле, которое наводит в нем также мгновенный дипольный
момент, т.е. и в этом атоме происходит разделение зарядов и по мере приближения двух атомов друг к другу их стабильная конфигурация становится эквивалентной двум электрическим диполям, что вызывает их притяжение.
Слайд 36 Такую систему можно рассматривать как систему из двух
гармонических осцилляторов.
Квантово-механический расчет сил притяжения для системы
из двух гармонических осцилляторов, находящихся на расстоянии r друг от друга выполнен Лондоном в 1930 г.
Он получил, что полная энергия двух осцилляторов уменьшается вследствие взаимодействия на величину, обратно пропорциональную шестой степени расстояния между ними.
где ω0 − собственная частота простого гармонического осциллятора; а = P/E − поляризуемость осциллятора (атома); Р − дипольный момент; Е − напряженность электрического поля; а − постоянная.
Слайд 37
Уменьшение энергии системы соответствует возникновению силы притяжения между
осцилляторами, которая изменяется обратно пропорционально седьмой степени расстояния и зависит
от поляризуемости а.
Поляризуемость определяет также оптические свойства кристаллов − дисперсию света − поэтому силы В-Д-В называют дисперсионными.
Поскольку притяжение, обусловленное силами В-Д-В мало, то обусловленная им энергия связи невелика и составляют в итоге несколько тысяч калорий на моль.
Силы В-Д-В действуют между любыми другими атомами, когда они находятся достаточно близко.
При дальнейшем уменьшении расстояния между атомами электронные оболочки начинают перекрываться и возникают силы отталкивания, главным образом вследствие действия принципа Паули.
Слайд 38 При перекрывании электронных оболочек электроны первого атома стремятся
частично занять состояния второго, и при перекрытии оболочек электроны должны
переходить в свободные квантовые состояния с более высокой энергией, т.к. электроны не могут занимать одну и ту же область пространства без увеличения их кинетической энергии.
Это увеличение приводит к увеличению полной энергии системы двух взаимодействующих атомов и, следовательно к появлению сил отталкивания.
Принято в настоящее время потенциал сил отталкивания представлять в форме степенного закона Uот = b/rn , где п = 12, что представляет собой хорошее приближение, хотя и не имеющее никакого обоснования.
Слайд 39 Чем выше атомный номер, тем больше энергия сцепления
и температура плавления молекулярных кристаллов.
С ростом Z
число электронов в одном атоме возрастает и электронная оболочка становится более рыхлой и легче деформируется, поэтому дипольные моменты возрастают.
Молекулярные связи встречаются не только у благородных газов в твердом состоянии.
Твердые вещества из насыщенных молекул − HCl, CH4, CnH2mOm (сахар) образуются за счет сил В-Д-В, т.к. они представляют собой полностью насыщенные комплексы с электронными оболочками, аналогичными заполненным оболочкам или представляют собой естественные диполи.
Слайд 40 Физические свойства кристаллов с чисто В-Д-В связями:
1. По электрическим свойствам − изоляторы, прозрачные для электромагнитного
излучения вплоть до глубокого ультрафиолета.
2. Зонная структура не известна, но ширина запрещенной зоны велика.
Перекрытие электронных состояний столь мало, что энергетический интервал между уровнями валентной зоны и зоны проводимости того же порядка, что и расстояние между соответствующими атомными уровнями, поэтому состояние электронов в кристалле почти не отличается от их состояния в изолированном атоме.
Слайд 41 Молекулярную решетку имеют и впервые полученные в 1985
г. новые углеродные соединения − фуллериты, имеющие кристаллическую структуру и
полые молекулы которых (фуллерены) имеют сферическую форму и содержат от 60 до 240 и более атомов углерода.
Поверхность фуллерена С60 по своей структуре напоминает футбольный мяч и образована 20 шестиугольниками и 12 пятиугольниками. Основой для образования молекулы фуллерена является обычная графитовая плоскость, состоящая из шестиугольников с гранями по 0,137 нм (что даже меньше, чем у алмаза − 0,156 нм) но отсутствие поперечных связей делает графит таким пластичным.
Для того, чтобы возникла шарообразная структура, графитовая плоскость в части ячеек потеряла по одному атому.
Межатомные расстояния в молекуле такие же маленькие, как в графитовой ячейке, поэтому молекула обладает твердостью большей, чем алмаз.
Слайд 42Ионная связь и ионные решетки.
Ионные кристаллы - это
соединения с преобладающим ионным характером химической связи, в основе которой
лежит электростатическое взаимодействие между заряженными ионами.
Типичные представители ионных кристаллов − галогениды щелочных металлов.
Первая теория ионной связи была разработана Косселем в 1916 г.
Он предположил, что поскольку инертные газы, имея восьми электронные оболочки, весьма устойчивы, то и атомам других элементов свойственно стремление приобрести такие оболочки.
Слайд 43 Атом натрия, имея один валентный электрон, стремится его
отдать, а атом хлора, у которого не хватает до полной
оболочки одного электрона, стремится его приобрести.
Способность атома отдавать наружные электроны определяется величиной его ионизационного потенциала I (процесс эндотермический − идет с поглощением энергии), а способность присоединять электроны − энергией присоединения Е (процесс экзотермический − энергия выделяется).
При перекрытии р − орбиталей имеет место понижение номинальных зарядов (+1 для Na и − 1 для Cl ) на ионах до небольших реальных значений вследствие сдвига электронной плотности в шести связях от аниона к катиону, так что реальный заряд атомов в соединении оказывается для Na равным +0,92 е.
Слайд 44Понижение номинальных зарядов атомов свидетельствует о том, что даже при
взаимодействии наиболее электроотрицательных и электроположительных элементов связь не является чисто
ионной.
В силу того, что ионная связь ненаправленна и ненасыщенна, для ионных кристаллов характерны большие координационные числа.
К ионным кристаллам относится большинство диэлектриков с высоким сопротивлением, их электропроводность на 20 порядков меньше, чем у металлов и осуществляется в основном ионами.
Большинство ионных кристаллов прозрачно в видимой области.
Слайд 45 При расчете энергии сцепления ионных кристаллов обычно исходят
из простых классических представлений, считая, что
ионы находятся в
узлах кристаллической решетки (положение равновесия),
их кинетическая энергия пренебрежимо мала
силы, действующие между ионами являются центральными
(для ионных кристаллов это вполне справедливо, т.к. потенциальная энергия взаимодействия между двумя ионами зависит только от расстояния между ними, причем сила направлена вдоль линии, соединяющей ионы).
Слайд 46 Выражение для энергии взаимодействия между двумя ионами i
и j, находящимися на расстоянии rij друг от друга, в
кристалле, образованном из ионов с зарядами Z1е и Z2е содержат два члена:
где первый член соответствует потенциалу сил притяжения при кулоновском взаимодействии, а второй − потенциалу сил отталкивания.
Полагая rij = rδij, где r = ra + rk − расстояние между ближайшими соседними ионами, и суммируя по всем ионам кристаллической решетки при j≠i, найдем энергию взаимодействия i-го иона со всеми другими ионами кристаллической решетки:
Слайд 47
Здесь
− структурные суммы.
Структурная сумма А получила
название постоянной Маделунга, она зависит от координационного числа и типа
кристаллической структуры.
Знаки плюс и минус, если i-ый ион заряжен отрицательно, относятся соответственно к положительным и отрицательным ионам.
При расчетах постоянной Маделунга надо иметь в виду, что поскольку А представляет собой условно сходящийся ряд, то его сумма зависит от порядка суммирования.
Слайд 48 Электропроводность ионных кристаллов значительно ниже, чем у металлов
и при комнатных температурах различие составляет по крайней мере 20
порядков.
Проводимость ионных кристаллов при повышении температуры возрастает, что указывает на то, что носители тока в них иные, нежели в металлах.
Электроны в заполненных оболочках обоих типов ионов столь сильно связаны, что не могут сколько-нибудь заметно перемещаться под действием внешнего поля.
Поэтому перемещение заряда в ионных кристаллах происходит за счет перемещения самих ионов, что, естественно, сопровождается переносом массы, т.е. пробоем.
Слайд 49Ионные кристаллы прозрачны для электромагнитного излучения почти всех частот вплоть
до некоторой граничной частоты, называемой основной или граничной частотой поглощения.
Для излучения более высоких частот они непрозрачны, т.к. энергия фотонов становится достаточно большой, чтобы возбудить электроны и перебросить их через запрещенную зону.
Есть тенденция представлять межионное расстояние r0 как сумму радиусов катиона и аниона.
Строгое решение задачи о радиусе иона если не невозможно, то крайне затруднительно, даже если речь идет об определении границы иона в кристалле.
Отсюда проистекают причины появления все новых и новых таблиц ионных радиусов, которые плодятся как кролики, но со значительно меньшей гастрономической пользой для прогрессивного (для непрогрессивного, впрочем, тоже) человечества.
Слайд 50 Со времен Магнуса (1925 г.) опубликованы таблицы кристаллохимических
ионых радиусов по Гольдшмидту (эмпирические), по Полингу (теоретические), по Захариасену
(эмпирико-теоретические) и множество других, связанных с менее известными фамилиями.
Следствием чего стал поражающий воображение факт − ионный радиус не является константой даже при стандартных p и v, а физический смысл этого понятия вообще спорен.
Исключений из правила Магнуса очень много (CsF, KF, LiBr, LiJ, AgF...).