Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Современные подходы к разработке клинических испытаний
Содержание
- 1. Современные подходы к разработке клинических испытаний
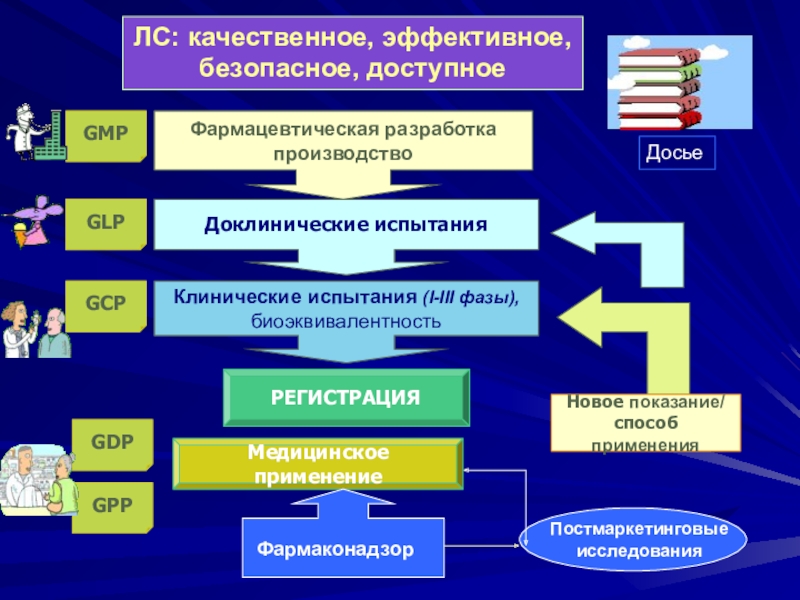
- 2. Фармацевтическая разработка производствоДоклинические испытанияКлинические испытания (I-III фазы), биоэквивалентностьРЕГИСТРАЦИЯНовое показание/способ примененияМедицинское применениеGMPGLPGCPЛС: качественное, эффективное, безопасное, доступноеGDPGPPФармаконадзорПостмаркетинговые исследованияДосье
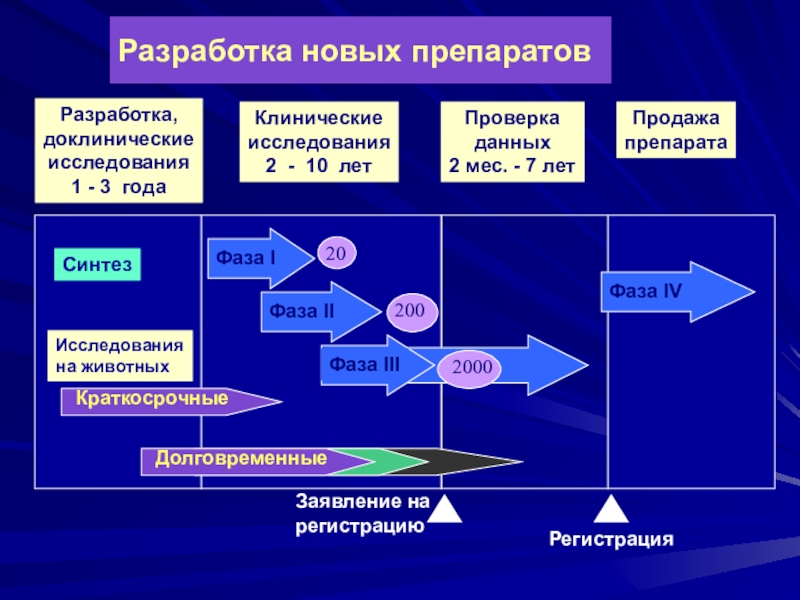
- 3. Разработка новых препаратов Пути открытия новых препаратовЛП из
- 4. Разработка новых препаратов202002000
- 5. Фазы клинического испытанияI:Первые КИ на здоровых добровольцахII
- 6. Доклинические исследованияДо изучения нового средства на людях,
- 7. Информация о результатах доклинических исследований нового ЛС Клинические
- 8. Цель: впервые изучить новое ЛС на людях
- 9. Факторы риска, которые необходимо учитывать при изучении
- 10. ЛС, содержащие моноклональные антитела биотехнологическое происхождение; иммуногенность; побочные реакции.Факторы риска:
- 11. II фаза КИ Главная цель доказательство наличия
- 12. Характеристика КИ ІІ фазыСравнительные КИЖесткие критерии включения
- 13. III фаза КИ Доказательство эффективности и безопасности
- 14. III ФАЗА КИ
- 15. Характеристика КИ ІІІ фазыКонтингент исследуемых - менее
- 16. IV фаза КИ После регистрации препаратаДополнительная информация
- 17. IV ФАЗА КИ
- 18. Технологии проведения КИ ПроспективныеОткрытые, слепые (простое, двойное,
- 19. Технологии проведения КИ ДизайныИсследования в одной
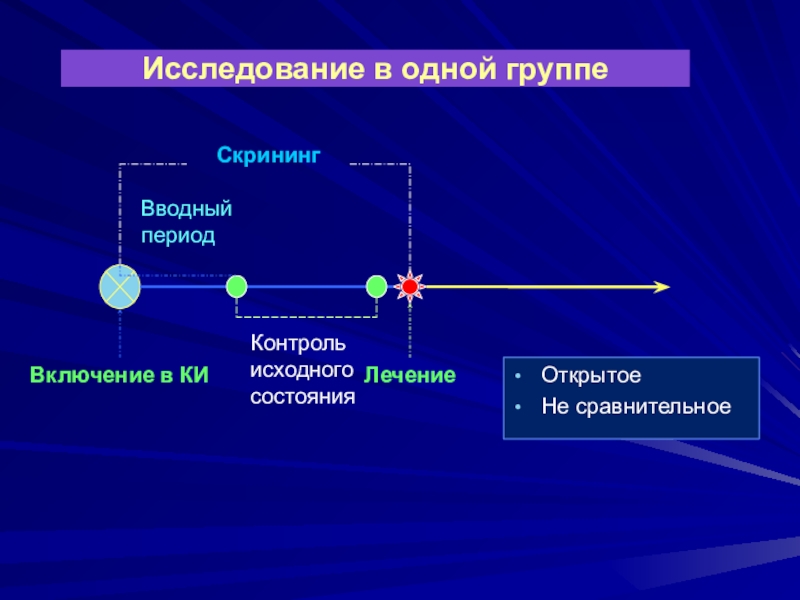
- 20. Исследование в одной группеОткрытоеНе сравнительноеСкринингВключение в КИЛечение Контроль исходного состоянияВводный период
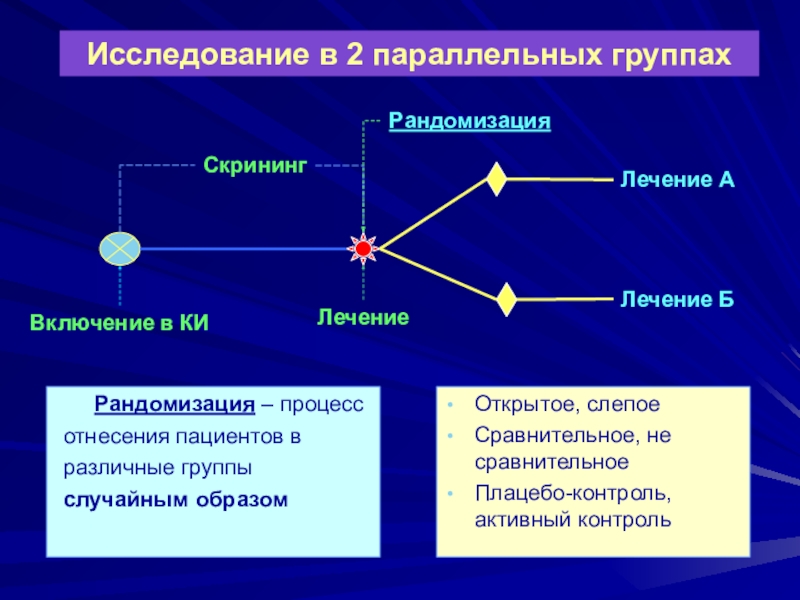
- 21. Исследование в 2 параллельных группахОткрытое, слепоеСравнительное, не
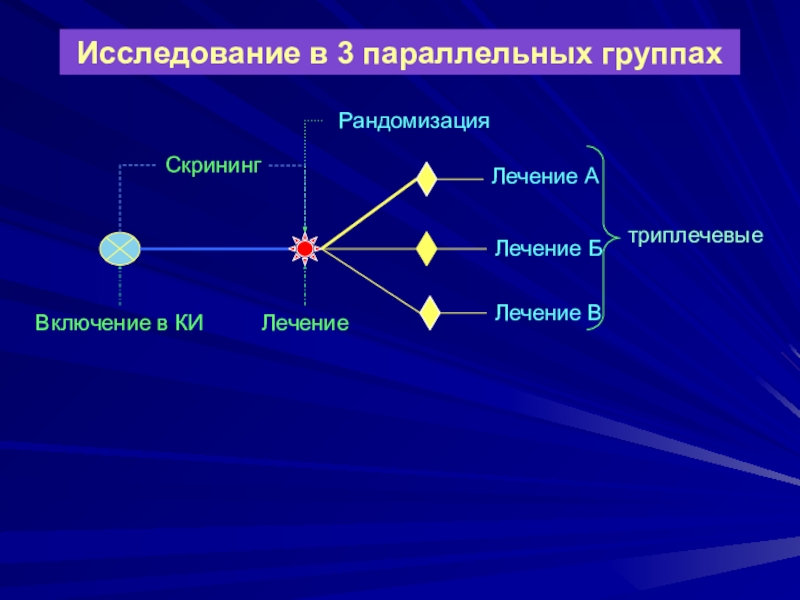
- 22. Исследование в 3 параллельных группахВключение в КИЛечение Лечение АЛечение ВСкринингРандомизацияЛечение Бтриплечевые
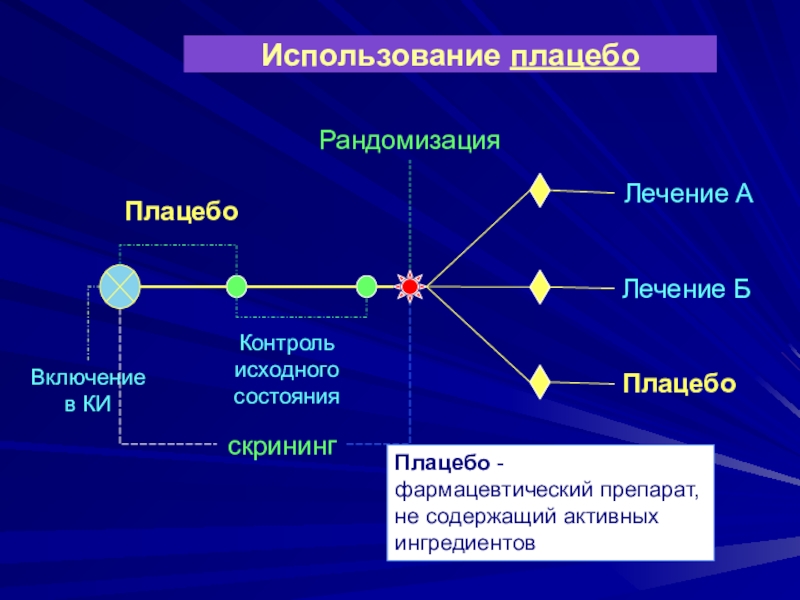
- 23. Использование плацебоскринингВключение в КИПлацебоКонтроль исходного состоянияРандомизация Лечение АПлацебоЛечение БПлацебо - фармацевтический препарат, не содержащий активных ингредиентов
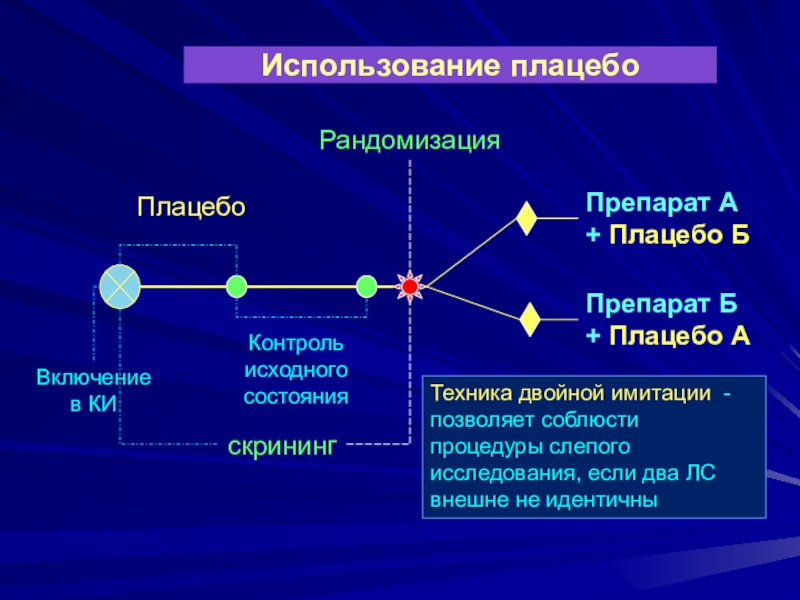
- 24. Использование плацебоскринингВключение в КИПлацебоКонтроль исходного состоянияРандомизация Препарат
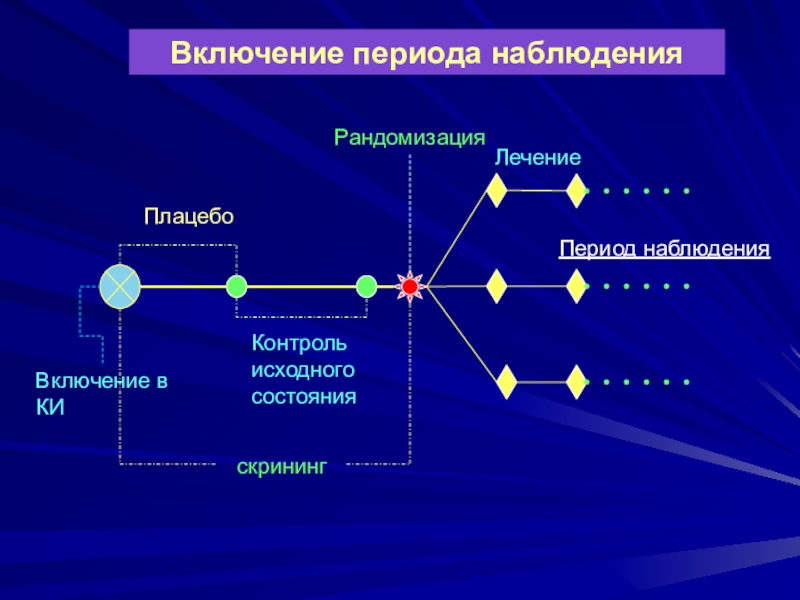
- 25. Включение периода наблюденияскринингВключение в КИПлацебоКонтроль исходного состоянияРандомизация Период наблюденияЛечение
- 26. Исследования доза - эффектскринингВключение в КИПлацебоКонтроль исходного состоянияРандомизация Плацебо (доза 0 А)Доза 2 АДоза 1 А
- 27. Дизайн исследования – факторный ИЛС (А) используется
- 28. скринингДоза 1 АДоза 2 БДоза 1 БДоза
- 29. Перекрестный дизайнРандомизацияОтмывочный периодДля учета вариабельности ответа на ЛС внутри популяции пациентовБААБ
- 30. Референтный препаратИнновационный препарат (на основе полного досье:
- 31. Дизайн исследования зависит от фазы клинической разработки
- 32. - клиническое испытание, проводимое по единому протоколу
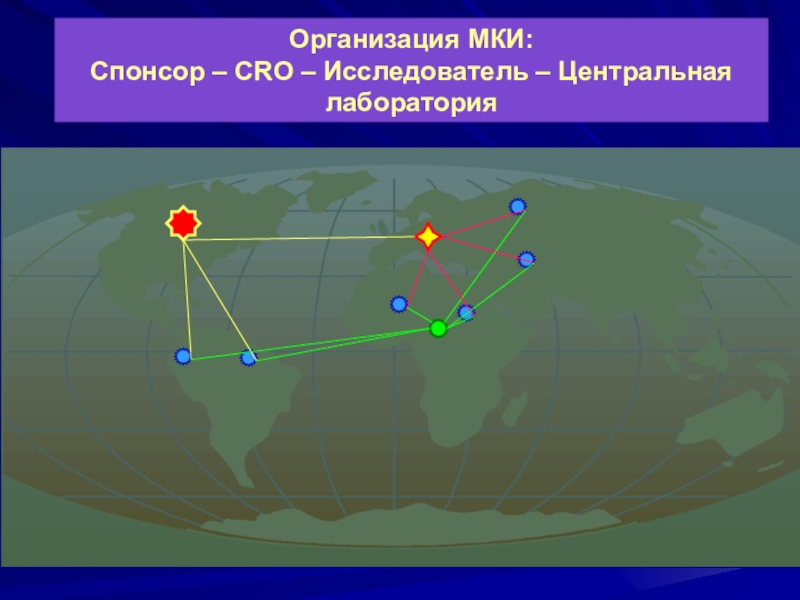
- 33. Организация МКИ: Спонсор – CRO – Исследователь – Центральная лаборатория
- 34. Контроль за безопасностью ЛС проводиться в течение
- 35. Дорогу осилит идущий
- 36. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Фармацевтическая разработка
производство
Доклинические испытания
Клинические испытания (I-III фазы),
биоэквивалентность
РЕГИСТРАЦИЯ
Новое показание/
способ применения
Медицинское
применение
Слайд 3Разработка новых препаратов
Пути открытия новых препаратов
ЛП из растительных источников
ЛП
химического происхождения
ЛП из эндогенных веществ животного происхождения
Метаболиты существующих препаратов
«Случайные» открытия
Эмпирическая
химия, объединенная с прикладной фармакологиейРациональное построение молекулы
Слайд 5Фазы клинического испытания
I:
Первые КИ на здоровых добровольцах
II а:
Первые на пациентах
II
b:
Базовые
III:
Оценка эффективности и безопасности
IV:
Стратегия применения ЛС
Безопасность
200
2000
20
Доказывающие КИ
Подтверждающие КИ
Слайд 6Доклинические исследования
До изучения нового средства на людях, необходимо провести химические,
фармацевтические исследования, испытания на животных
Экспериментальная фармакология
Фармакокинетика
Фармакодинамика (характер, выраженность и
продолжительность)Токсичность ЛС (острая и хроническая, специфическая -репродуктивная, мутагенная, тератогенная, канцерогенная, влияние на иммунитет, эмбриотоксичность, аллергическая)
Специфическая активность
Побочные эффекты (частота и степень тяжести)
Слайд 7Информация о результатах доклинических исследований нового ЛС
Клинические исследования разрешаются
Фармакокинетика
Фармакодинамика
(характер, выраженность и продолжительность)
Токсичность ЛС (острая и хроническая)
Побочные эффекты (частота
и степень тяжести)Слайд 8Цель: впервые изучить новое ЛС на людях 20-80 здоровых
добровольцев, 6 месяцев - 1 год
Изучение однократной дозы:
переносимость,
фармакокинетические
параметры,фармакодинамические эффекты
Изучение многократного введения дозы:
курсовое введение фиксированной дозы,
эскалация доз
Определяют:
максимально переносимую дозу,
дозозависимый эффект
дозу для последующего изучения
Возможность дальнейшей разработки препарата
I ФАЗА КИ
Слайд 9Факторы риска, которые необходимо учитывать при изучении новых ЛС:
тип
лекарственного средства (новизна активной субстанции, структура, биологическая активность, механизм
действия);способ и скорость введения лекарственного средства;
исследуемая популяция (здоровые добровольцы или пациенты);
выбор первой дозы (использование подхода минимального уровня предполагаемого биологического эффекта (MABEL));
определение последующих уровней доз (включает оценку возможных фармакодинамических и побочных эффектов);
четкие критерии исключения из исследования;
место проведения клинических испытаний (соответствующее оборудование, квалифицированный персонал, оказание неотложной медицинской помощи, контроль за безопасностью испытуемых)
Руководство по требованиям к КИ, которые проводятся впервые с участием человека для лекарственных средств с потенциально высоким риском (ЕМЕА/СНМР/28367/2007)
Слайд 10ЛС, содержащие моноклональные антитела
биотехнологическое происхождение;
иммуногенность;
побочные реакции.
Факторы риска:
Слайд 11II фаза КИ
Главная цель
доказательство наличия терапевтического эффекта
подбор эффективной дозы
подбор кратности приема
Безопасность и переносимость (оценка
безопасности на небольших группах пациентов с конкретным заболеванием)Первые контролируемые исследования с участием пациентов (200-600 пациентов, длительность до 2 лет)
Фаза А - пилотное
оценка безопасности на небольших группах пациентов с конкретным заболеванием
Фаза Б - базовое
оценка эффективности и безопасности, оптимального уровня дозирования
Слайд 12Характеристика КИ ІІ фазы
Сравнительные КИ
Жесткие критерии включения
Контроль:
- плацебо
-
препарат аналогичного действия,
- разные дозы изучаемого ЛС
- стандартное лечение
Слепые КИ
Рандомизированные
Слайд 13III фаза КИ
Доказательство эффективности и безопасности
Демонстрация терапевтического
преимущества
Определение любых взаимодействий с препаратами
Многоцентровые большие исследования у
различных популяций больныхОценить ЛС в условиях максимально приближенных к практическому применению (тысячи пациентов, более 3 лет)
Слайд 14III ФАЗА КИ Оценить ЛС в условиях максимально приближенных
к практическому применению
Главная задача:
подтвердить эффективность и безопасность ЛС
на большом контингенте пациентовтысячи пациентов, 3 года
Сравнительные без сравнения
Слепые открытые КИ
Рандомизация, стратификация
Длительные исследования
Слайд 15Характеристика КИ
ІІІ фазы
Контингент исследуемых
- менее жесткие условия включения в
КИ,
- разные группы пациентов
Оцениваются
- редкие побочные реакции,
- безопасность при длительном
применении,- взаимодействие лекарств,
- оценка качества жизни, экономическая оценка методов лечения (фармакоэкономика)
Слайд 16IV фаза КИ
После регистрации препарата
Дополнительная информация об эффективности
различные
лекарственные формы
лекарственные взаимодействия / взаимодействие с пищей
новые группы
пациентов (возраст, раса …)Сравнение с другими стандартными курсами лечения
Обнаружение и определение ранее неизвестных
нежелательных реакций и факторов риска
Влияние на выживаемость
Получить более подробную информацию о безопасности и эффективности препарата
Слайд 17IV ФАЗА КИ Получить более подробную информацию об эффективности и
безопасности препарата
Усовершенствование применения ЛП
Взаимодействие с пищей и другими ЛП
Сравнение
с другими стандартными схемами леченияПрименение ЛС в других возрастных группах или категориях пациентов
Влияние на выживаемость
Слайд 18Технологии проведения КИ
Проспективные
Открытые, слепые (простое, двойное, тройное)
Рандомизированные, стратифицированные
Сравнительные
(лечения эквивалентны, не хуже, лучше), не сравнительные (изучение исходов)
Контроль: плацебо,
активный контрольСлайд 19Технологии проведения КИ
Дизайны
Исследования в одной группе
Исследования в параллельных группах
Перекрестная
модель
Другие методы: факторный, латинских квадратов, «игра на лидера», «связанных пар»
и пр.Слайд 20Исследование в одной группе
Открытое
Не сравнительное
Скрининг
Включение в КИ
Лечение
Контроль исходного состояния
Вводный
период
Слайд 21Исследование в 2 параллельных группах
Открытое, слепое
Сравнительное, не сравнительное
Плацебо-контроль, активный контроль
Рандомизация
– процесс отнесения пациентов в различные группы случайным образом
Включение в
КИЛечение
Лечение А
Лечение Б
Скрининг
Рандомизация
Слайд 22Исследование в 3 параллельных группах
Включение в КИ
Лечение
Лечение А
Лечение В
Скрининг
Рандомизация
Лечение
Б
триплечевые
Слайд 23Использование плацебо
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Лечение А
Плацебо
Лечение Б
Плацебо -
фармацевтический препарат, не содержащий активных ингредиентов
Слайд 24Использование плацебо
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Препарат А + Плацебо
Б
Препарат Б + Плацебо А
Техника двойной имитации - позволяет соблюсти
процедуры слепого исследования, если два ЛС внешне не идентичныСлайд 25Включение периода наблюдения
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Период наблюдения
Лечение
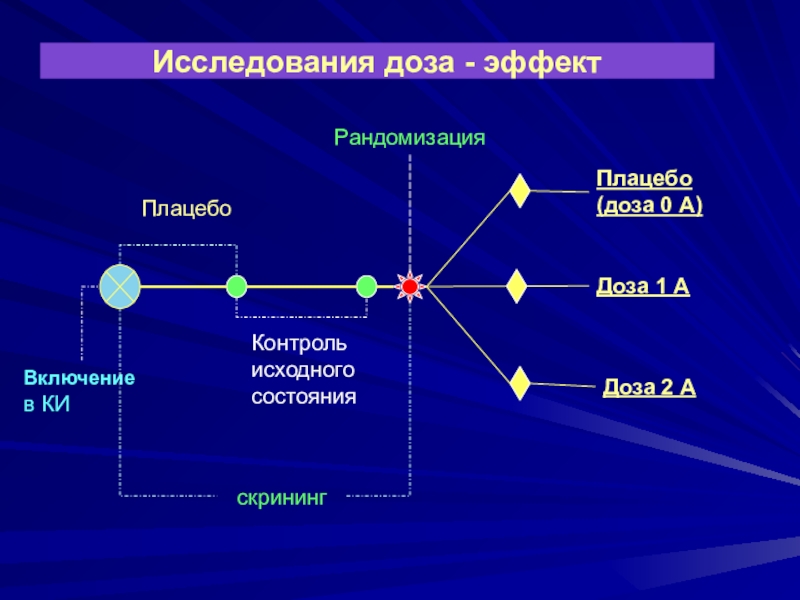
Слайд 26Исследования доза - эффект
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Плацебо (доза
0 А)
Доза 2 А
Доза 1 А
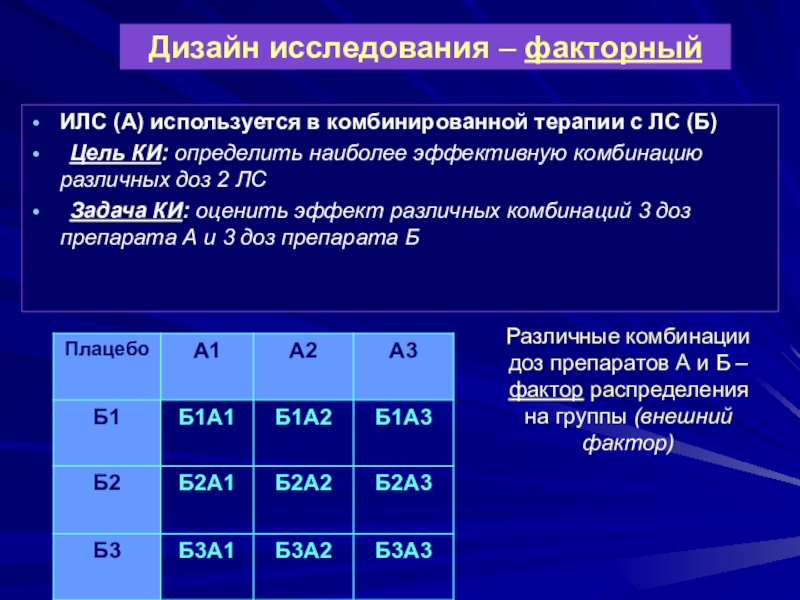
Слайд 27Дизайн исследования – факторный
ИЛС (А) используется в комбинированной терапии
с ЛС (Б)
Цель КИ: определить наиболее эффективную комбинацию различных доз
2 ЛСЗадача КИ: оценить эффект различных комбинаций 3 доз препарата А и 3 доз препарата Б
Различные комбинации доз препаратов А и Б – фактор распределения на группы (внешний фактор)
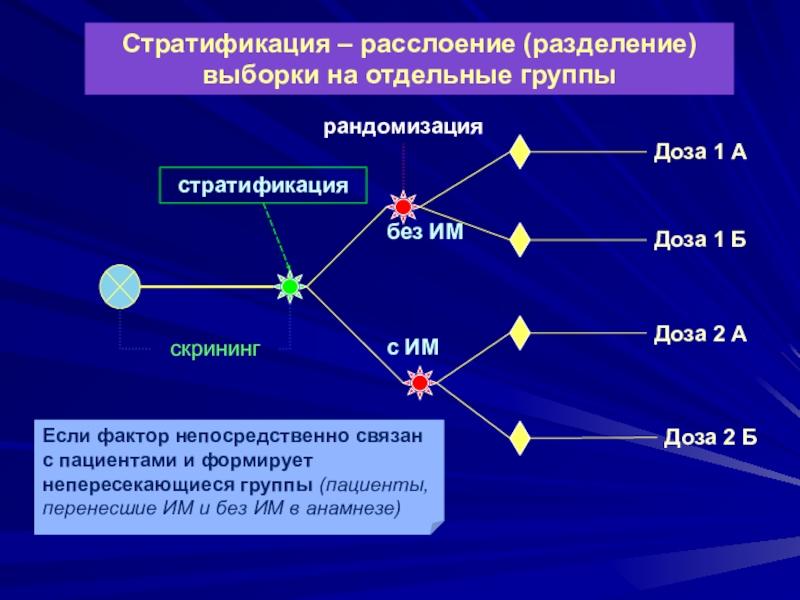
Слайд 28скрининг
Доза 1 А
Доза 2 Б
Доза 1 Б
Доза 2 А
рандомизация
стратификация
без ИМ
с
ИМ
Если фактор непосредственно связан с пациентами и формирует непересекающиеся группы
(пациенты, перенесшие ИМ и без ИМ в анамнезе)Стратификация – расслоение (разделение) выборки на отдельные группы
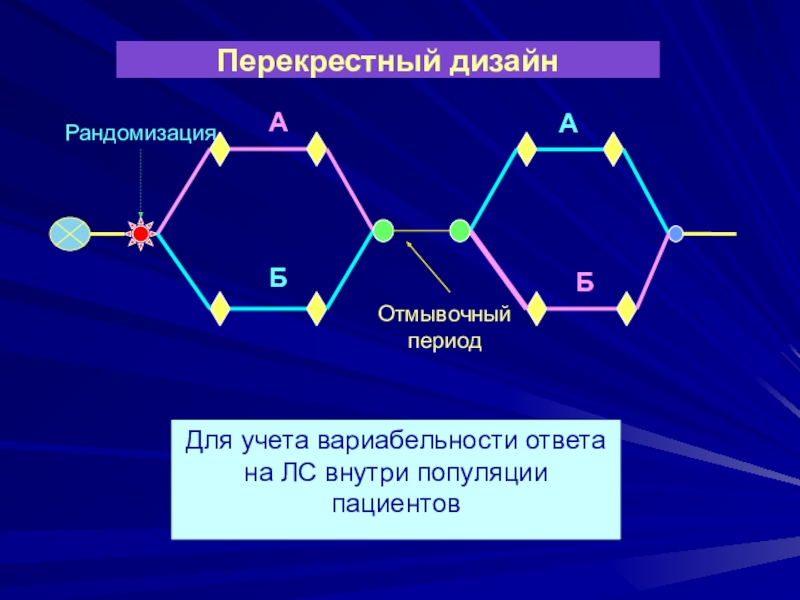
Слайд 29Перекрестный дизайн
Рандомизация
Отмывочный период
Для учета вариабельности ответа на ЛС внутри популяции
пациентов
Б
А
А
Б
Слайд 30Референтный препарат
Инновационный препарат (на основе полного досье: данные химического, биологического,
фармацевтического, фармакологического, токсикологического и клинического изучения)
Если получить инновационный препарат не
представляется возможным, можно использовать препарат, лидирующий на рынке по объемам продаж, при условии его установленной эффективности, безопасности и качестваВ случае, когда вышеперечисленное невозможно, национальный регуляторный орган может определить препарат, находящийся на рынке другой страны при условии его установленной эффективности, безопасности и качества, и/или который выбран регуляторным органом другого государства
Слайд 31 Дизайн исследования зависит от фазы клинической разработки ЛП и задач,
стоящих перед конкретным испытанием
Включение пациента в исследование
Скрининг
- Подготовительный (вводный) период
-
Оценка исходного состоянияОтмывочный период
Период лечения
Период последующего наблюдения
Этапы исследования
Слайд 32 - клиническое испытание, проводимое по единому протоколу более чем в
одном исследовательском центре и, следовательно, более чем одним исследователем
GCP
Технологии проведения КИ
Многоцентровые клинические испытания -
Слайд 34Контроль за безопасностью ЛС проводиться в течение всего
“жизненного цикла”
Процесс
разработки может быть длительным и не всегда заканчивается после регистрации
ЛСЗарегистрированное ЛС может опять изучаться в КИ и тогда РSUR и периодический отчет по безопасности при КИ могут разрабатываться одновременно
Выявленные проблемы безопасности зарегистрированного ЛС требуют повторной оценки данных КИ, а порой и новых доклинических и клинических испытаний