Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
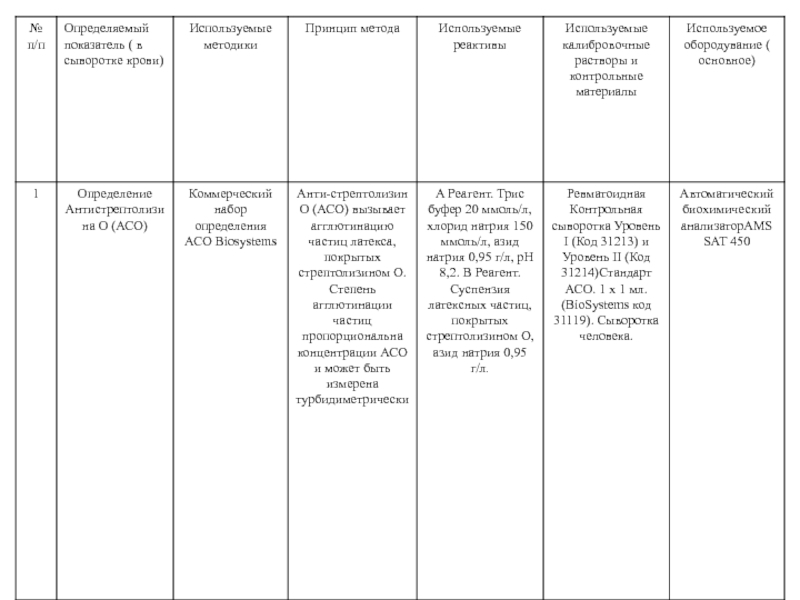
Современные требования к компетентности и качеству клинико
Содержание
- 1. Современные требования к компетентности и качеству клинико
- 2. …Главный вопрос, который требуетбезотлагательного решения как смедицинских,
- 3. Слайд 3
- 4. 3.1.1 качество ( quality): степеньсоответствия совокупности присущиххарактеристик
- 5. Эта задача может быть выполнена, еслимедицинская лаборатория
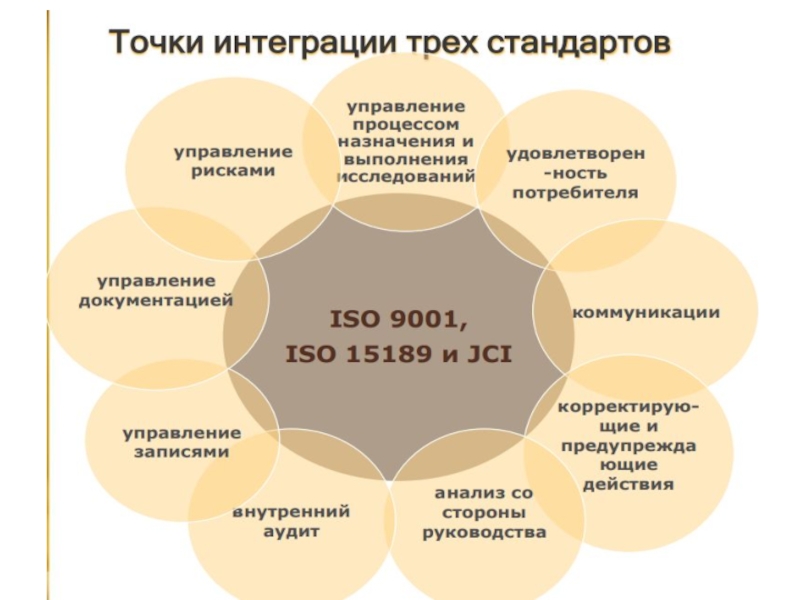
- 6. Основной документ, регламентирующий работу медицинских лабораторий:ISO 15189
- 7. Требования ИСО 15189 (Медицинские лаборатории. Требования к
- 8. В целом, качество и компетентностьмедицинской лаборатории определяются:•
- 9. Слайд 9
- 10. Слайд 10
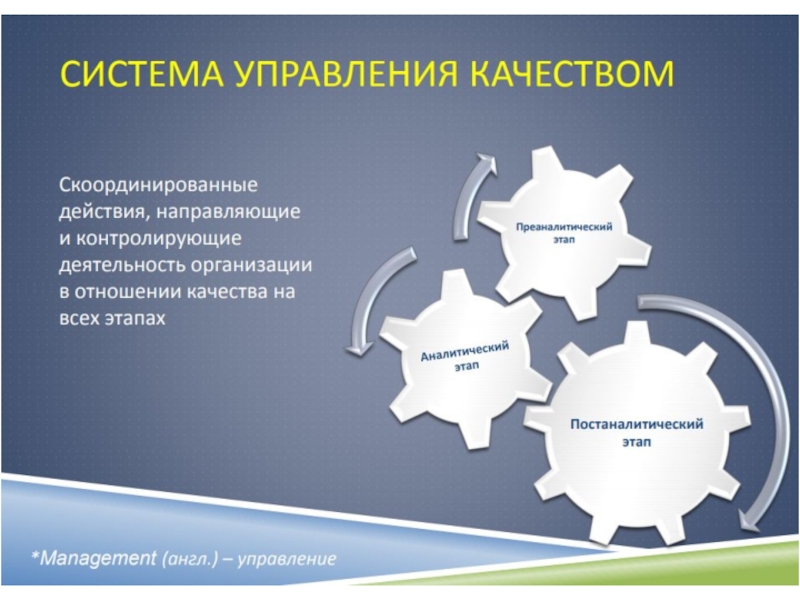
- 11. Система менеджмента качестваВсе аспекты деятельности лаборатории должны
- 12. Система качества лаборатории 1 Оптимизация организации работы
- 13. 7 Менеджмент несоответствующих событий 8 Оценивание работы
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Документацияидокументирование
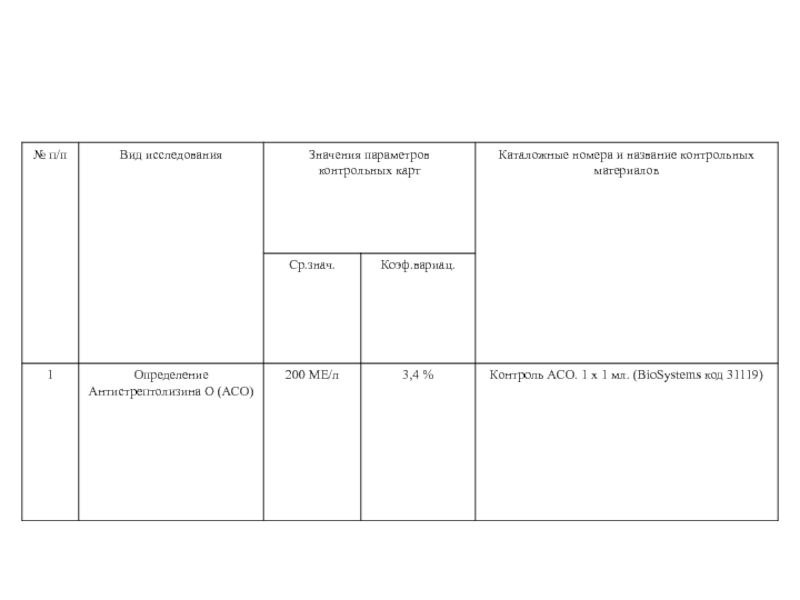
- 28. Регламентирующая и учетная документация.Система документации лаборатории состоит
- 29. Управление документамиОсновная цель управления документацией – обеспечение
- 30. Управление документациейУстановлены процедуры управлениядокументациейИмеется журнал регистрации документовВсе
- 31. Паспорт Клинико – Диагностической лабораторииПеречень выполняемых исследованийПеречень
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Основа планирования и организацииработы- стандартные операционныепроцедуры (СОП)СОП
- 37. Разрабатываемые в лаборатории СОП должны охватывать все
- 38. процедуры управление данными; меры предосторожности и меры
- 39. Стандартная операционная процедура (СОП)
- 40. СОП составляются непосредственно в лаборатории для каждого
- 41. С целью описания алгоритма действий, регламентации процесса
- 42. Национальные стандарты – для регламентации организации всего
- 43. Стандартизованные или гармонизированные аналитические технологии, представленные в
- 44. Нормативные документы РФ используемые для составления СОП
- 45. Минимальный перечень СОП преаналитического этапа, утвержденный руководителем
- 46. заполнение бланка-запроса на лабораторное исследование лечащим
- 47. Минимальный перечень СОП преаналитического этапа, утверждаемый заведующим
- 48. Минимальный перечень СОП аналитического этапа, утверждаемый руководителем
- 49. правила оценки данных, полученных в ходе внутреннего
- 50. правила работы с информационными системами лаборатории;организация межлабораторных
- 51. правила расчета неопределенности;правила расчета общей ошибки;правила гармонизации
- 52. Важность внедрения СОП:Возможность обеспечить единообразие, согласованность и
- 53. Хорошая СОПдает детальные, ясные и полные инструкции
- 54. Требования к технической компетентности медицинских лабораторий
- 55. ISO 15189 устанавливает требования к технической компетентности
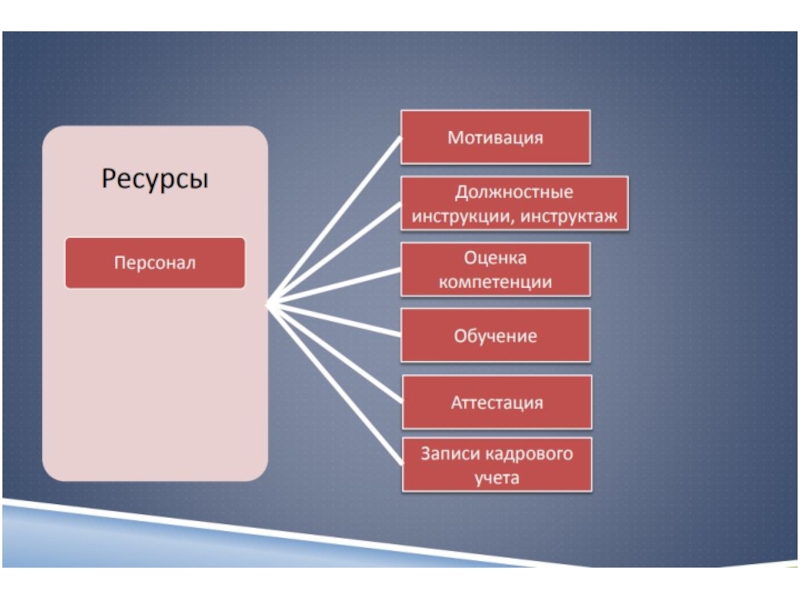
- 56. Лаборатория должна обеспечить подготовку персонала по следующим
- 57. Оценивание технической компетентностиперсонала должна осуществляться (5.1.6):прямым наблюдением
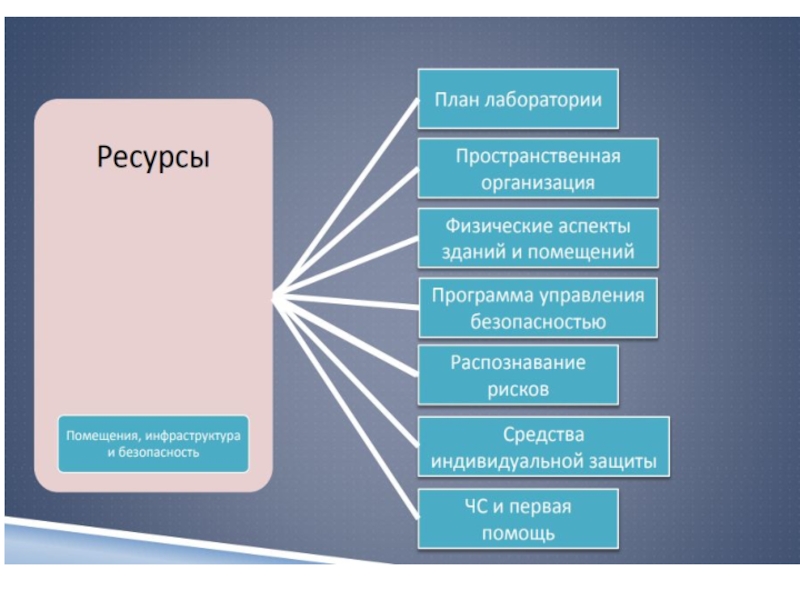
- 58. Помещения и условия работы (5.2) Лаборатория должна
- 59. Лаборатории должны использоватьтолько валидированые иливерифицированные методики (5.5.1)
- 60. Обеспечение качества результатовисследования (5.6) Лаборатория должна разработать
- 61. Лаборатория должна обязательно участвоватьв программе ( программах
- 62. Слайд 62
- 63. Спасибо за Внимание!
- 64. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2…Главный вопрос, который требует
безотлагательного решения как с
медицинских, так и с
экономических
Слайд 43.1.1 качество ( quality): степень
соответствия совокупности присущих
характеристик требованиям
ISO 9000:2007
Обеспечение пациента
и/или врача,
который его обслуживает, результатами
клинических лабораторных
исследований которые соответствуют
установленным требованиям
Слайд 5Эта задача может быть выполнена, если
медицинская лаборатория отвечает
требованиям качества и
компетентности
• Требования к качеству лабораторных исследований:
диагностическая значимость, аналитическая правильность достоверность
и сопоставимость, своевременность, правильная трактовка• Для достижения качества лаборатория должна быть
компетентной - способной продемонстрировать
применение соответствующих знаний, умений и навыков на практике.
Слайд 6Основной документ, регламентирующий работу медицинских лабораторий:
ISO 15189 : 2012 (Е)
Медицинские
лаборатории. Требования к компетентности и качеству
25 пунктов требований
Слайд 7Требования ИСО 15189
(Медицинские лаборатории. Требования к компетентности и качеству)
4 Требования
к менеджменту
4.1 Организация и ответственность
менеджмента
4.2 Система менеджмента качества
4.3 Управление документацией
4.4
Договоры о предоставлении услуг4.5 Исследования, проводимые
привлеченными лабораториями
4.6 Внешние услуги и поставки
4.7 Консультативные услуги
4.8 Жалобы и претензии
4.9 Управление несоответствиями
4.10 Корректирующие действия
4.11 Предупредительные меры
4.12 Постоянное улучшение
4.13 Управление записями
4.14 Оценка и аудит
4.15 Анализ со стороны руководства
5 Технические требования
5.1 Персонал
5.2 Помещения и условия труда
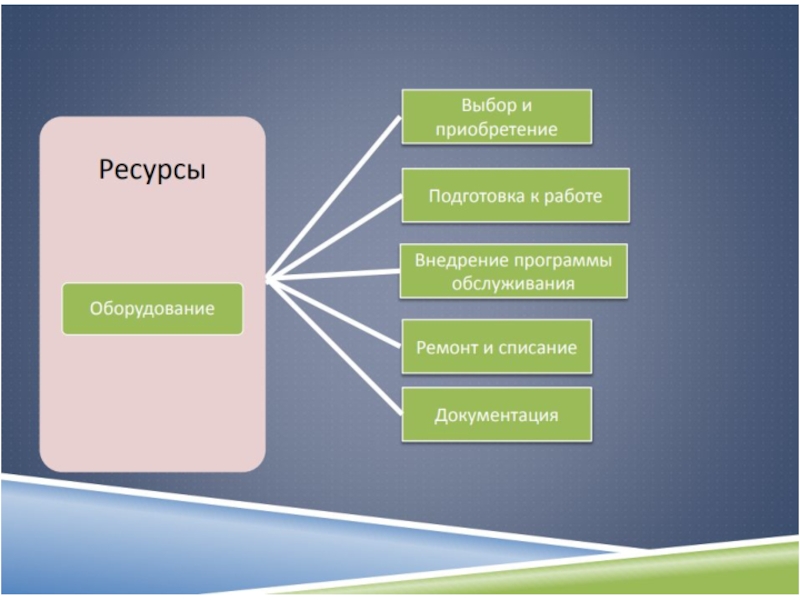
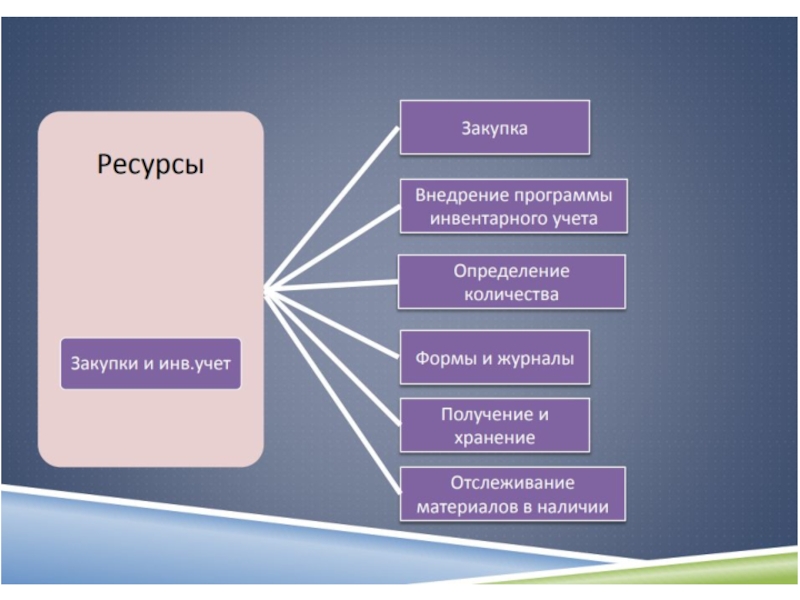
5.3 Лабораторное оборудование , реагенты и расходные материалы
5.4 Преаналитический процесс
5.5Аналитический процесс
5.6 Обеспечение качества результатов
исследования
5.7 Постаналитический процесс
5.8 Отчет о результатах
5.9 Предоставление результатов
5.10Управление информацией лаборатории
Слайд 8В целом, качество и компетентность
медицинской лаборатории определяются:
• - организационной компетентностью,
внедрением
системы менеджмента
качества - СМК (ISO 9000)
• - технической компетентностью (ISO
17025)
•
- профессиональной (медицинской)компетентностью (+ISO 15189)
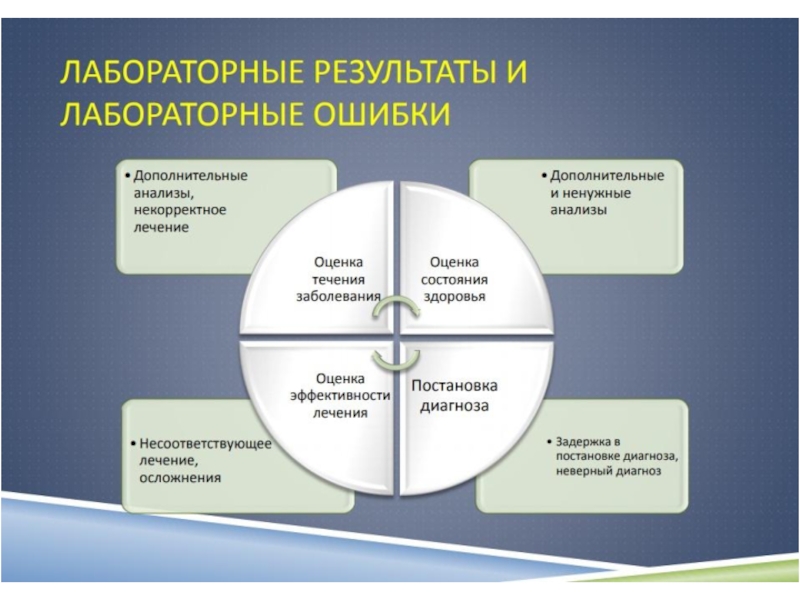
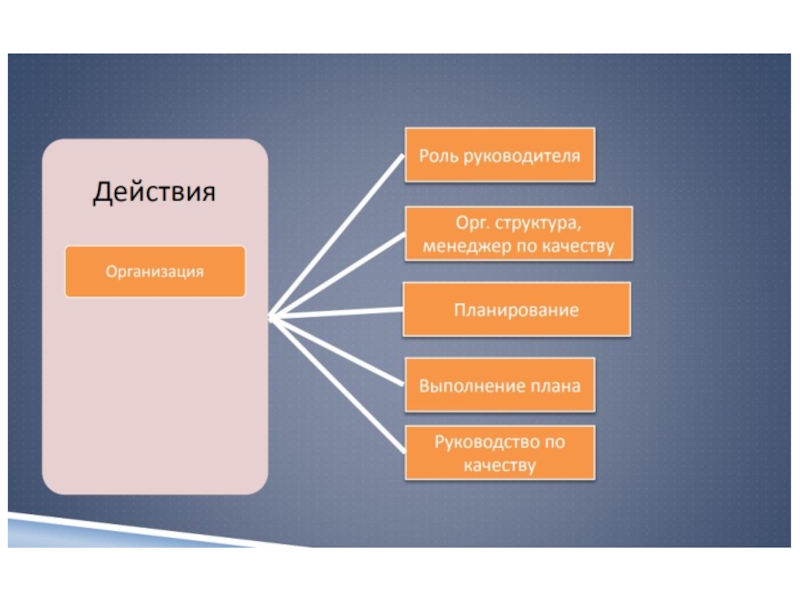
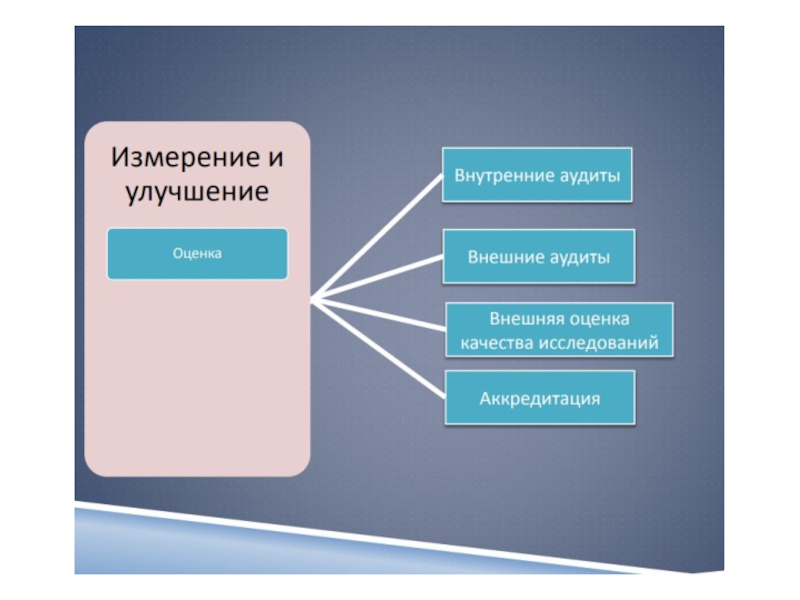
Слайд 11Система менеджмента качества
Все аспекты деятельности лаборатории должны быть рассмотрены с
точки зрения
организации достижения, поддержания и улучшения качества;
это и составляет
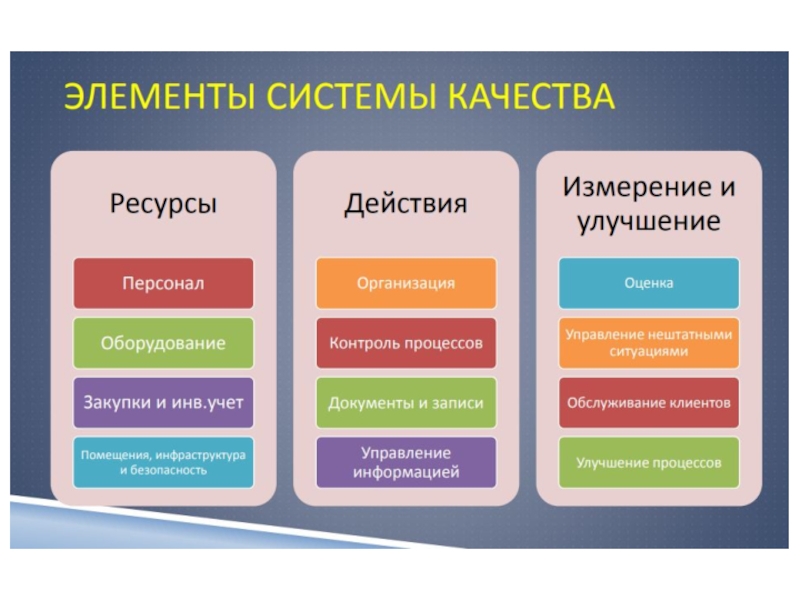
систему менеджмента качества.Слайд 12Система качества
лаборатории
1 Оптимизация организации работы
2 Персонал лаборатории
3
Регламентирующая и учетная документация.
4 Оборудование
5 Приобретение и управление
расходными материалами6 Контроль процессов
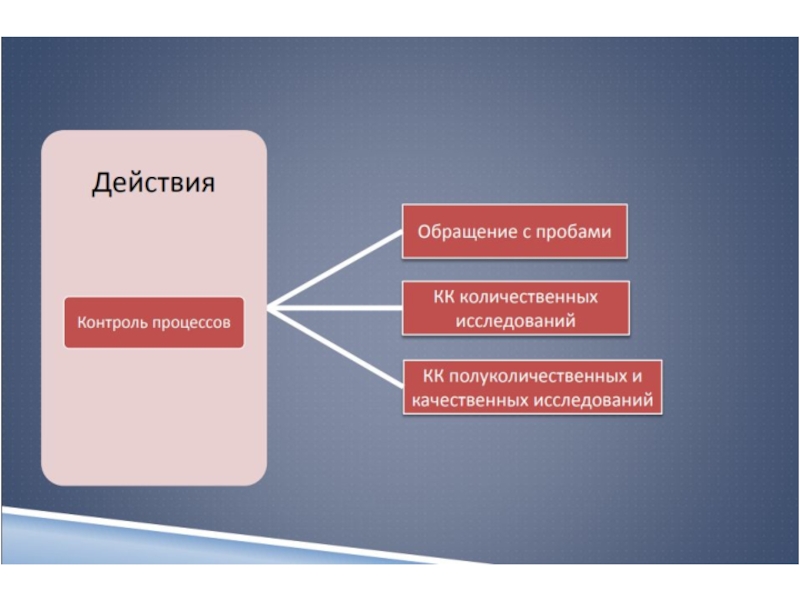
Слайд 137 Менеджмент несоответствующих событий
8 Оценивание работы лаборатории
9 Управление
информационными потоками
10 Обслуживание клиентов и их
удовлетворенность
11 Постоянное улучшение
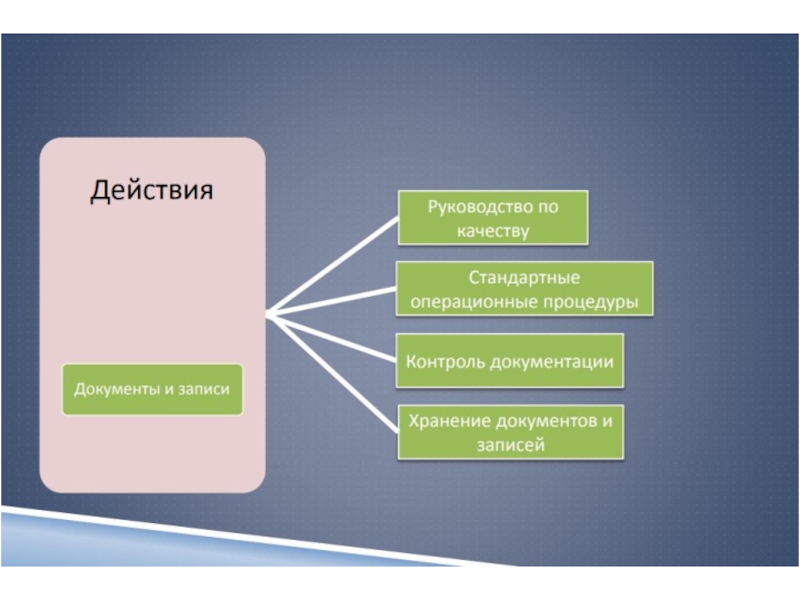
12 Технические средства и безопасностьСлайд 28Регламентирующая и
учетная документация.
Система документации лаборатории состоит из
регламентирующих документов, которые
содержат описания
всех типов работ и процессов,
которые выполняются в лаборатории (Руководство по
качеству,
правила, инструкции, методики выполненияисследований, стандартные операционные процедуры)
и учетной документации (записи), в которой
регистрируются результаты выполнения процессов и
процедур (журналы, протоколы, записи, контрольные
карты, отчеты, результаты внешней оценки качества и
т.п.).
Слайд 29Управление документами
Основная цель управления документацией – обеспечение того, что находящиеся
в обращении документы «правильные» и применяются, как следует, т. е.
все необходимые для работы документы (как правило, их последние версии) имеются в наличии и доступны.Слайд 30Управление документацией
Установлены процедуры управления
документацией
Имеется журнал регистрации документов
Все документы проверены и
утверждены
Периодически пересматриваются , вносятся
изменения и утверждаются
Изымаются устаревшие документы
Документы
доступны персоналуСлайд 31Паспорт Клинико – Диагностической лаборатории
Перечень выполняемых исследований
Перечень основного оборудования (средства
измерения)
Перечень вспомогательного оборудования
Имеющиеся стандартные контрольные материалы
Штатное обеспечение и кадровый состав
Характеристика
помещенийСлайд 36Основа планирования и организации
работы- стандартные операционные
процедуры (СОП)
СОП - документально оформленные
инструкции по выполнению отдельных производственных процедур, максимально детализированные и изложены
в той последовательности, в которой эти процедуры должны выполняться.Слайд 37Разрабатываемые в лаборатории СОП должны охватывать все виды деятельности и
процессы, выполняемые в лаборатории
персонал лаборатории, его квалификация, обучение, оценка;
техническое
обслуживание лабораторий, включая рабочее место, освещение, вентиляцию, регулировку температуры, борьбу с шумом;процедуры очистки, стерилизации и дезинфекции;
уход за оборудованием и приборами и их эксплуатация,
калибровку, проверку и техническое обслуживание приборов и оборудования;
процедуры отбора, транспортировки и хранения образцов;
детальное описание процедур выполнения измерений и исследований;
Слайд 38процедуры управление данными;
меры предосторожности и меры безопасности;
обработку и удаление
отходов, включая биоотходы;
процедуры внутреннего контроля качества включая и корректирующие процедуры;
порядок представление результатов;процедуры внутреннего аудита;
участие во внешних программах оценки качества
Слайд 39Стандартная операционная процедура (СОП)
Соблюдение и документирование
правил проведения клинических лабораторных исследований в лаборатории осуществляется путем разработки
стандартных операционных процедур (СОП), которые используются для обеспечения четкой и рациональной организации действий каждого сотрудника лаборатории при выполнении каждого этапа и каждой пробоподготовительной и аналитической процедуры и представляют собой подробные описания условий, средств и порядка выполнения отдельной процедуры, процесса лабораторного исследования.Слайд 40СОП составляются непосредственно в лаборатории для каждого рабочего места и
для каждой целенаправленной группы действий оператора на всех этапах процесса
лабораторного исследования и должны содержать информацию о том:кто участвует в реализации и выполняет требования СОП;
как реализуется СОП в виде описания действий оператора;
что и какие ресурсы необходимы для реализации СОП;
когда, на каком этапе технологии производить процедуру и в какой временной промежуток.
Слайд 41С целью описания алгоритма действий, регламентации процесса лабораторного исследования, его
этапов и стандартных операционных процедур в соответствии с клиническими рекомендациями
по лабораторной диагностике используются:Слайд 42Национальные стандарты – для регламентации организации всего процесса лабораторного исследования
и отдельных его этапов, требо-
ваний к компетентности лабораторного персонала и
качеству исследований; к безопасности условий работы лаборатории;
к характеристикам средств лабораторного анализа;
Слайд 43Стандартизованные или гармонизированные аналитические технологии, представленные в виде клинических рекомендаций
проведения клинических лабораторных исследований – для регламентации рабочих процессов в
лаборатории, для выбора оборудования иреагентов с соответствующими функциональными характеристиками, для обеспечения надежности и сопоставимости результатов исследований.
Слайд 44Нормативные документы РФ используемые для составления СОП в КДЛ
СанПиН 2.1.3.2630-10,
СанПин 1.3.2322-08,
СанПиН 2.1.7.2790-10,
СанПин 3.1.5.2826-10
Приказ МЗ РФ 7 .02. 2000 г.
N 45 О СИСТЕМЕ МЕР ПО ПОВЫШЕНИЮ КАЧЕСТВАКЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ Приказ МЗ РФ от 26.05.2003 г. N 220 ПРАВИЛА ПРОВЕДЕНИЯ ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ КАЧЕСТВА КОЛИЧЕСТВЕННЫХ МЕТОДОВ КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
ПРИКАЗ МЗ РФ 21 .02.2000 г. N 64 ОБ УТВЕРЖДЕНИИ НОМЕНКЛАТУРЫ КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Приказ МЗ РФ N 380 25 .12.1997 г. О СОСТОЯНИИ И МЕРАХ ПО СОВЕРШЕНСТВОВАНИЮ ЛАБОРАТОРНОГО ОБЕСПЕЧЕНИЯ
ДИАГНОСТИКИ И ЛЕЧЕНИЯ ПАЦИЕНТОВ
Слайд 45Минимальный перечень СОП преаналитического этапа, утвержденный руководителем медицинской организации, после
их представления руководителем Лаборатории и согласования с заведующими других структурных
подразделений:Слайд 46 заполнение бланка-запроса на лабораторное исследование лечащим врачом;
первичная регистрация
пациента;
контроль соблюдения пациентом правил подготовки к сдаче биологического материала;
взятие биологического материала (по видам исследований и типам биологического материала);правила первичной маркировки биологического материала;
заполнение сопроводительной документации;
первичная обработка данных о пациенте и внесение данных в ЛИС;
правила транспортировки биологического материала.
Слайд 47Минимальный перечень СОП преаналитического этапа, утверждаемый заведующим лаборатории:
прием, регистрация и
оценка качества биоматериала лабораторией;
правила маркировки биоматериала;
внесение данных о пациенте и
биоматериале в ЛИС;действия сотрудников при обнаружении брака биоматериала;
действия сотрудников при необходимости использовать одну пробирку с биоматериалом для нескольких видов исследований;
пробоподготовка и оценка качества биоматериала (по видам исследований и типам биоматериала).
Слайд 48Минимальный перечень СОП аналитического этапа, утверждаемый руководителем лаборатории:
СОП по всем
«ручным методам» и методам, где используется много «ручного труда» и/или
работы экспертов, в том числе микроскопия;СОП по аналитическим методам, в которых применяются стандартные инструкции производителя;
правила проведения внутреннего контроля качества (по видам исследований);
Слайд 49правила оценки данных, полученных в ходе внутреннего контроля качества (по
видам исследований);
правила калибровки оборудования (с привязкой к приборам);
операционные инструкции по
работе с оборудованием (с привязкой к приборам);правила проведения и оценки данных по межлабораторному сличению результатов лабораторных исследований;
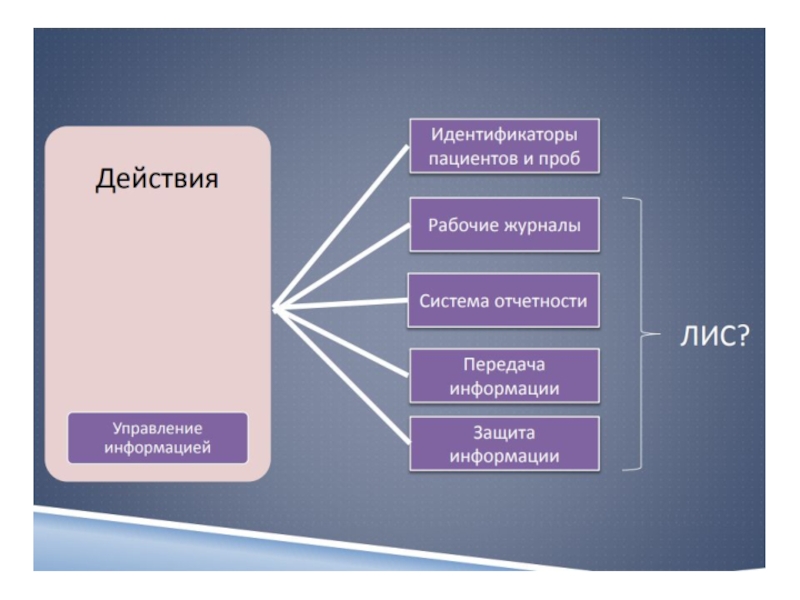
Слайд 50правила работы с информационными системами лаборатории;
организация межлабораторных сличений;
проведение верификации и
реверификации анализаторов;
проведение верификации и реверификации методик исследований;
управление рисками, включая биориски;
Слайд 51правила расчета неопределенности;
правила расчета общей ошибки;
правила гармонизации данных, полученных в
одной лаборатории для одного пациента, одной биопробы, одного аналита на
разных анализаторах и/или разными методами.Слайд 52Важность внедрения СОП:
Возможность обеспечить единообразие, согласованность и контроль над проводимыми
процессами и гарантировать, что процедура
выполняется точно таким же способом
каждый раз,
независимо от оператора;СОП должны регулярно пересматриваться и обновляться!
Слайд 53Хорошая СОП
дает детальные, ясные и полные инструкции по выполнению анализов
легко доступна, понятна новым сотрудникам
рассмотрена, проверена и утверждена руководством
регулярно обновляется
Слайд 55ISO 15189 устанавливает требования к технической компетентности лабораторий, включающие:
техническую компетентность
персонала
условия проведения исследований
выбор, валидацию и верификацию методик
метрологическую прослеживаемость
результатов исследований и
калибровкизабор образцов, подготовка и транспортировка образцов
обеспечение качества исследований
Слайд 56Лаборатория должна обеспечить подготовку персонала по следующим направлениям (5.1.5)
система менеджмента
качества;
процессы и процедуры, касающиеся служебных обязанностей;
использование лабораторной информационной системы;
техника безопасности;
этика;
конфиденциальность
информации о пациентах.Слайд 57Оценивание технической компетентности
персонала должна осуществляться (5.1.6):
прямым наблюдением за ходом подготовки
образцов
и осуществления исследований, включая все
мероприятия по технике безопасности
непосредственным наблюдением за
обслуживаниемоборудования и проверкой его функционирования,
мониторингом документирования и выдачи результатов.
анализом рабочих записей,
оценкой умения решать возникающие проблемы
оценкой выполнения исследований специальных проб
(повторное исследование, контрольные материалы,
пробы ВОК)
Слайд 58Помещения и условия работы (5.2)
Лаборатория должна иметь помещения,
необходимые для
осуществления ее деятельности, конструкция которых
позволяла бы обеспечить качество,
безопасность и эффективность
предоставляемых
услуг, а также здоровье ибезопасность персонала лаборатории,
пациентов и посетителей.
Слайд 60Обеспечение качества результатов
исследования (5.6)
Лаборатория должна разработать и
внедрить процедуры
внутрилабораторного контроля
качества,
с помощью которых можно
проверить достижения необходимого
качества результатов . ( 5.6.2.1
)Слайд 61Лаборатория должна обязательно участвовать
в программе ( программах ) межлабораторных
сравнений ,
(таких , как программы внешнего
оценивания качества или для
профессионального тестирования), которые
являются
приемлемыми для исследования иинтерпретации результатов исследования .
Лаборатория должна отслеживать результаты
участия в программе ( программах )
межлабораторного сравнения и участвовать во
внедрении корректирующих действий , если
установленные требования к рабочим
характеристикам не выполняются