Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ставропольский государственный медицинский университет Кафедра общей и
Содержание
- 1. Ставропольский государственный медицинский университет Кафедра общей и
- 2. ПЛАН ЛЕКЦИИ:1. Дисперсные системы и их классификация.
- 3. Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и ВМС (высоко-молекулярных соединений).Томас Грэм (1862)
- 4. ДИСПЕРСНАЯ СИСТЕМА – Дисперсная фаза ( Д.Ф.) - Дисперсионная среда ( Д.С.) -
- 5. Классификация дисперсных системI. По агрегатному состоянию дисперсной
- 6. По агрегатному состоянию Д.Ф. и Д.С.
- 7. Коллоидно- дисперсные системы с твердой дисперсной фазой
- 8. II. По степени дисперсности Д.Ф. 1. Грубодисперсные
- 9. Свойства систем различной степени дисперсности
- 10. Слайд 10
- 11. По структурно-механическим свойствам:
- 12. По характеру взаимодействия Д.Ф. с Д.С. :
- 13. Природа коллоидного состояния 1.Гетерогенность2.Высокая
- 14. Условия получения золя: 1. плохая
- 15. МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ (золей):диспергационные методы -
- 16. I. Методы диспергирования: - механическое дробление с
- 17. Методы диспергирования:3. - распыление под водой
- 18. II. Методы конденсациифизические методы:а - метод замены
- 19. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХРАСТВОРОВ:Диализ- удаление низкомолекулярных соединений с помощью мембран
- 20. Электродиализ - это процесс диализа в условиях
- 21. Ультрафильтрация- это отделение дисперсной фазы от дисперсионной
- 22. Компенсационный диализ (вивидиализ) - АИП
- 23. Компенсационный или вивидиализ - применяют
- 24. МИЦЕЛЛА (Лат. Mica -крошка) - этогетерогенная микросистема,
- 25. Ядро состоит из: - агрегата
- 26. Правило ПАНЕТТА-ФАЯНСА:кристаллическую решетку ядра достраивает тот ион,
- 27. Слайд 27
- 28. агрегат m моль KCl взят в избытке
- 29. Fe(OH)3 + HCl
- 30. СuSO4 взят в избытке n моль;n СuSO4
- 31. В мицелле существует 2 скачка потенциала:
- 32. Fe(OH)3 + HCl
- 33. Схема строения мицеллы золя иодида серебра и ее двойного электрического слоя
- 34. Межфазный (электродинамический) (φ фи) потенциал
- 35. Электрокинетический (ζ дзета) потенциалпотенциал на границе скольжения
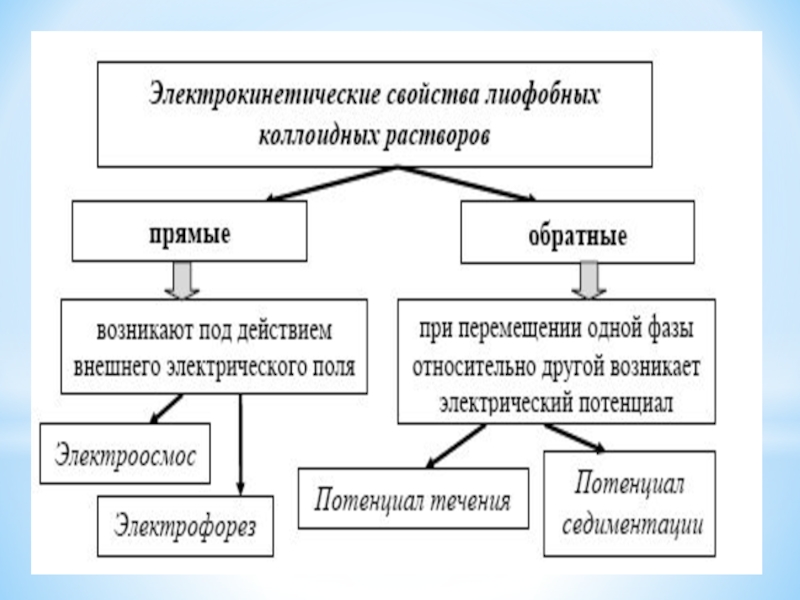
- 36. Свойства лиофобных коллоидных растворов Молекулярно-кинетические Электро-кинетические Оптические
- 37. Конус Тиндаля-дифракционное рассеивание света в результате огибания частиц световой волной
- 38. Формула Рэлея [1871 г.]: I –
- 39. Окраска золей связана с избирательным поглощением световых
- 40. На сравнении интенсивности светорассеяния золей, один из
- 41. Слайд 41
- 42. Электрофорез – направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием электрического тока
- 43. Уравнение Гельмгольца-Смолуховского
- 44. Явление электрофореза в организмеЯвление электрофореза наблюдается при
- 45. Электрофорез применяют: - для очистки различных фармацевтических
- 46. В сравнении со многими видами терапии, электрофоретическая
- 47. Электроосмос – направленное движение дисперсионной среды (жидкости)
- 48. Электроосмос в организмеЭлектроосмотическое движение жидкости может происходить
- 49. Электроосмос в медицине:На явлении электроосмоса один из
- 50. Потенциал седиментации (Ф. Дорн, нем., 1878) –
- 51. Величина потециала седиментации (оседания) влияет на скорость
- 52. Устойчивость коллоидных растворов:Седиментационная (кинетическая) устойчивость
- 53. II. Агрегативная устойчивость –
- 54. Агрегативная устойчивость - способность частиц дисперсной фазы
- 55. В результате:электростатического отталкивания одноименно заряженных частиц за
- 56. Основные факторы устойчивости коллоидных растворов1. Величина ζ-потенциала
- 57. КОАГУЛЯЦИЯ - процесс объединения коллоидных
- 58. Примером коагуляции коллоидной системы служит процесс свертывания
- 59. Теории коагуляции 1. Теория Фрейндлиха:а/ коагуляция наступает,
- 60. Механизм коагуляции. Роль электролитов при коагуляции заключается
- 61. Виды коагуляцииНейтрализационная коагуляция - наступает под действием
- 62. Концентрационная коагуляция – наступает за счет ионов
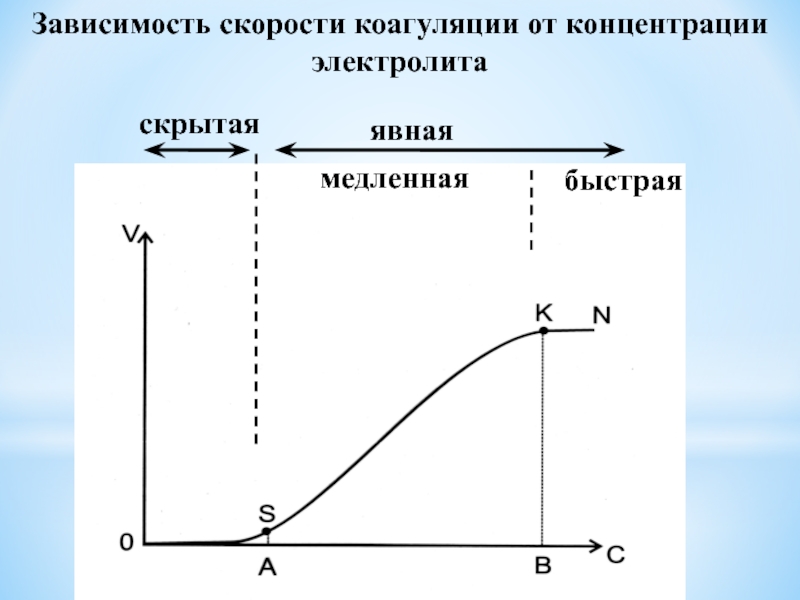
- 63. Зависимость скорости коагуляции от концентрации электролитаскрытаяявнаямедленнаябыстрая
- 64. Скрытая коагуляция: образование частиц низших (I, II,
- 65. Явная коагуляция делится на два периода:1. медленную
- 66. Порог коагуляции - наименьшее количество
- 67. Правило Шульце-Гарди: 1.Коагуляцию
- 68. γ(Al+3): γ(Ca+2): γ(K+1) ≈Гранула ( -
- 69. При коагуляции смесями электролитов возможны 3 случая:
- 70. 1) аддитивность –это суммирование коагулирующего действия
- 71. Синергизм — это усиление у одного
- 72. C2C1213γ2γ1 Коагуляция смесями электролитов:1 – аддитивность; 2 – антагонизм; 3 - синергизм
- 73. Взаимная коагуляция - это слипание разноименно заряженных
- 74. Пептизация - процесс, обратный коагуляции
- 75. Процесс пептизации лежит в основе лечения многих
- 76. Механизм коагуляции золей электролитами1. Сжатие диффузного слоя2.
- 77. Защита коллоидов от коагуляции (коллоидная защита)Устойчивость коллоидов
- 78. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Ставропольский государственный медицинский университет
Кафедра общей и биологической химии
Лекция
7
Слайд 2ПЛАН ЛЕКЦИИ:
1. Дисперсные системы и их классификация.
2. Методы
получения и
очистки коллоидных растворов.3. Строение коллоидных частиц.
4. Устойчивость и коагуляция коллоидных систем.
Слайд 3
Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем
и ВМС (высоко-молекулярных соединений).
Томас Грэм (1862)
Слайд 5Классификация дисперсных систем
I. По агрегатному состоянию дисперсной фазы и дисперсионной
среды
IV. По характеру взаимодействия между фазой и средой
III
. По характеру взаимодействия частиц дисперсной фазы между собой II. По степени дисперсности дисперсной фазы
Слайд 7Коллоидно- дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной
средой называют коллоидными растворами (золи, если растворитель вода- гидрозоль)
Коллоидными системами являются многие биологические жидкости живого организма: кровь, плазма, лимфа, спинно-мозговая жидкость, моча и др.
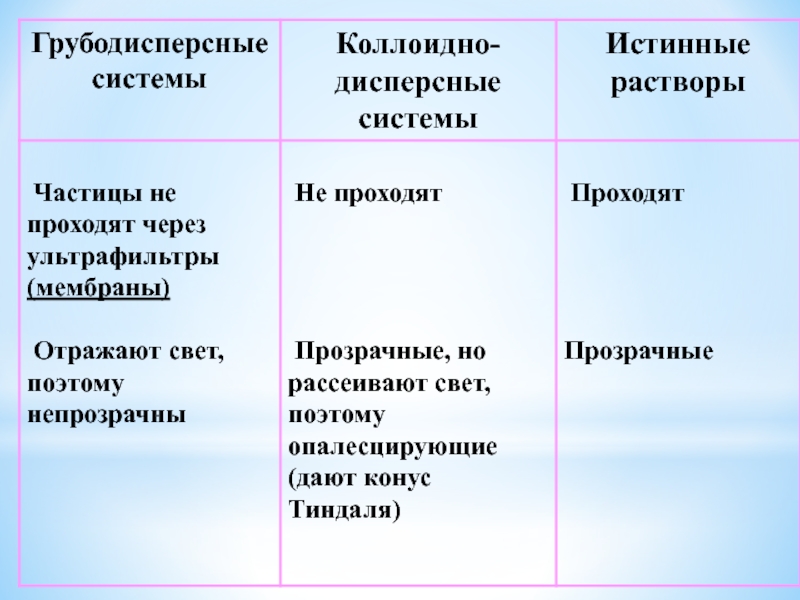
Слайд 8II. По степени дисперсности Д.Ф.
1. Грубодисперсные системы (микрогетерогенные, низкодисперсные
системы системы):
>10-7 м или >100 нм
2. Коллоидно-дисперсные системы (ультрамикрогетерогенные
или высокодисперсные системы): ≈ 10-7 - 10-9 м, 1 - 100 нм
3. Молекулярно-ионные (истинные) растворы:
< 10-9 м, < 1 нм
Слайд 13 Природа коллоидного состояния
1.Гетерогенность
2.Высокая степень дисперсности.
3.Наличие высокоразвитой
поверхности раздела фаз.
4. Большой запас поверхностной энергии Гиббса.
5. Агрегативная
и кинетическая неустойчивость.Слайд 14
Условия получения золя:
1. плохая растворимость
Д.Ф. в Д.С., т.е. наличие границы
раздела фаз;2. размер частиц 10-7 -10-9 м (1-100 нм) ;
3. наличие иона стабилизатора, который сорбируясь на ядре прeпятствует
слипанию частиц (ион-стабилизатор определяется правилом Панетта-Фаянса)
Слайд 15МЕТОДЫ ПОЛУЧЕНИЯ
КОЛЛОИДНЫХ РАСТВОРОВ (золей):
диспергационные методы - измельчение крупных частиц
до размеров коллоидных ;
2) конденсационные методы - объединение молекул
и ионов в истинных растворах в более крупные коллоидные частицы Слайд 16I. Методы диспергирования:
- механическое дробление с помощью шаровых
и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора;
- дробление ультразвуком - под действием ультразвуковых колебаний на смесь нерастворимого вещества и растворителя (дробление камней в почках) ;
Слайд 17 Методы диспергирования:
3. - распыление под водой в вольтовой дуге
благородных металлов с последующей конденсацией паров металла при охлаждении [метод
Бредига].4. -химическое диспергирование (пептизация), заключается в химическом воздействии на осадок (лечение тромбофлебита гепарином)
.
Слайд 18II. Методы конденсации
физические методы:
а - метод замены растворителя
б -
метод конденсации паров
химические методы: - реакции восстановления
(Ag2O+H2 → 2Ag↓ +H2O)
- реакции окисления
(2H2S + SO2 → 3S↓ + 2Н2О)
- реакции обмена
(СuСl2+ Na2S → CuS↓ + 2NaCl)
- реакции гидролиза
(FеСl3 +ЗН2O → Fe(OH)3↓ +3HCI)
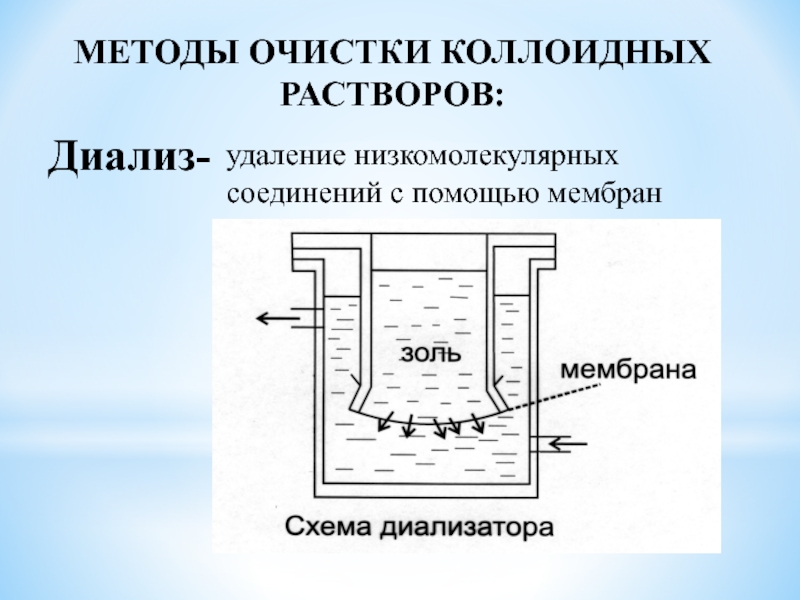
Слайд 19МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ
РАСТВОРОВ:
Диализ-
удаление низкомолекулярных соединений с помощью мембран
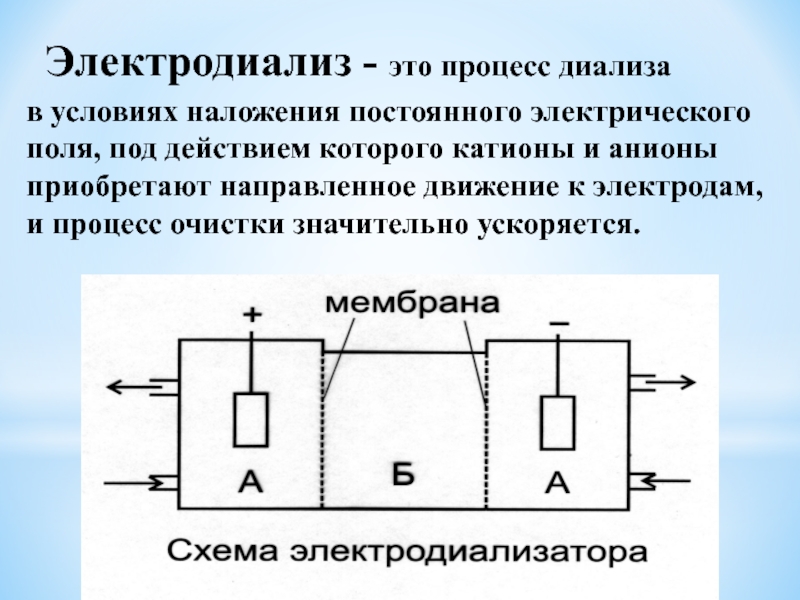
Слайд 20Электродиализ - это процесс диализа
в условиях наложения постоянного электрического
поля, под действием которого катионы и анионы приобретают направленное движение
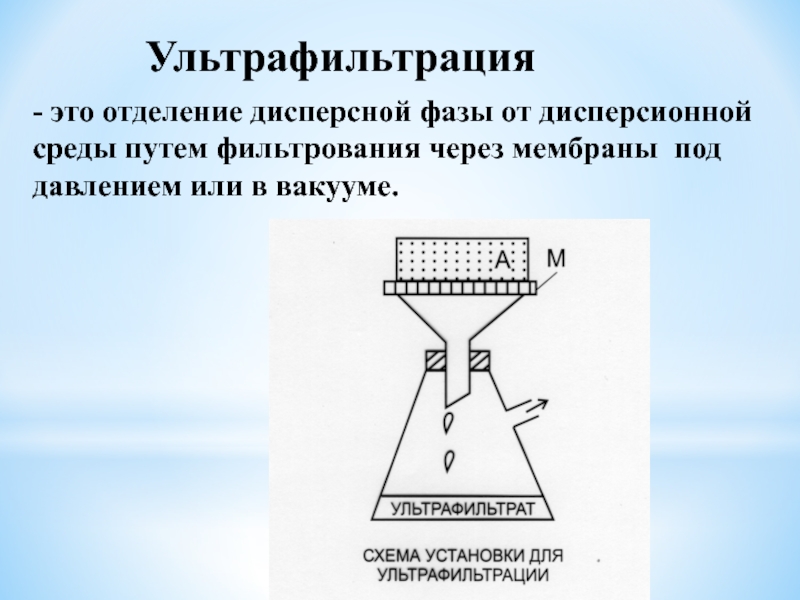
к электродам, и процесс очистки значительно ускоряется.Слайд 21Ультрафильтрация
- это отделение дисперсной фазы от дисперсионной среды путем фильтрования
через мембраны под давлением или в вакууме.
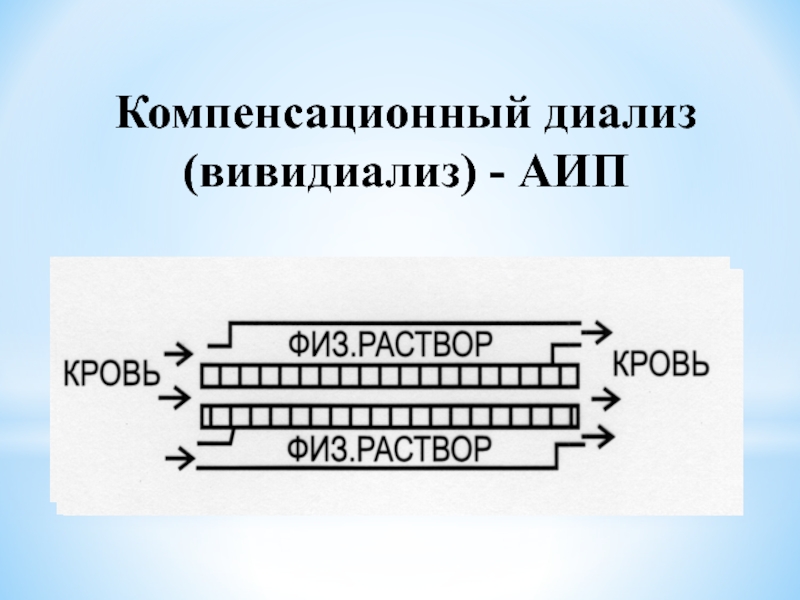
Слайд 23Компенсационный или вивидиализ
- применяют тогда, когда необходимо освободиться
лишь от части низкомолекулярных примесей. В этом случае растворитель заменяют
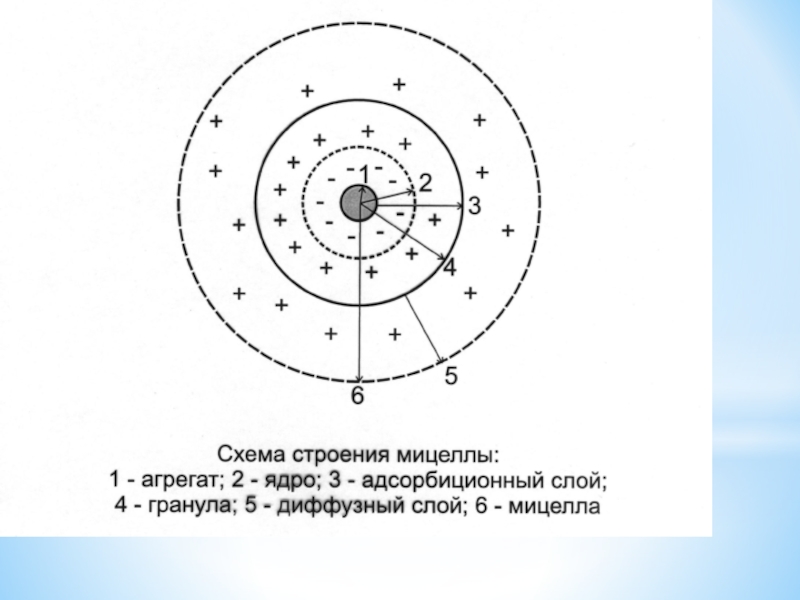
раствором НМВ, которые необходимо оставить в коллоидном растворе.Слайд 24МИЦЕЛЛА (Лат. Mica -крошка) - это
гетерогенная микросистема, которая состоит из
микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Мицеллярная теория строения
коллоидных частицСлайд 25 Ядро состоит из:
- агрегата (микрокристаллы малорастворимого вещества);
-потенциалопределяющих ионов (ПОИ).
Мицелла состоит из:
1. ядра;
2. адсорбционного слоя;
3.
диффузного слоя.Слайд 26Правило ПАНЕТТА-ФАЯНСА:
кристаллическую решетку ядра достраивает тот ион, который находится в
растворе в избытке и содержится в агрегате или родственен (изоморфен)
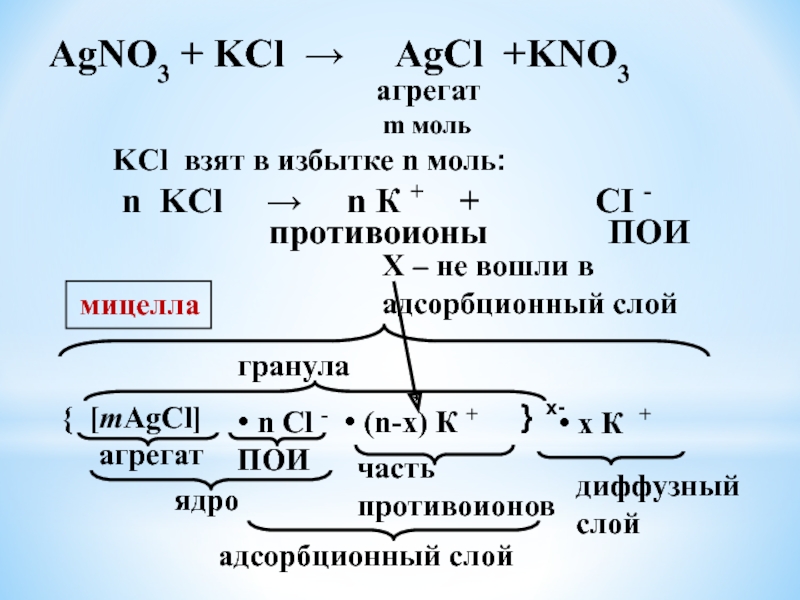
ему.Слайд 28агрегат
m моль
KCl взят в избытке n моль:
n KCl
→ n К + +
CI -ПОИ
противоионы
{ [mAgCl]
агрегат
• n Cl -
ПОИ
ядро
• (n-x) К +
адсорбционный слой
} х-
гранула
• x К +
мицелла
часть противоионов
диффузный слой
Х – не вошли в адсорбционный слой
AgNO3 + KCl AgCl +KNO3
Слайд 29
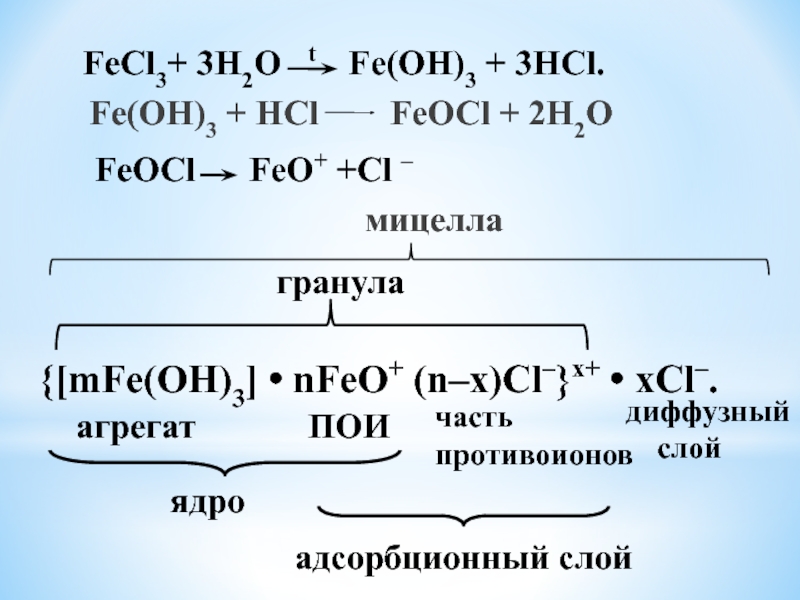
Fe(OH)3 + HCl FeOCl + 2H2O
FeCl3+ 3H2O t Fe(OH)3 + 3HCl.
FeOCl FeO+ +Cl –
{[mFe(OH)3] • nFeO+ (n–x)Cl–}x+ • xCl–.
агрегат
ПОИ
часть
противоионов
ядро
адсорбционный слой
диффузный
слой
гранула
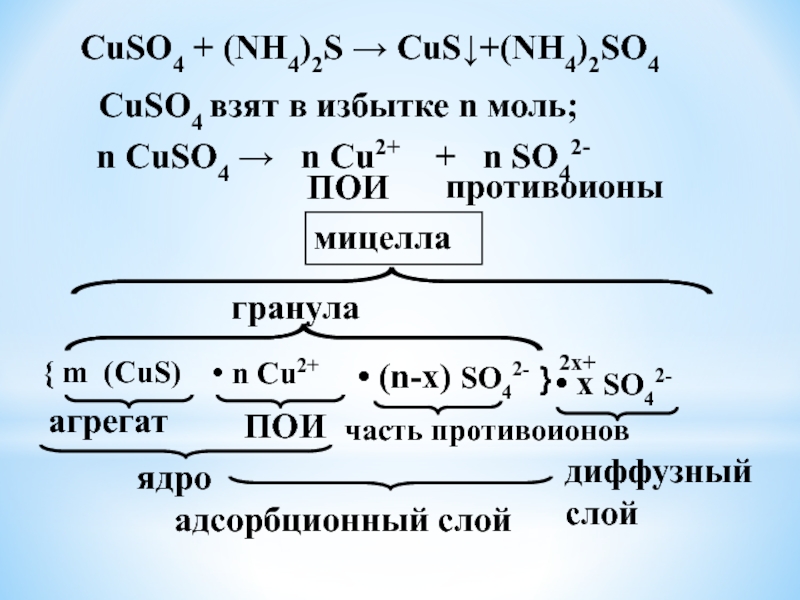
Слайд 30СuSO4 взят в избытке n моль;
n СuSO4 → n
Сu2+ + n SO42-
противоионы
ПОИ
{ m (CuS)
агрегат
• n Сu2+
ПОИ
ядро
• (n-x) SO42-
часть противоионов
адсорбционный слой
}
гранула
2x+
• x SO42-
диффузный слой
мицелла
СuSO4 + (NH4)2S → CuS↓+(NH4)2SO4
Слайд 31 В мицелле существует 2 скачка потенциала:
1) φ - электротермодинамический
–φ ~ 1 В.
2) ζ (дзетта) - электрокинетический –
ζ = 0,1 В
Состояние гранулы, когда все ионы диффузного слоя переходят в адсорбционный и ζ = 0 - называется изоэлектрическим.
{[m CuS] • n Сu2+• (n-x) SO4 2-}2x+ • x SO42-
φ
ζ
Слайд 32
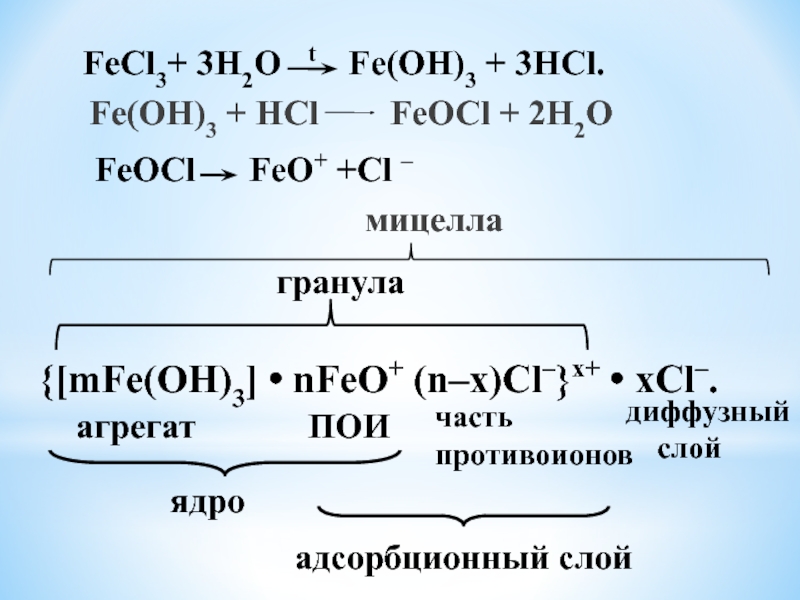
Fe(OH)3 + HCl FeOCl + 2H2O
FeCl3+ 3H2O t Fe(OH)3 + 3HCl.
FeOCl FeO+ +Cl –
{[mFe(OH)3] • nFeO+ (n–x)Cl–}x+ • xCl–.
агрегат
ПОИ
часть
противоионов
ядро
адсорбционный слой
диффузный
слой
гранула
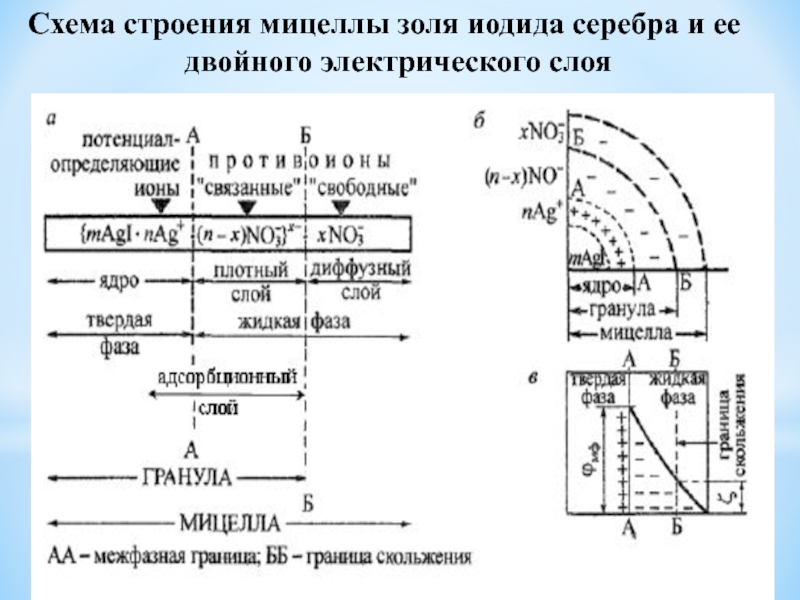
Слайд 34 Межфазный (электродинамический)
(φ фи) потенциал -
потенциал ДЭС на
границе раздела между твердой и жидкой фазами в мицелле (на
схемах мицеллы - граница АА).Зависит от природы твердой фазы, заряда и концентрации потенциалопределяющих ионов.
Знак φмф совпадает со знаком заряда ПОИ.
Слайд 35Электрокинетический (ζ дзета) потенциал
потенциал на границе скольжения между адсорбционной и
диффузионной частями ДЭС (на схемах мицеллы - граница ББ) Зависит
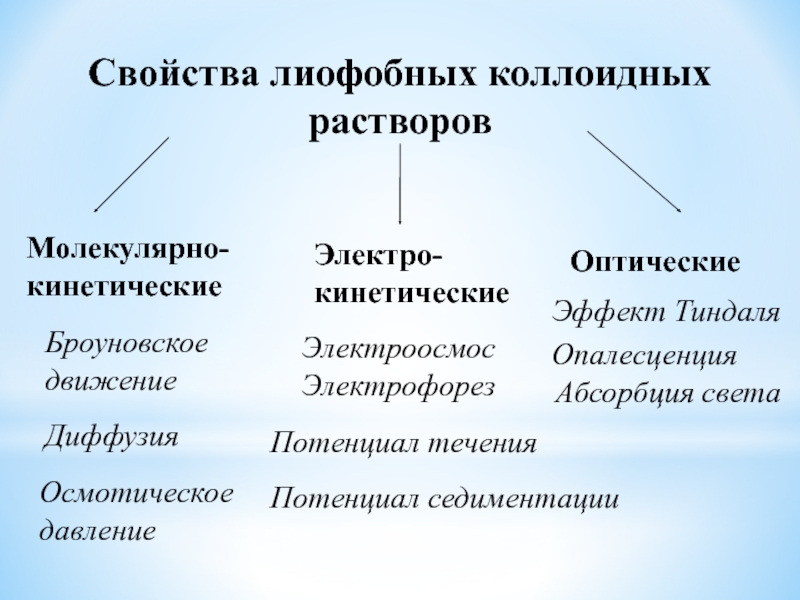
от толщины диффузного слоя. Основной фактор агрегативной устойчивости. Мицеллы, образующие стабильные коллоидные растворы, имеют относительно высокое значение ζ=(50 - 70 мВ).Слайд 36Свойства лиофобных коллоидных растворов
Молекулярно-
кинетические
Электро-
кинетические
Оптические
Броуновское
движение
Диффузия
Осмотическое
давление
Электроосмос
Электрофорез
Потенциал течения
Потенциал седиментации
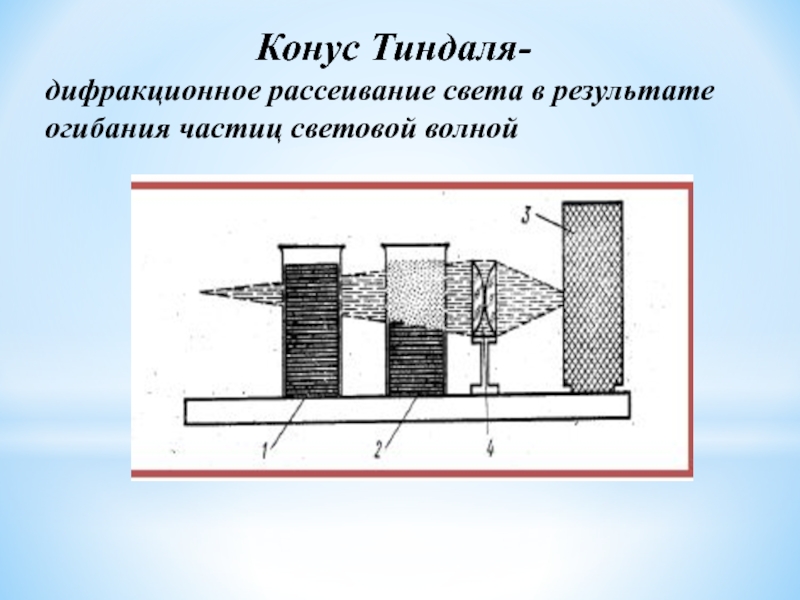
Эффект Тиндаля
Опалесценция
Абсорбция света
Слайд 38Формула Рэлея [1871 г.]:
I – интенсивность рассеянного
света в направлении, перпендикулярном к лучу падающего света; K –
константа, зависящая от свойств показателей преломления фаз; n – число частиц в единице объема золя; – длина волны падающего света; V – объем каждой частицы.Слайд 39Окраска золей
связана с избирательным поглощением световых лучей.
Если золь
только рассеивает, а не поглощает световые лучи — он бесцветен.
Опалесценция- рассеяние света в коллоидных системах и изменение окраски коллоида
По Рэлею : светорассеяние обратно пропорционально длине волны падающего света
Дихроизм— наложение опалесценции на собственную окраску золя.
Слайд 40На сравнении интенсивности светорассеяния золей, один из которых имеет известную
концентрацию (степень дисперсности), основан метод определения концентрации либо степени дисперсности
золя, называемый нефелометрией.На использовании эффекта Тиндаля основывается ультрамикроскоп – прибор, позволяющий наблюдать коллоидные частицы размером более 3нм в рассеянном свете (в обычном микроскопе можно наблюдать частицы с радиусом не менее 200 нм из-за ограничений, связанных с разрешающей способностью оптики).
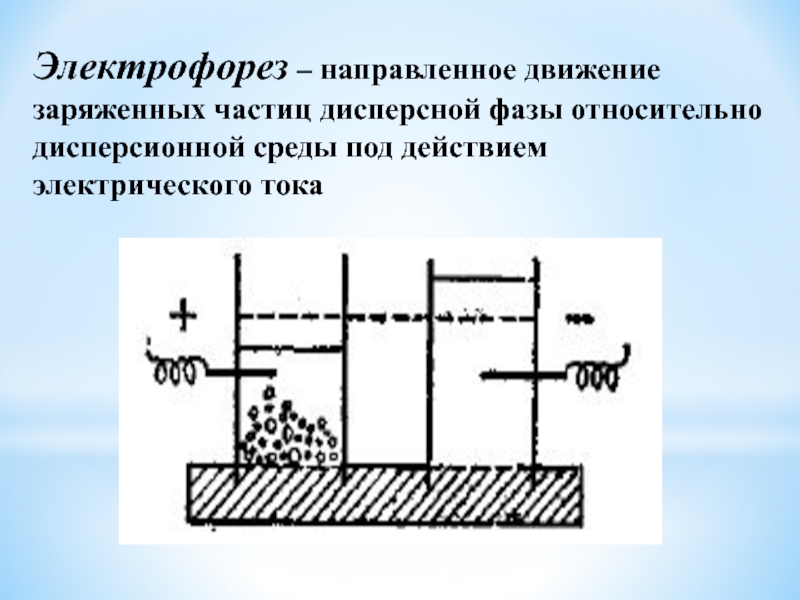
Слайд 42Электрофорез – направленное движение заряженных частиц дисперсной фазы относительно дисперсионной
среды под действием электрического тока
Слайд 43Уравнение Гельмгольца-Смолуховского
ε Н
ζ
v = ———
4πηгде v – электрофоретическая скорость,
ε – диэлектрическая проницаемость раствора,
Н – напряженность внешнего электрического поля (приложенный потенциал),
ζ – электрокинетический потенциал,
η – вязкость раствора.
Электрофоретическая подвижность коллоидных частиц рассчитывается по формуле: v εζ
v0 = — = ———
Н 4πη
Слайд 44Явление электрофореза в организме
Явление электрофореза наблюдается при миграции лейкоцитов в
очаги воспаления, в которых происходит накопление кислых продуктов, в основном,
органических кислот, рН снижается, на границе воспаленного и невоспаленного участков возникает разность потенциалов 100-150 мВ, причем лейкоциты, имеющие отрицательный заряд устремляются в зону очага воспаления, имеющего положительный заряд. Методом электрофореза установлено, что внутренняя поверхность биологических мембран заряжена отрицательно.
Слайд 45Электрофорез применяют:
- для очистки различных фармацевтических препаратов, установления
степени чистоты по электрофоретической однородности ряда антибиотиков, витаминов и других
веществ.- для локального введенииия лечебных препаратов в организм человека.
- при диагностике ряда заболеваний путем сравнения фракционного состава (по числу и интенсивности зон на электрофореграмме) нормальных и патологических биологических жидкостей.
Слайд 46В сравнении со многими видами терапии, электрофоретическая методика лечения является
предпочтительнее в силу основных своих достоинств:
Минимальный риск развития нежелательных реакций.
Высокая
продолжительность терапевтического действия.Возможность одновременного введения нескольких препаратов. Примером может служить электрофорез с кальцием и фосфором, который часто назначают при патологии суставов.
Свойственна длительная задержка препарата в организме.
Воздействие тока повышает чувствительность тканей организма даже к малым дозам лекарственного средства.
Основное действие электрофореза – местное, противовоспалительное. Препарат вводится непосредственно в воспалительный очаг.
- для разделения и выделения различных лекарственных веществ и биологически активных соединений
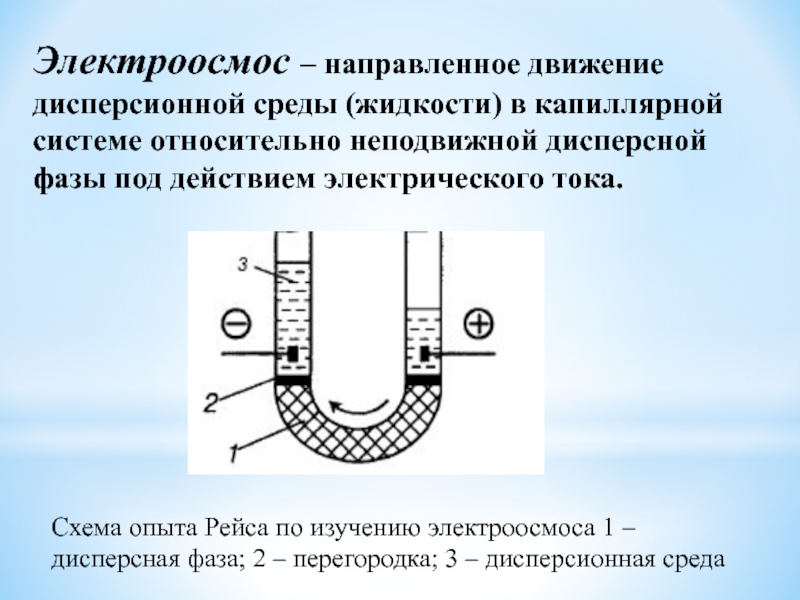
Слайд 47Электроосмос – направленное движение дисперсионной среды (жидкости) в капиллярной системе
относительно неподвижной дисперсной фазы под действием электрического тока.
Схема опыта
Рейса по изучению электроосмоса 1 – дисперсная фаза; 2 – перегородка; 3 – дисперсионная среда Слайд 48Электроосмос в организме
Электроосмотическое движение жидкости может происходить через поры брыжейки
млекопитающих, через капилляры, стенки которых обладают электрическим зарядом. В организме
электроосмос возникает при работе секретирующих клеток, а также в канальцах почек при образовании мочи. В клетках проксимального канальца нефрона за счет механизма активного переноса ионов Na+ и K+ , а также за счет пассивного движения ионов между апикальной и базальной поверхностями клеток канальца возникает разность потенциалов величиной 50–60 мВ. Поэтому через стенку проксимального канальца наряду с обычным осмосом происходит и электросмотический ток жидкости.Слайд 49Электроосмос в медицине:
На явлении электроосмоса один из широко используемых физиотерапевтических
методов лечения многих заболеваний – ионофорез, сущность которого заключается в
проникновении жидкости, содержащей лечебные ионы и молекулы через капиллярную систему под действием электрического тока.Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем.
Слайд 50Потенциал седиментации (Ф. Дорн, нем., 1878) – это разность потенциалов,
возникающая при оседании частиц дисперсной фазы в жидкой дисперсионной среде.
Потенциал течения ( Г. Квинке, нем., 1859)
– это разность потенциалов, возникающая на концах капиллярной системы при протекании через систему жидкой дисперсионной среды под действием гидростатического давления.
Слайд 51Величина потециала седиментации (оседания) влияет на скорость оседания эритроцитов (СОЭ).
Удельная масса эритроцитов превышает удельную массу плазмы крови, поэтому эритроциты
оседают медленно.При течении крови по капиллярам возникают потенциалы течения (протекания). При сокращении сердечной мышцы кровь проталкивается через капилляры, при этом возникает потенциал течения, как компонент сумммарного электрического потенциала, регистрируемого при электро-кардиографии.
Зубец Q на ЭКГ обусловлен потенциалами течения в коронарной системе.
Слайд 52
Устойчивость
коллоидных растворов:
Седиментационная (кинетическая) устойчивость -
Критерии:
броуновское движение;
степень дисперсности;
3.
вязкость дисперсионной среды (чем ↑, тем ↑ уст-сть);4. температура (чем ↑, тем ↑ уст-сть).
Слайд 53 II. Агрегативная устойчивость –
способность
системы противостоять
слипанию частиц дисперсной фазы.
Критерии:1. ионная оболочка, т.е. наличие
двойного электрического слоя; ДЭС = адсорбционный + диффузный слой
2. сольватная (гидратная) оболочка растворителя (чем ↑, тем ↑ уст-сть);
3. величина ζ– потенциала гранулы ( чем > ζ , тем < вероятность слипания и тем > уст-сть) Коллоидные растворы с ионным стабилизатором устойчивы, если ζ-потенциал превышает 50 мВ, относительно устойчивы при 30 ζ 50 мВ и неустойчивы при ζ 30 мВ.
4. температура.
Слайд 54Агрегативная устойчивость - способность частиц дисперсной фазы противодействовать их слипанию
между собой и тем самым сохранять неизменными свои размеры.
Причина а.у.
-наличие на поверхности частиц "рыхлой" ионной атмосферы из гидратированных противоионов, которая увеличивает сродство коллоидных частиц к дисперсной среде, препятствует их слипанию Слайд 55В результате:
электростатического отталкивания одноименно заряженных частиц за счет большого скопления
противоионов в области контакта ионных атмосфер;
расклинивания за счет упругих свойств
гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;- расклинивания за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т. е. в область большого скопления противоионов.
Слайд 56Основные факторы устойчивости коллоидных растворов
1. Величина ζ-потенциала
2. Величина электродинамического
потенциала (φ)
3. Толщина диффузного слоя
4. Величина заряда гранулы
Слайд 57 КОАГУЛЯЦИЯ - процесс объединения коллоидных частиц с образованием
более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
Факторы,
вызывающие коагуляцию:увеличение концентрации золя;
действие света;
изменение температуры;
облучение;
добавление электролитов.
Слайд 58Примером коагуляции коллоидной системы служит процесс свертывания крови. Ему способствует
наличие в крови катионов кальция, поэтому для длительного хранения крови,
предназначенной для консервирования, эти ионы удаляют из крови различными физико-химическими методами.Слайд 59Теории коагуляции
1. Теория Фрейндлиха:
а/ коагуляция наступает, когда заряд коллоидной
частицы понижен до критического значения;
б/ понижение заряда обусловлено адсорбцией и
замещением компенсирующих ионов на ионы коагулятора.2. Теория Мюллера: коагуляция обязана понижению заряда двойного электрического слоя в результате сжатия двойного электрического слоя и перехода ионов из диффузного слоя в адсорбционный..
3. из современных теорий коагуляции – теория
Б.В.Дерягина и Л.Д.Ландау.
сближению частиц, препятствует расклинивающее давление,
препятствуют сближению частиц также прилегающие к частице молекулы воды, обладающие повышенной вязкостью и упругостью.
Слайд 60Механизм коагуляции.
Роль электролитов при коагуляции заключается в уменьшении расклинивающего
давления между сближающимися коллоидными частицами. Это может происходить двумя путями:
-за счет уменьшения заряда поверхности ядра, т. е. за счет снижения межфазного потенциала
- за счет уменьшения толщины (сжатия) ионных атмосфер мицелл
Слайд 61Виды коагуляции
Нейтрализационная коагуляция - наступает под действием электролита, который химически
взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение и
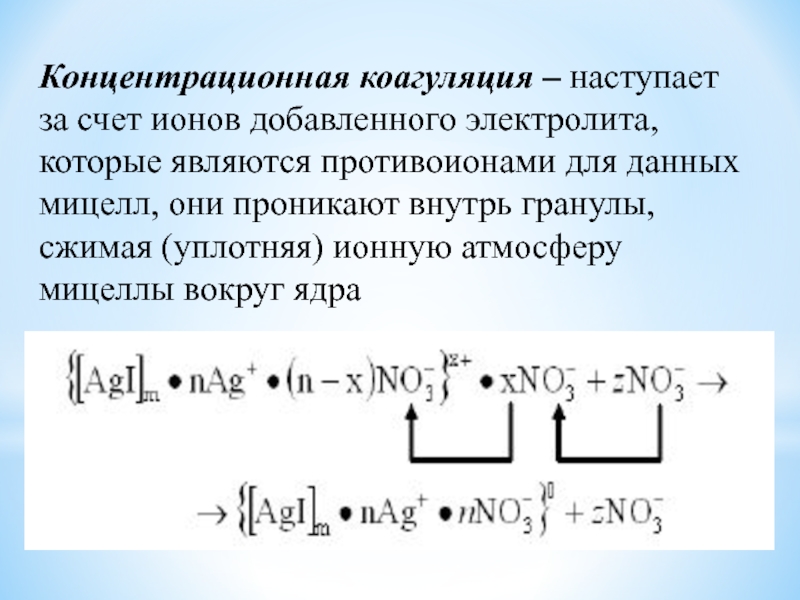
уменьшая заряд поверхности ядра.Слайд 62Концентрационная коагуляция – наступает за счет ионов добавленного электролита, которые
являются противоионами для данных мицелл, они проникают внутрь гранулы, сжимая
(уплотняя) ионную атмосферу мицеллы вокруг ядраСлайд 64Скрытая коагуляция:
образование частиц низших (I, II, III) порядков протекает
незаметно для невооруженного глаза.
Явная коагуляция :
повышение скорости коагуляции,
появление частиц более высоких порядков, золь претерпевает видимые изменения: мутнеет или изменяется окраска. При этом величина ξ-потенциала частиц уменьшается. Слайд 65Явная коагуляция делится на два периода:
1. медленную коагуляцию - всякое
увеличение концентрации электролита ускоряет коагуляцию
2. быструю коагуляция - повышение концентрации
электролита не влияет на ее скорость, т.е. коагуляция протекает с максимальной быстротой.Слайд 66Порог коагуляции - наименьшее количество электролита, которое
вызывает явную коагуляцию 1л золя
1000Сэл VэлС пк =
Vкр + Vэл
Спк. - порог коагуляции, ммоль/л;
Сэл. - концентрация электролита, моль/л;
Vэл. - объем раствора электролита, л;
Vзоля - объем золя, л.
γ = 1/ Спк. - коагулирующее действие электролита
Слайд 67 Правило Шульце-Гарди:
1.Коагуляцию вызывают любые ионы,
которые имеют знак заряда, противоположный заряду гранул.
2.Коагулирующее действие ионов
(γ) тем сильнее, чем выше заряд иона-коагулянта - прямо пропорционально его заряду в шестой степени: γ = f (z6)
Слайд 68 γ(Al+3): γ(Ca+2): γ(K+1) ≈
Гранула ( - )
36 :
26 : 16 ≈ 729 : 64 : 1
Гранула (
+ )γ (PO4 3-): γ (SO42-): γ (Cl-) ≈ 36 : 26 : 16
Слайд 69При коагуляции смесями электролитов возможны 3 случая:
1) аддитивность
–
2) антагонизм –
3) синергизм –
Слайд 70
1) аддитивность –это суммирование коагулирующего действия ионов, вызывающих
коагуляцию - не взаимодействуют химически между собой. Например, смесь солей
КС1 и NaNO3 2) антагонизм –это ослабление у электролита в присутствии другого - ионы связываются в нерастворимое соединение. Например, у РЬ 2+ по отношению к отрицательно заряженным гранулам ослабляется в присутствии NaCl:
РЬ 2+ + 2Сl-= РЬС12
Слайд 71
Синергизм — это усиление у одного электролита в
присутствии другого- - химическое взаимодействие c образованием многозарядного иона, обладающего
очень высокой коагулирующей способностью.FeCl3 + 6KCNS —K3[Fe(CNS)6] + 3KC1
Слайд 73Взаимная коагуляция -
это слипание разноименно заряженных гранул коллоидных растворов
Привыкание золя –
при медленном добавлении электролита коагуляция может
не наступить, а если этот же электролит добавлять быстро, то коагуляция наступит. Слайд 74Пептизация -
процесс, обратный коагуляции - превращение осадка, образовавшегося
в результате коагуляции, в устойчивый коллоидный раствор.
Условия пептизации:
—свежеполученные осадки;
—
необходимо добавление небольших количеств электролита- пептизатора, в ином случае может вновь наступить коагуляция;— пептизации способствуют перемешивание и нагревание
Слайд 75Процесс пептизации лежит в основе лечения многих заболеваний:
- рассасывания атеросклеротических
бляшек на стенках кровеносных сосудов,
- почечных и печеночных камней.
Не пептизируются застарелые тромбы и уплотнившиеся камни
Слайд 76Механизм коагуляции золей электролитами
1. Сжатие диффузного слоя
2. Избирательная адсорбция ионов
с зарядом, противоположным заряду гранулы
3. Ионообменная адсорбция
Слайд 77Защита коллоидов от коагуляции
(коллоидная защита)
Устойчивость коллоидов к действию электролитов
повышается при добавлении к ним ВМС (белков, полисахаридов: желатин, крахмал,
казеин натрия.Механизм защитного действия ВМС:
1. Макромолекулы ВМС адсорбируются на коллоидных частицах золя. Т.к. молекулы ВМС гидрофильны, то гидрофобные части золя, окруженные молекулами ВМС, становятся более гидрофильными и устойчивость их в водном растворе увеличивается.
2. Увеличиваются сольватные оболочки вокруг гидрофобных частиц, что препятствует сближению и слипанию частиц золя.
























![Ставропольский государственный медицинский университет
Кафедра общей и Формула Рэлея [1871 г.]: I – интенсивность рассеянного света в Формула Рэлея [1871 г.]: I – интенсивность рассеянного света в направлении, перпендикулярном к лучу падающего света;](/img/thumbs/c3b47f662c7dc4d42894cc8498a43a4a-800x.jpg)