Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома
Содержание
- 1. Строение атома
- 2. Атом – Химический элемент –Доказательства сложности строения атома:Открытие рентгеновских лучейОткрытие радиоактивностиОткрытие «катодных лучей» (электронов)Изучение явления радиоактивности
- 3. Модели строения атомаПудинг с изюмом (1902-04 гг)
- 4. Слайд 4
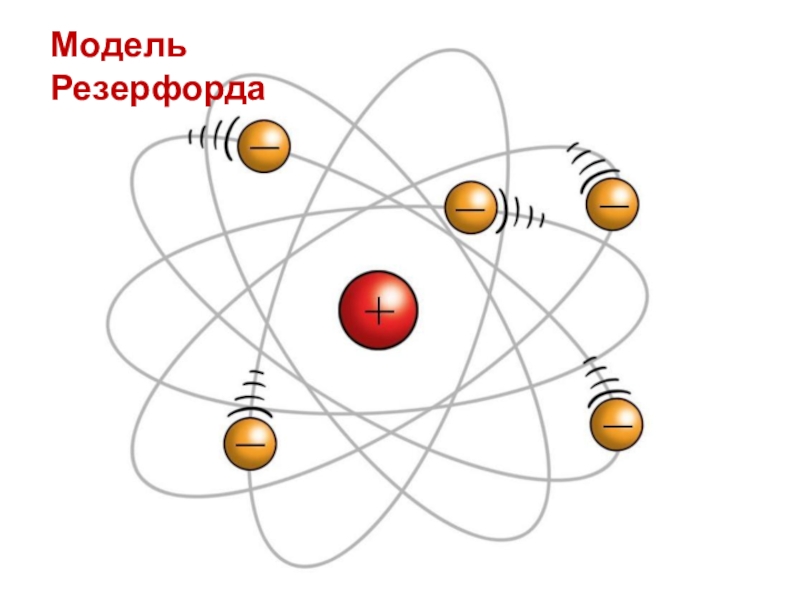
- 5. Модель Резерфорда
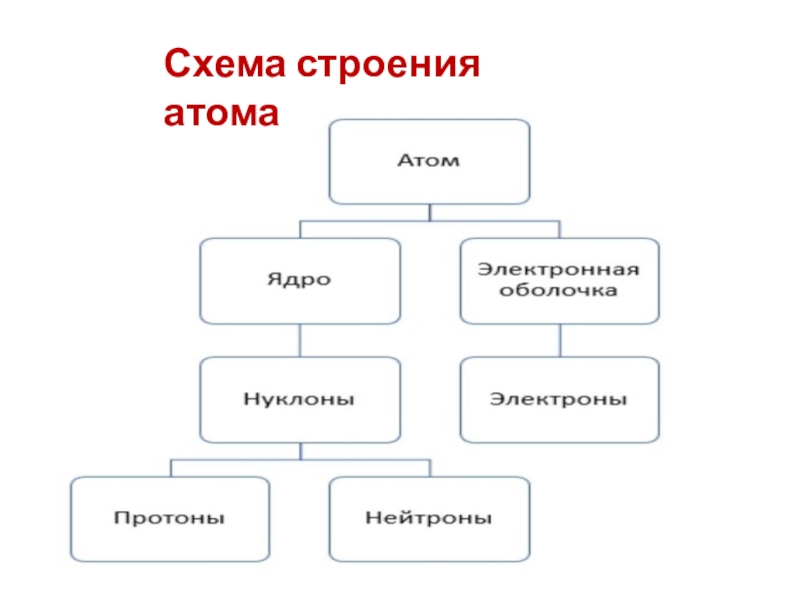
- 6. Схема строения атома
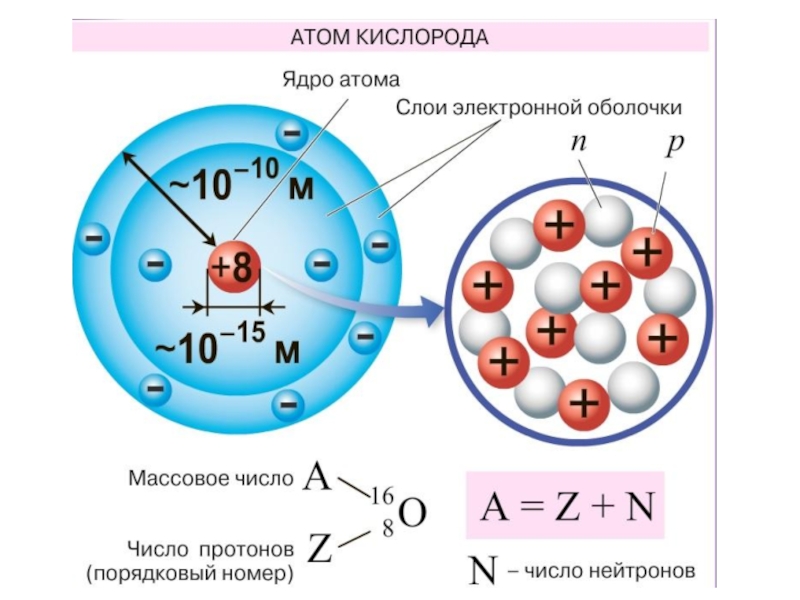
- 7. Слайд 7
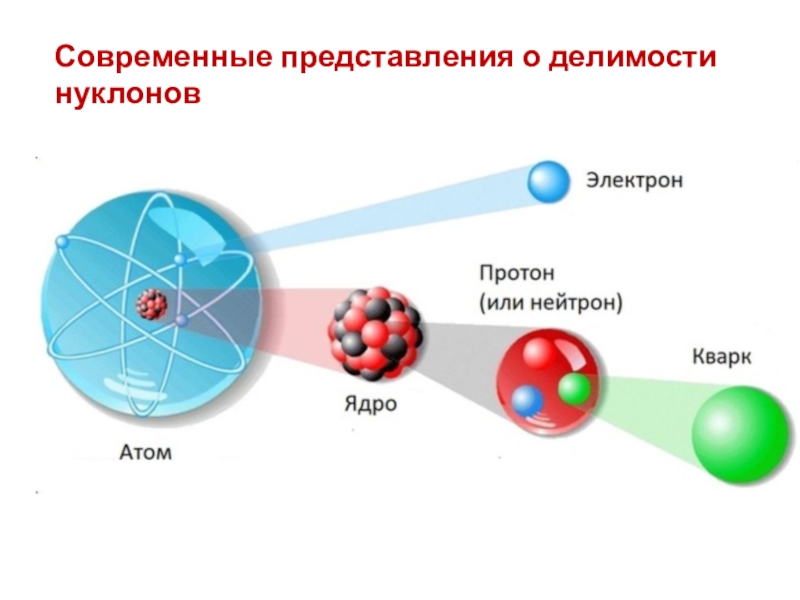
- 8. Современные представления о делимости нуклонов
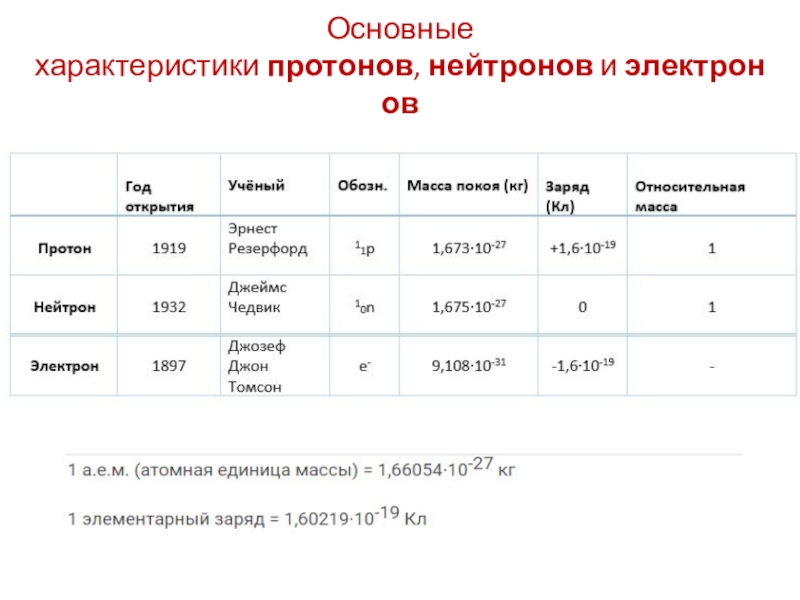
- 9. Основные характеристики протонов, нейтронов и электронов
- 10. Обратите внимание! При решении задач ЕГЭ среднее значение
- 11. Порядковый номер химического элемента в Периодической таблице
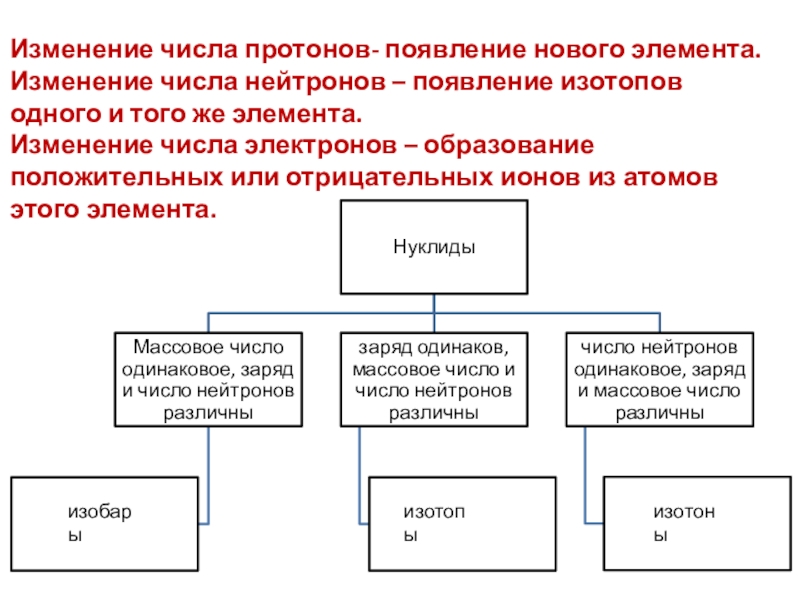
- 12. Изменение числа протонов- появление нового элемента.Изменение числа
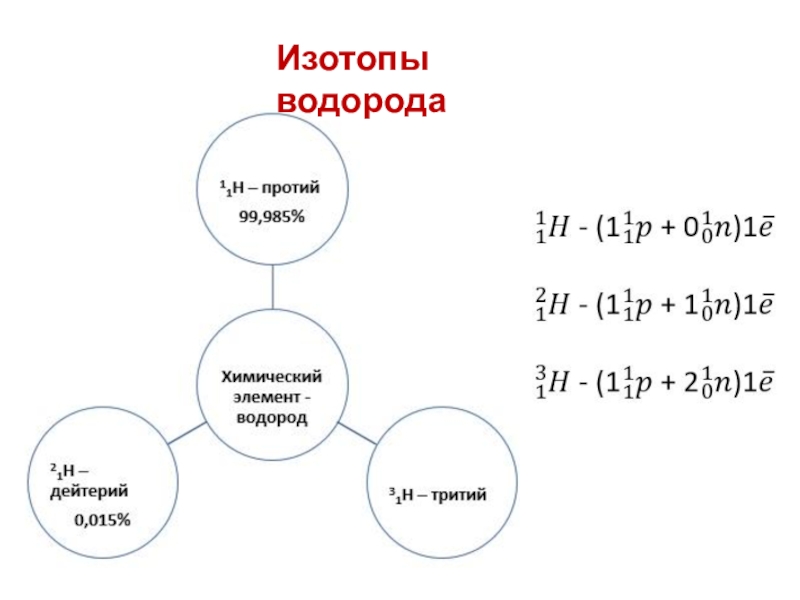
- 13. Изотопы водорода
- 14. Попробуйте ответить на вопросы:1. У изотопов одного
- 15. 3. Определите количество нейтронов, протонов и электронов в
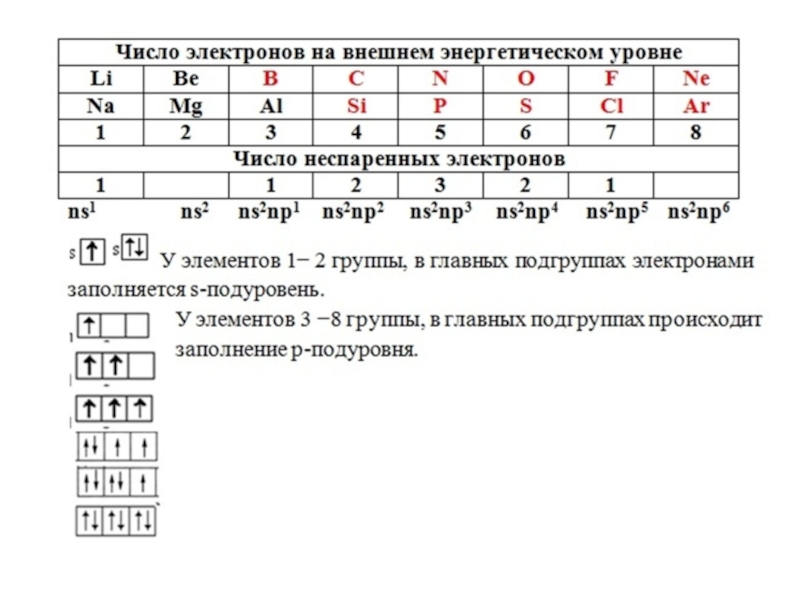
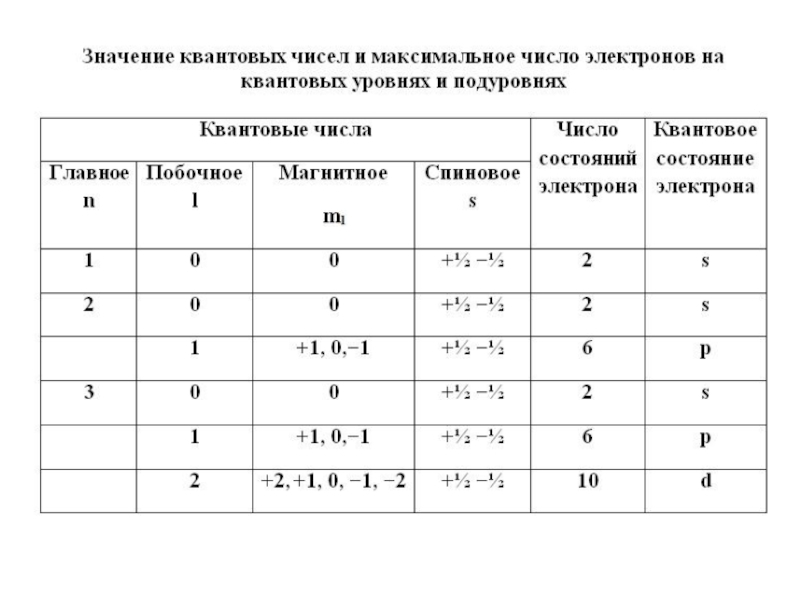
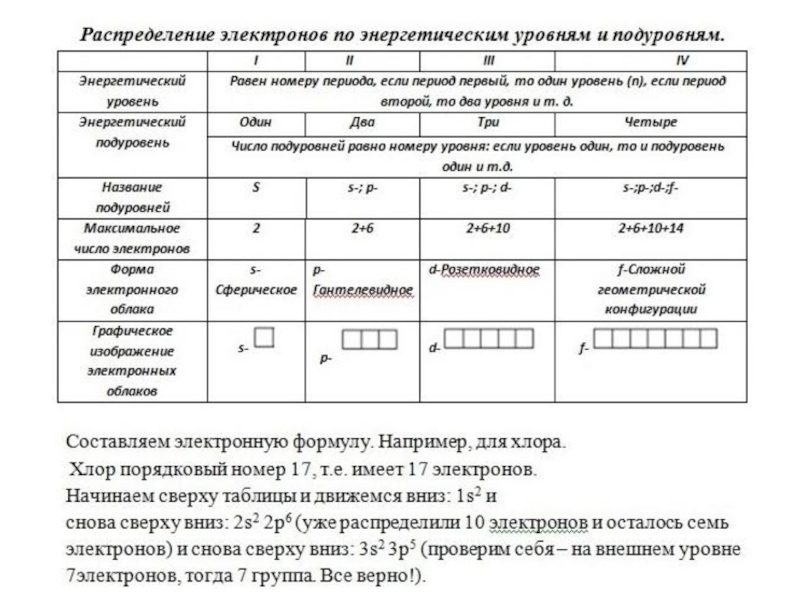
- 16. Электронное облако – Электронная орбиталь –Формы электронных орбиталей -
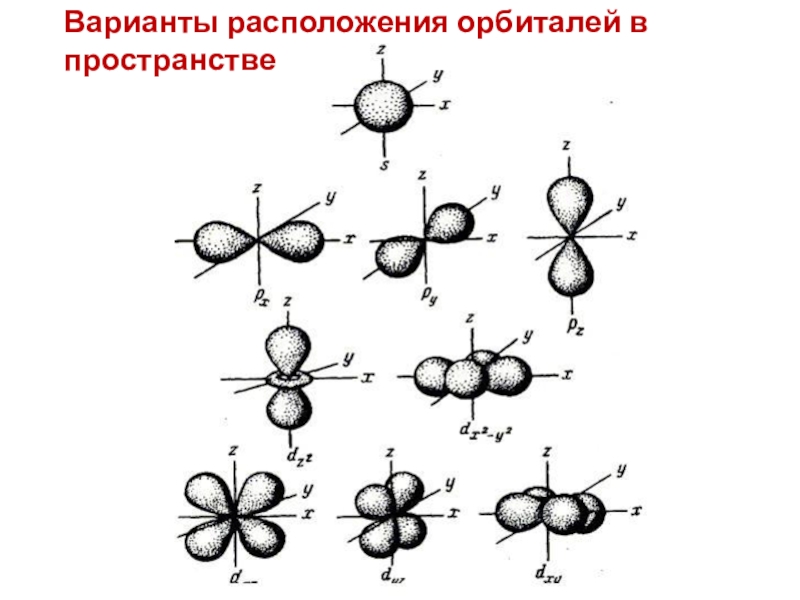
- 17. Варианты расположения орбиталей в пространстве
- 18. Слайд 18
- 19. Слайд 19
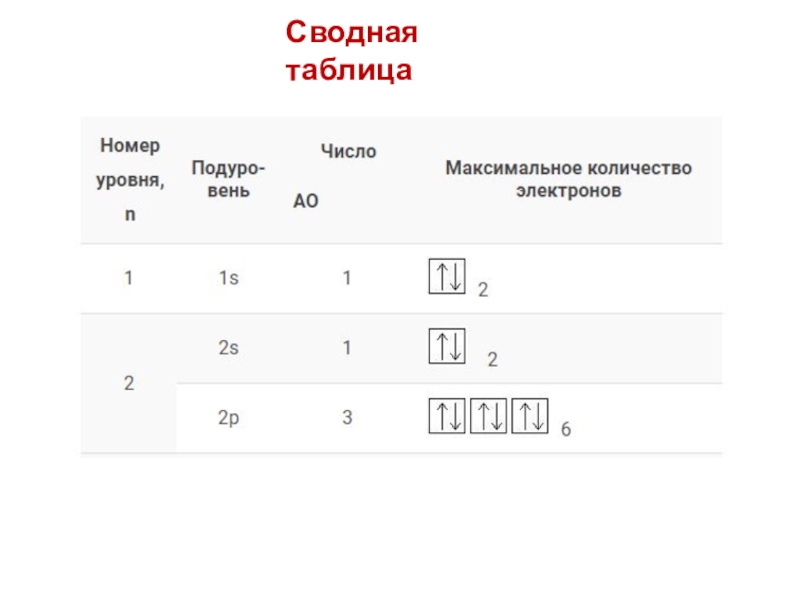
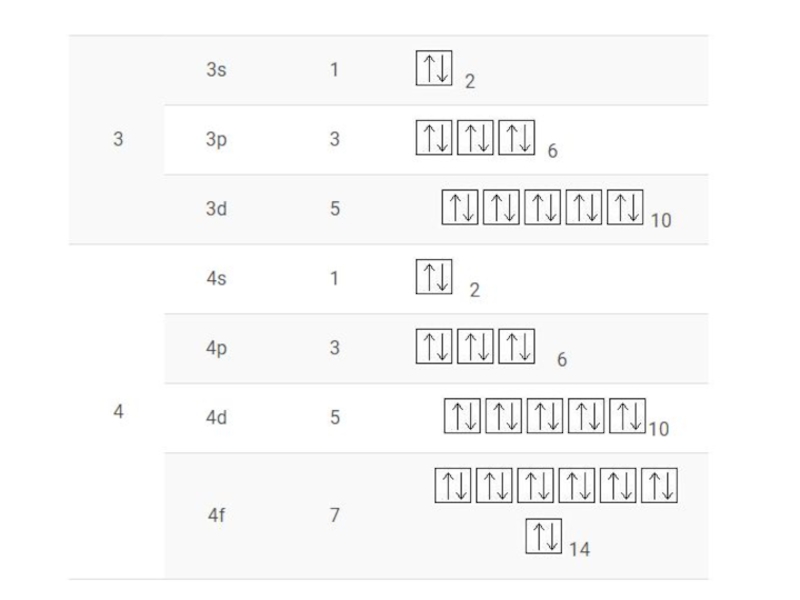
- 20. Сводная таблица
- 21. Слайд 21
- 22. Слайд 22
- 23. Принцип минимума энергии. Электроны заполняют сначала орбитали с
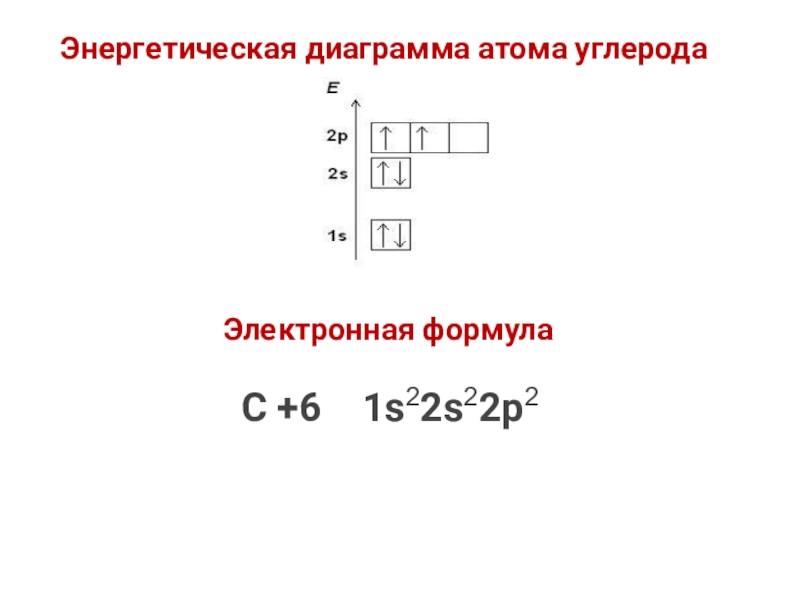
- 24. Энергетическая диаграмма атома углеродаЭлектронная формула С +6 1s22s22p2
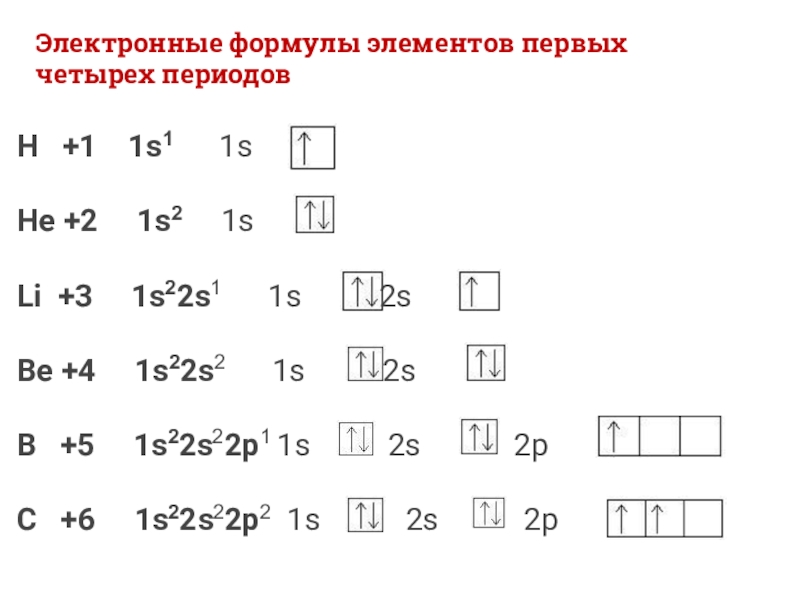
- 25. Электронные формулы элементов первых четырех периодовH
- 26. Ne +10 1s22s22p6
- 27. А вот начиная с 19-го элемента, калия, заполняется не
- 28. У элемента 21, скандия, согласно энергетическому ряду орбиталей,
- 29. Основное и возбужденное состояние атома бора B
- 30. Электронные формулы ионовЕсли атом отдаёт электроны, то общий заряд
- 31. В некоторых случаях совершенно разные атомы образуют
- 32. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Атом –
Химический элемент –
Доказательства сложности строения атома:
Открытие рентгеновских лучей
Открытие
радиоактивности
Открытие «катодных лучей» (электронов)
Изучение явления радиоактивности
Слайд 3Модели строения атома
Пудинг с изюмом (1902-04 гг) Кельвин, Томсон)
Планетарная (1907-13
гг) Резерфорда-Бора
Модель Бора-Зоммерфельда (1913 г)
Квантово-механическая модель, опирающаяся на протонно-нейтронную теорию
ядра (совр.) Шредингер, Гейзенберг, Бор и др.Слайд 10Обратите внимание! При решении задач ЕГЭ среднее значение относительной атомной массы
всех атомов, кроме хлора, округляется до целого по правилам математики.
Среднее значение относительной атомной массы атома хлора в ЕГЭ принято считать равным 35,5.Среднее значение относительной атомной массы с учетом распространенности изотопов
Слайд 11Порядковый номер химического элемента в Периодической таблице –
Массовое число
–
Номер периода –
Номер группы для элементов главных и
побочных подгрупп -Чего следует ожидать при изменении
числа элементарных частиц в атоме?
Для чего можно использовать эти данные?
Составим схему строения атома одного из элементов малых периодов, например, серы.
Слайд 12Изменение числа протонов- появление нового элемента.
Изменение числа нейтронов – появление
изотопов одного и того же элемента.
Изменение числа электронов – образование
положительных или отрицательных ионов из атомов этого элемента.изобары
изотопы
изотоны
Слайд 14Попробуйте ответить на вопросы:
1. У изотопов одного элемента массовое число
одинаковое или разное?
2. У изотопов одного элемента число протонов одинаковое
или разное?1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
Слайд 153. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число
нейтронов в изотопе хлора-37.
3. Массовое число изотопа брома-81 равно 81. Атомный номер
= заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
Слайд 23Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия
атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если
сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.Слайд 25Электронные формулы элементов первых четырех периодов
H +1 1s1
1s
He +2 1s2 1s
Li +3
1s22s1 1s 2s Be +4 1s22s2 1s 2s
B +5 1s22s22p1 1s 2s 2p
C +6 1s22s22p2 1s 2s 2p
Слайд 26 Ne +10 1s22s22p6 1s
2s 2p
Na+11 1s22s22p63s1 1s 2s 2p
3s У неона завершено заполнение второго энергетического уровня.
У натрия начинается заполнение третьего энергетического уровня.
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня.
Слайд 27А вот начиная с 19-го элемента, калия, заполняется не 3d-орбиталь, а 4s.
Заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей,
а не по порядку.Таким образом, формула калия:
K +19 1s22s22p63s23p64s1
1s 2s 2p 3s 3p 4s
У кальция 4s-подуровень заполнен:
Ca +20 1s22s22p63s23p64s2
1s 2s 2p 3s 3p 4s
Слайд 28У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
Sc
+21 1s22s22p63s23p63d14s2
3d
4s Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия.
Однако, у хрома порядок заполнения орбиталей нарушается.
Электронная конфигурация хрома такая:
Cr +24 [Ar]3d54s1 [Ar] 3d 4s
Этот эффект так и называется —провал или проскок
электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
Слайд 29Основное и возбужденное состояние атома бора
B +5 1s22s22p1
1s 2s 2p
B* +5 1s22s12p2
1s
2s 2p Слайд 30Электронные формулы ионов
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним,
что число протонов в атоме равно числу электронов, а при
отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:Na +11 1s22s22p63s1 -1е = Na+ +11 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
Cl +17 1s22s22p63s23p5 +1e = Cl— +17 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Слайд 31В некоторых случаях совершенно разные атомы образуют ионы с одинаковой
электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом
электронов называют изоэлектронными частицами.Например, ионы Na+ и F—.
Электронная формула катиона натрия:
Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора:
F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.