Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение соединений d - элементов
Содержание
- 1. Строение соединений d - элементов
- 2. Сопоставление подходов для p и dP-элементыD-элементыТеория валентных
- 3. Правило Сиджвика Комплексные соединения d-элементов в малых или
- 4. Основные принципыТипы электронов в комплексных соединениях:Собственные электроны
- 5. Характеристики лигандов3) Формальный заряд – заряд лиганда
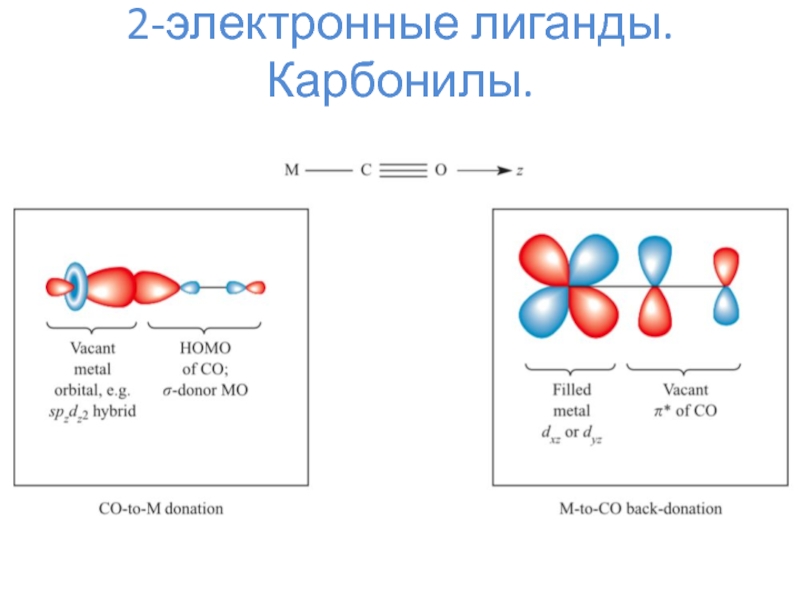
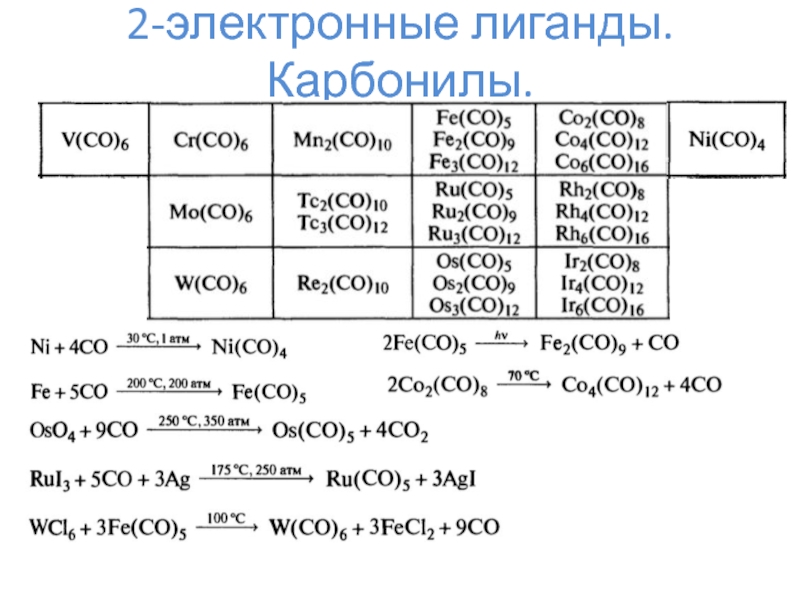
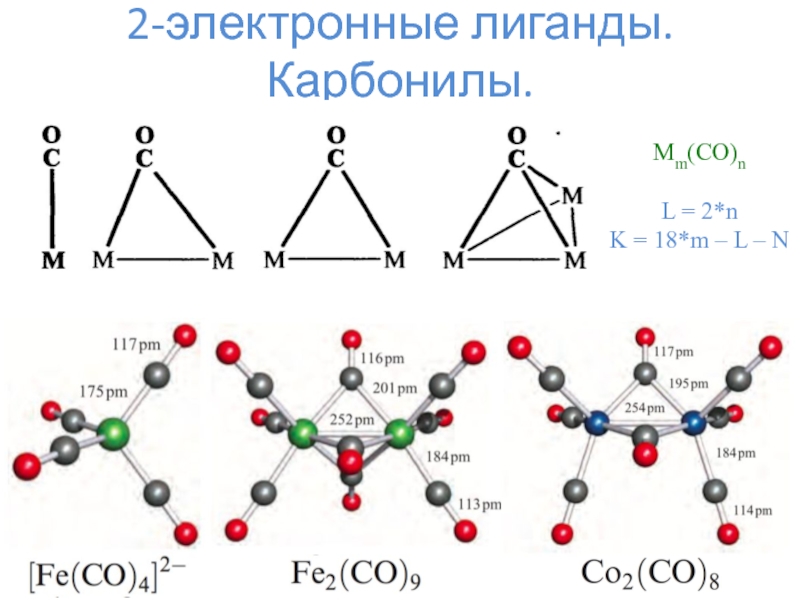
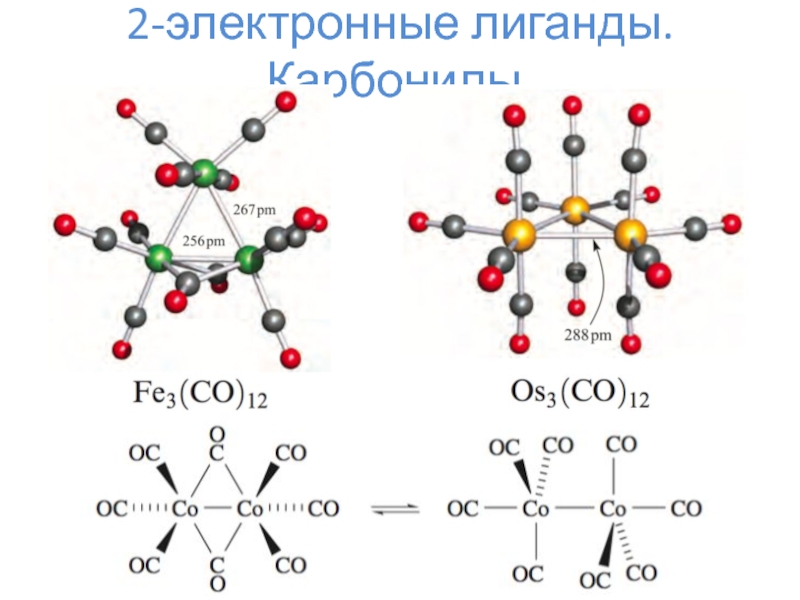
- 6. 2-электронные лиганды. Карбонилы.
- 7. 2-электронные лиганды. Карбонилы.
- 8. 2-электронные лиганды. Карбонилы.Mm(CO)nL = 2*n K = 18*m – L – N
- 9. 2-электронные лиганды. Карбонилы.
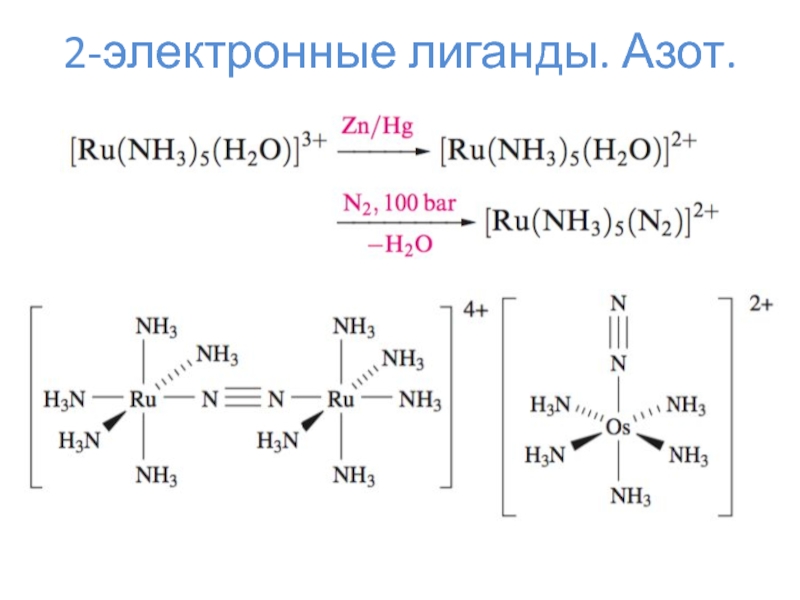
- 10. 2-электронные лиганды. Азот.
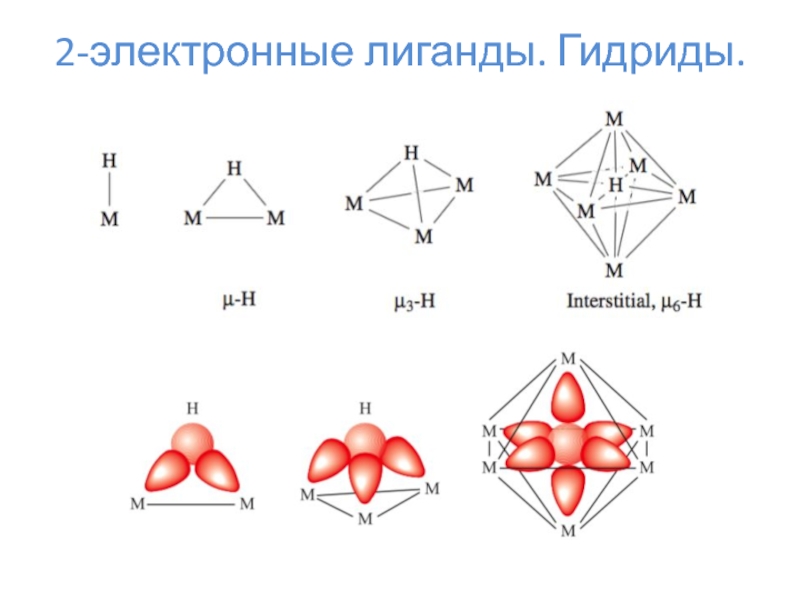
- 11. 2-электронные лиганды. Гидриды.
- 12. 2-электронные лиганды. Гидриды.
- 13. 2-электронные π-лиганды
- 14. Нитрозильные комплексыЛинейныеИзогнутыеZ = +1Z = -1
- 15. 2-электронные π-лиганды4-электронный аллильный лиганд Комплексы с конфигурацией d8 (если заряд металла положительный) - 16-электронные!!!
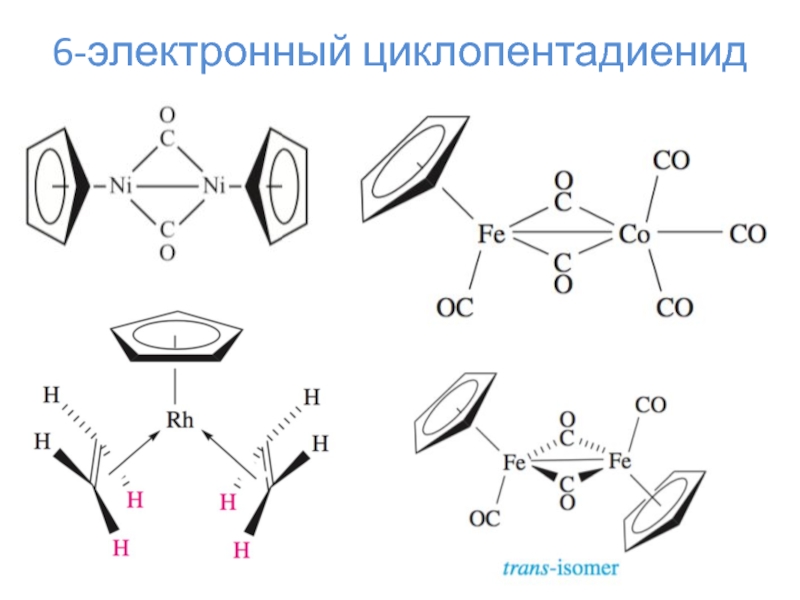
- 16. 6-электронный циклопентадиенидL = 6*n
- 17. 6-электронный циклопентадиенид
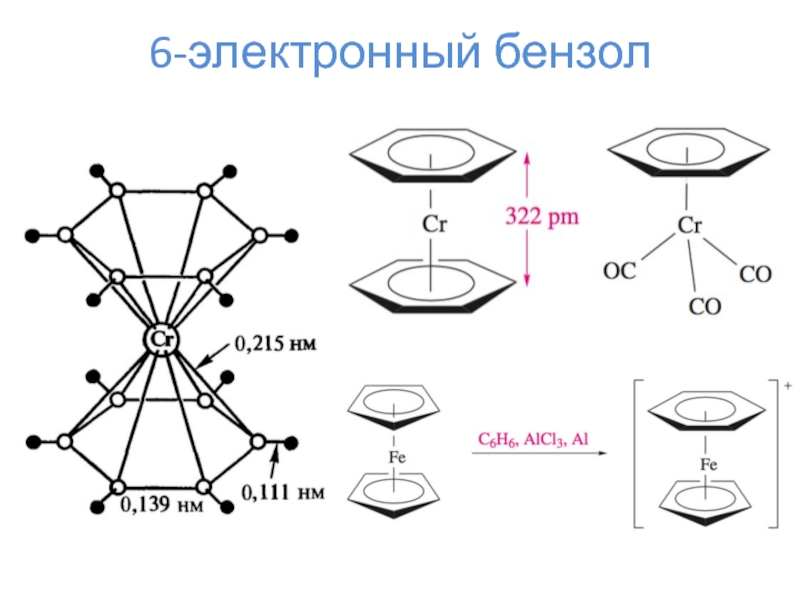
- 18. 6-электронный бензол
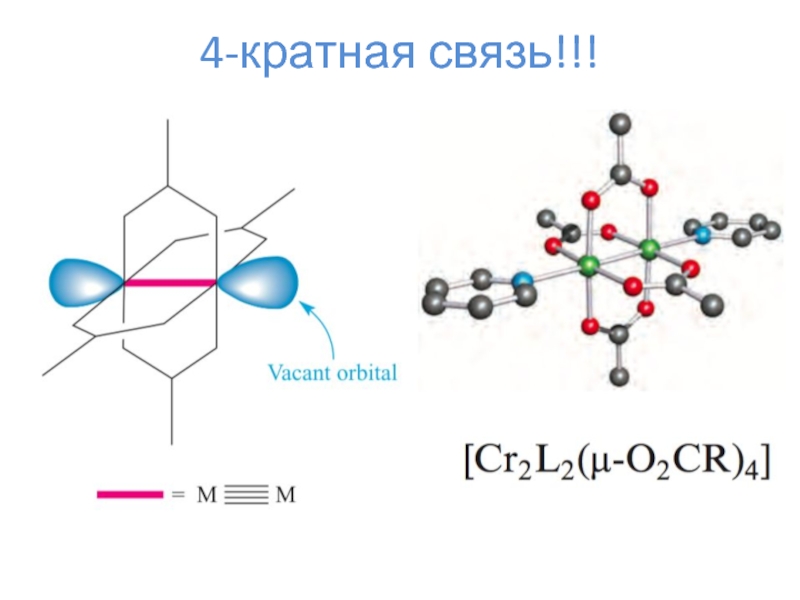
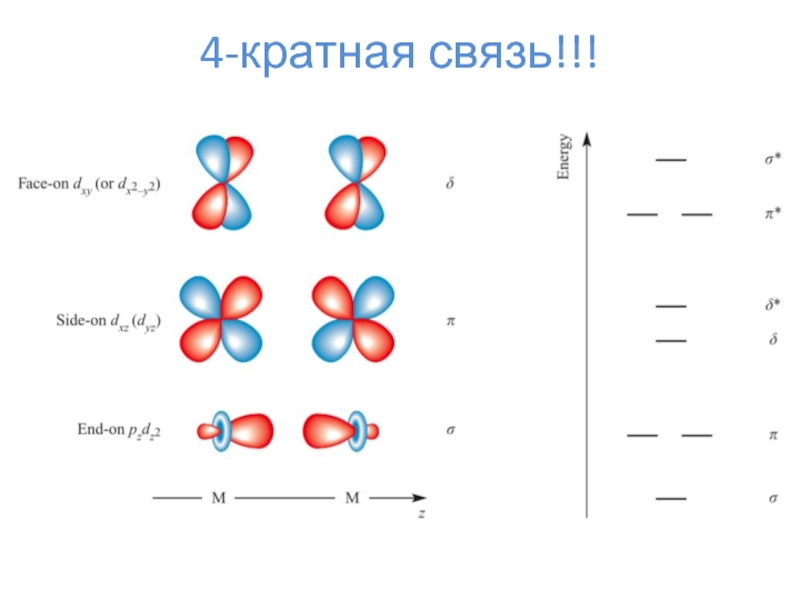
- 19. 4-кратная связь!!!
- 20. 4-кратная связь!!!
- 21. Давайте посчитаемHRe3(CO)14Mn2(CO)7(NO)3[H2Re4(CO)12]2-[HCr2(CO)10]-MoCp2H2[Fe(CN)5(NO)]2-[VCp(CO)4][Co3(CO)10]-
- 22. Позволяет предсказать магнитные свойства (число неспаренных электронов)Позволяет
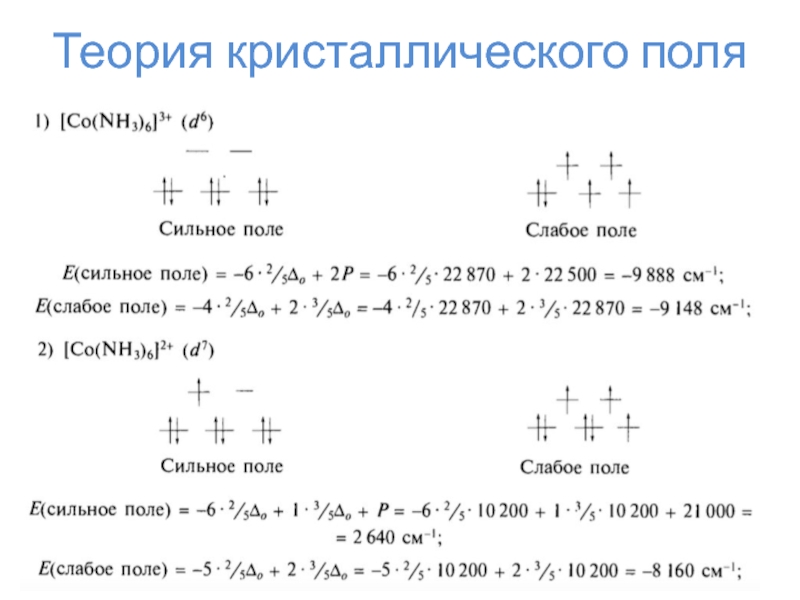
- 23. Теория кристаллического поля
- 24. Теория кристаллического поляΔоЭнергия стабилизации кристаллическим полемЭСКП =
- 25. Теория кристаллического поля
- 26. Теория кристаллического поля
- 27. Теория кристаллического поля
- 28. Теория кристаллического поля
- 29. Теория кристаллического поля
- 30. Теория кристаллического поля
- 31. Теория кристаллического поля
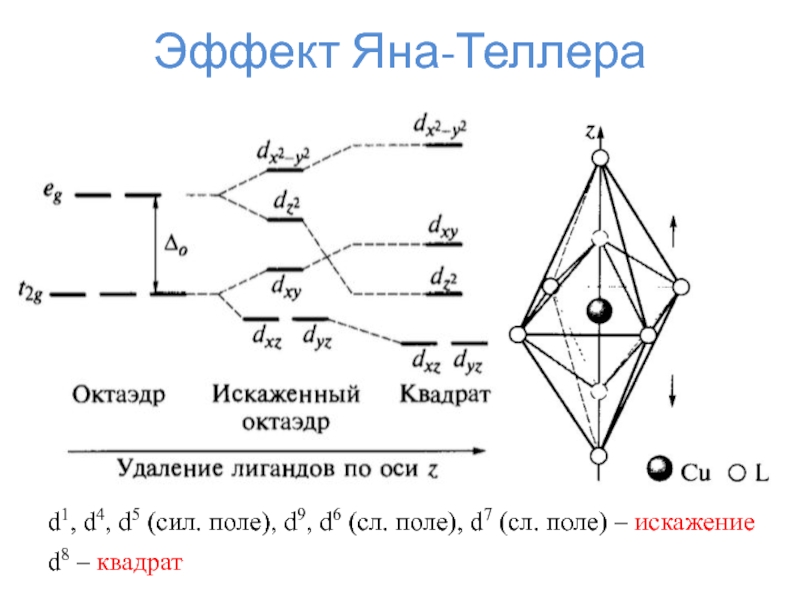
- 32. Эффект Яна-Теллераd1, d4, d5 (сил. поле), d9,
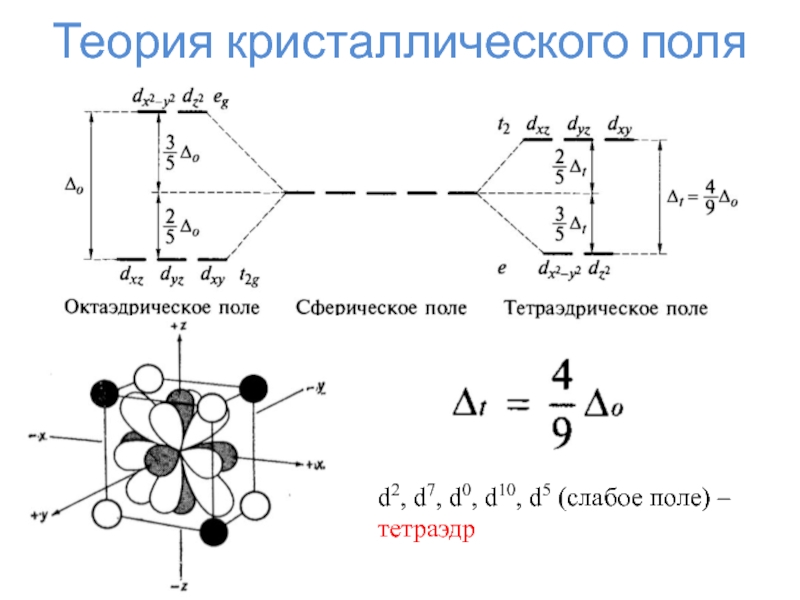
- 33. Теория кристаллического поляd2, d7, d0, d10, d5 (слабое поле) – тетраэдр
- 34. Личные контактыСтраница VK: Никита ШлапаковЭлектронная почта: shlapakovns@gmail.comКонсультации, советы по подготовке химическая литература
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Строение соединений
d-элементов
Лекцию подготовил: Шлапаков Никита, студент 6 курса Химического
факультета МГУ.
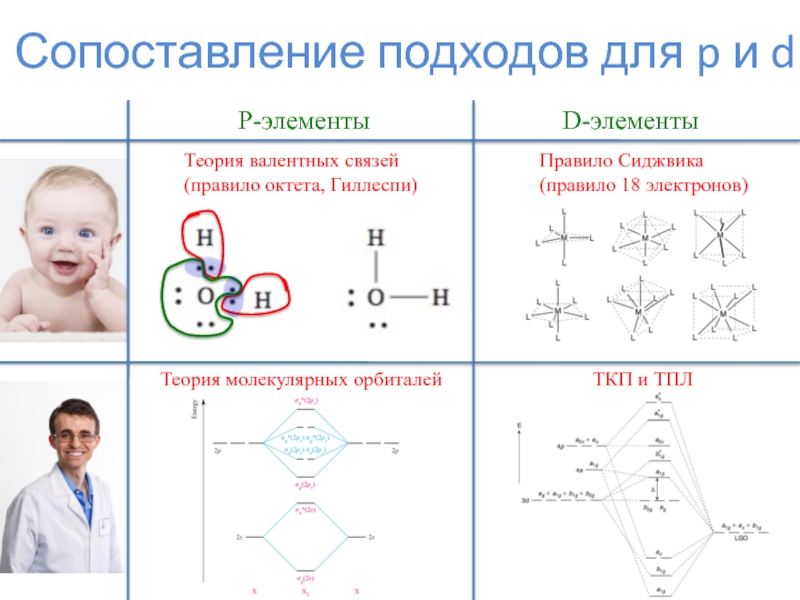
Слайд 2Сопоставление подходов для p и d
P-элементы
D-элементы
Теория валентных связей
(правило октета, Гиллеспи)
Правило
Сиджвика (правило 18 электронов)
Теория молекулярных орбиталей
ТКП и ТПЛ
Слайд 3Правило Сиджвика
Комплексные соединения d-элементов в малых или отрицательных степенях окисления
предпочитают лигандное окружение, обеспечивающее 18-электронное заполнение внешней оболочки.
!!! Очень плохо
работает для степеней окисления выше 2+ и с лигандами сильного поля. Эти соединения описываются другими приближениями.Слайд 4Основные принципы
Типы электронов в комплексных соединениях:
Собственные электроны центральных атомов (d-металлов),
не задействованные в связях (N)
Пары электронов от присоединённых лигандов (L)
Обобществлённые
электроны от кластерных связей М-М (K)Предсказания реакционной способности:
Для каждого атома соблюдается N+L+K=18 – соединение стабильно
Есть атомы металла, для которых N+L+K<18 – соединение является окислителем
Есть атомы металла, для которых N+L+K>18 – соединение является восстановителем
Количество кластерных связей зависит от значений N и L. Обычно, всегда образуется столько связей, чтобы N+L+K=18
Слайд 5Характеристики лигандов
3) Формальный заряд – заряд лиганда в свободном состоянии
4)
Мостиковость – количество атомов металла, с которыми связан лиганд (μ)
1)
Дентантность – количество пар электронов, предоставляемое лигандом2) Гаптность – количество атомов лиганда, участвующих в связывании с металлом (η)
2-электронные лиганды – CO, N2, NO+, H–, PR3, алкены и прочее
4-электронные лиганды – циклобутадиен, бутадиен, аллил
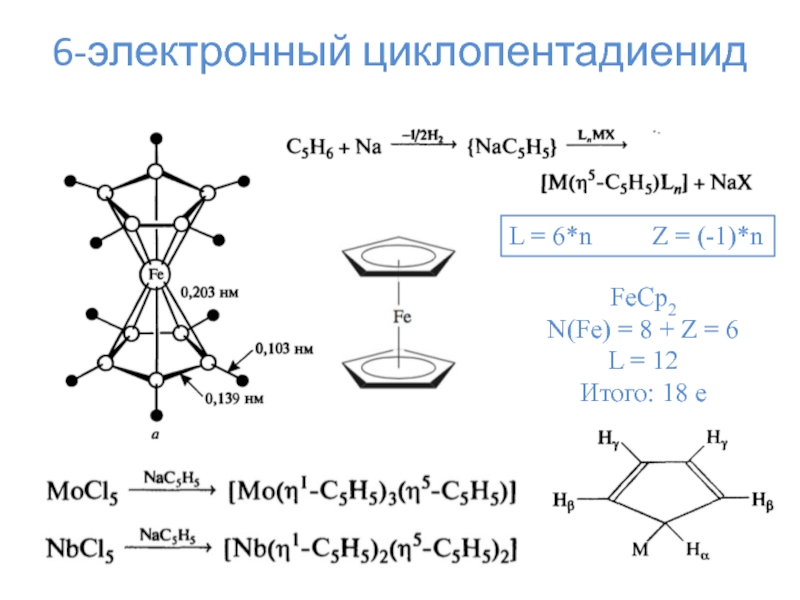
6-электронные лиганды – ципендадиенид, бензол, тропилий
8-электронные лиганды - циклооктатетраен
η1 – все привычные лиганды
η2 – алкен
η3 – аллил
η4 – бутадиен, циклобутадиен
η5 – циклопентадиенид
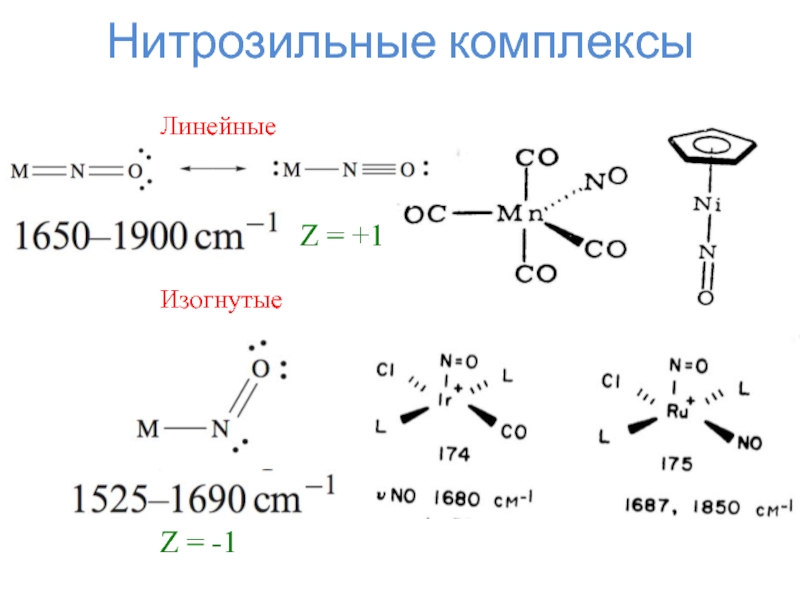
–1 – циклопентадиенид, аллил, галогенид
0 – все основные лиганды
+1 – нитрозил, тропилий
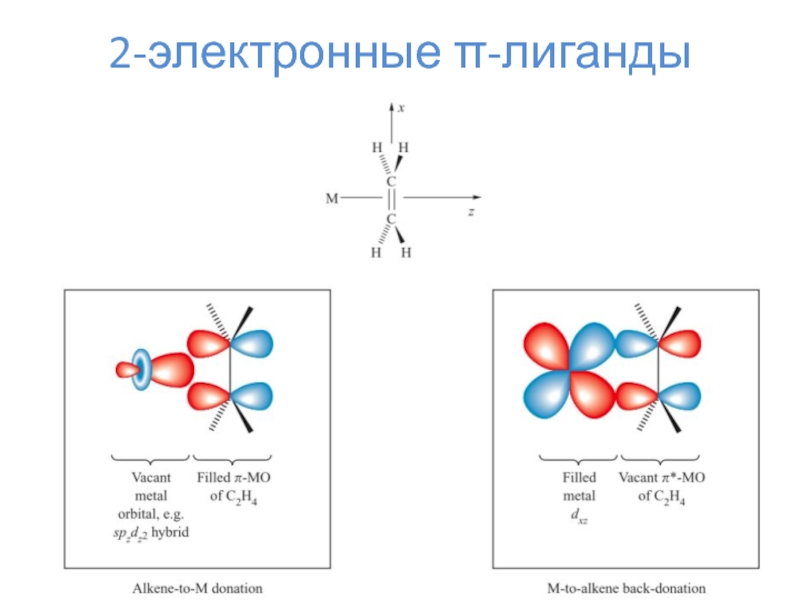
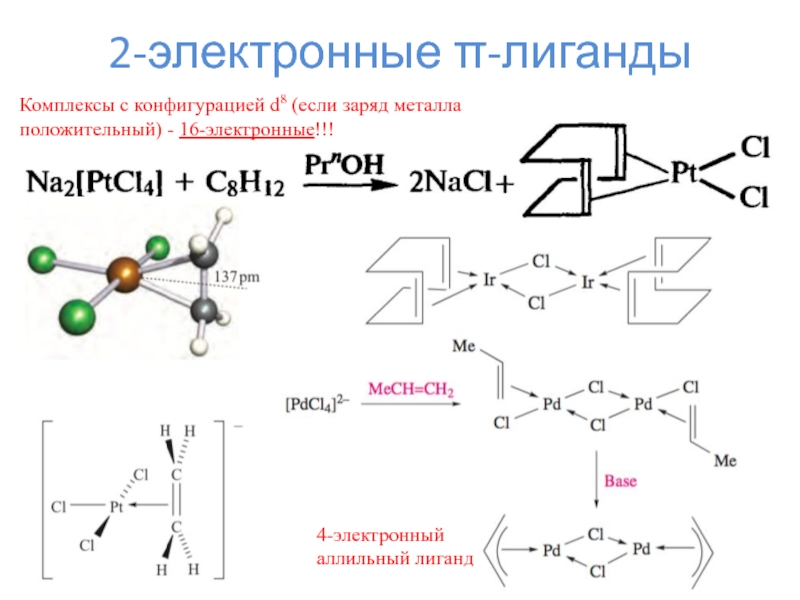
Слайд 152-электронные π-лиганды
4-электронный
аллильный лиганд
Комплексы с конфигурацией d8 (если заряд металла
положительный) - 16-электронные!!!
Слайд 21Давайте посчитаем
HRe3(CO)14
Mn2(CO)7(NO)3
[H2Re4(CO)12]2-
[HCr2(CO)10]-
MoCp2H2
[Fe(CN)5(NO)]2-
[VCp(CO)4]
[Co3(CO)10]-
Слайд 22Позволяет предсказать магнитные свойства (число неспаренных электронов)
Позволяет оценить устойчивость комплекса
и его реакционноспособность
Позволяет сравнить устойчивость октаэдрического и тетраэдрического окружения
Позволяет предсказать
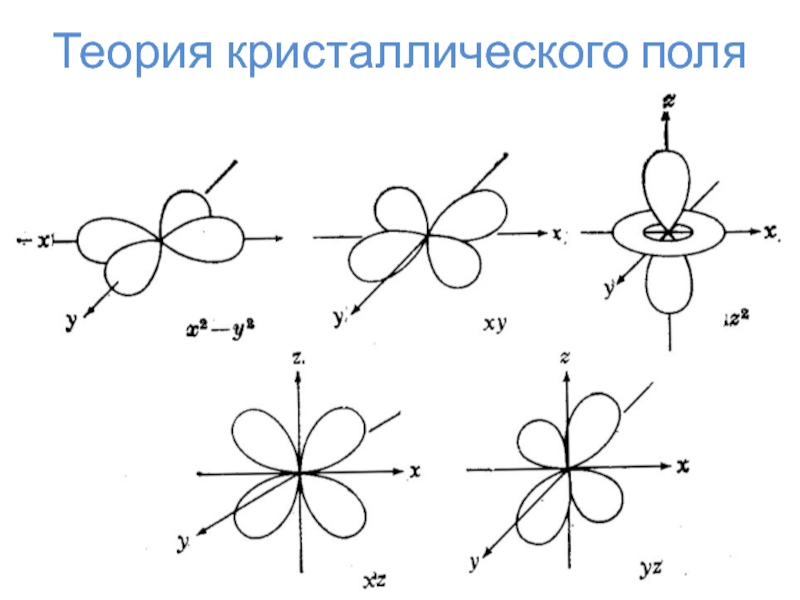
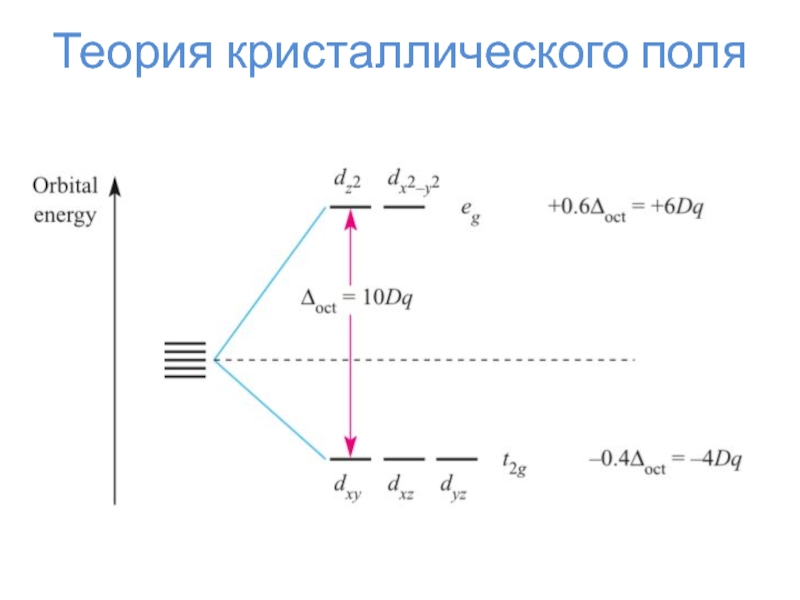
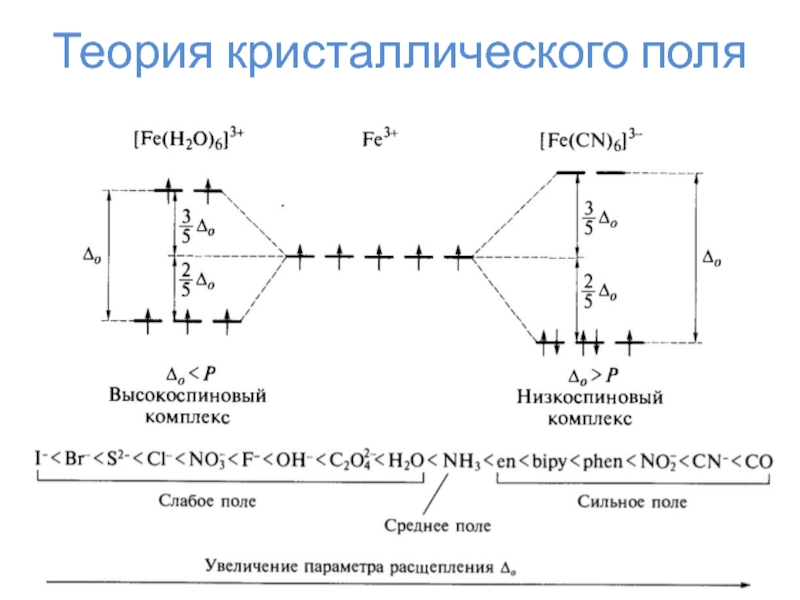
искажение формы комплекса по определённой осиТеория кристаллического поля
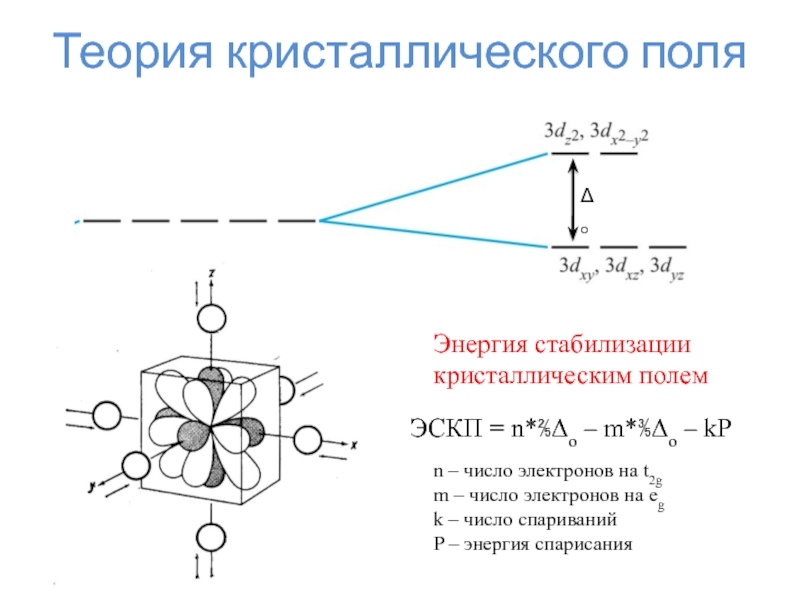
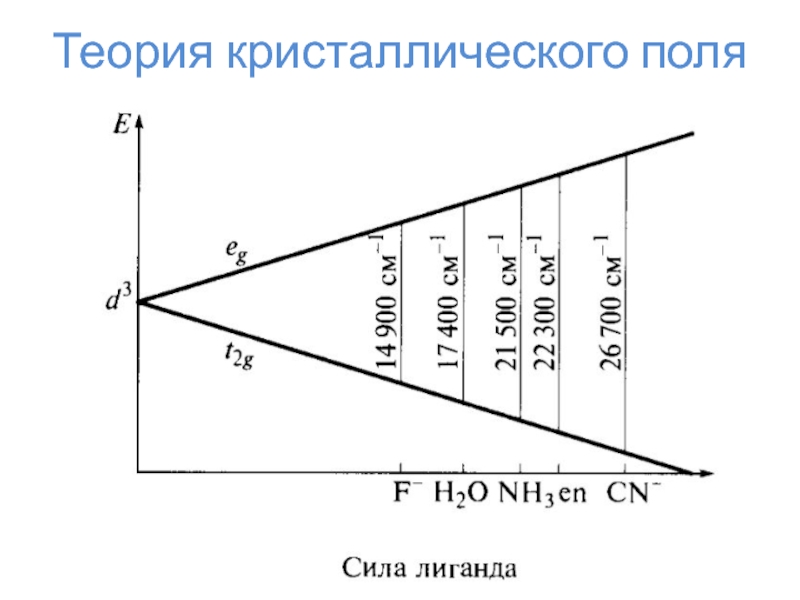
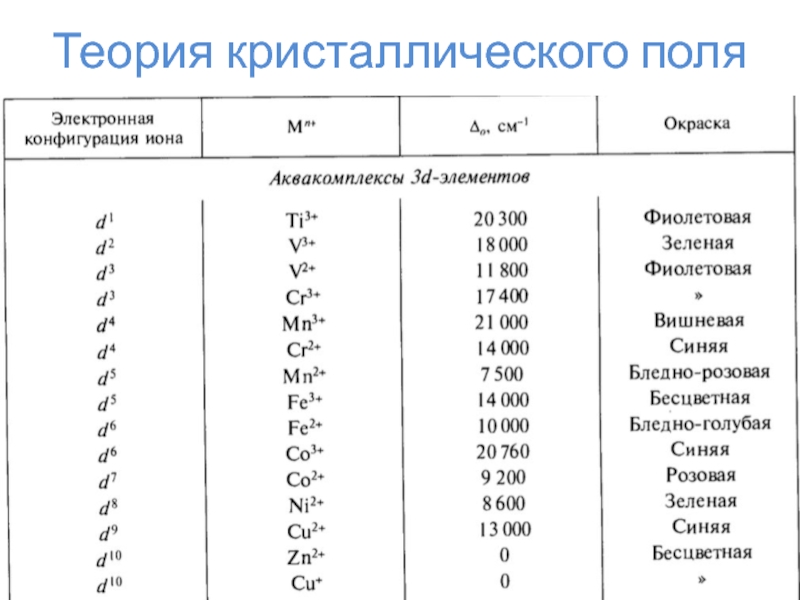
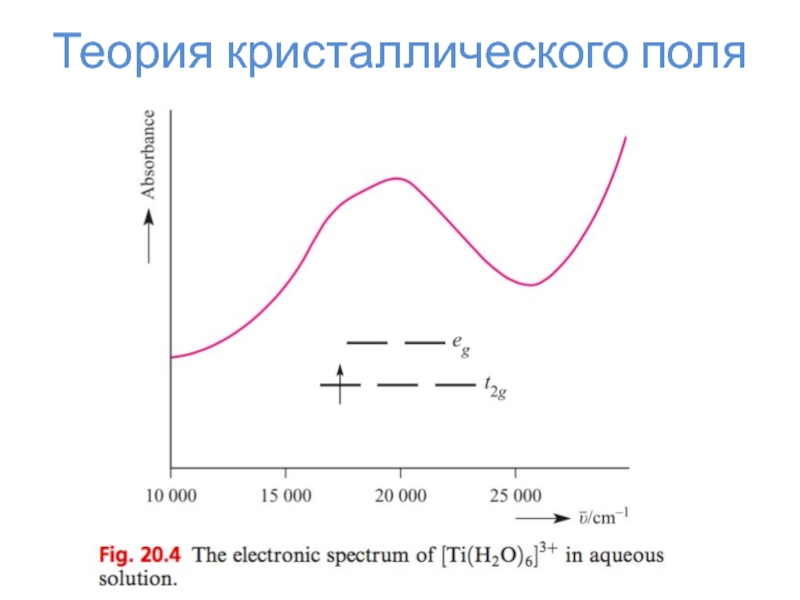
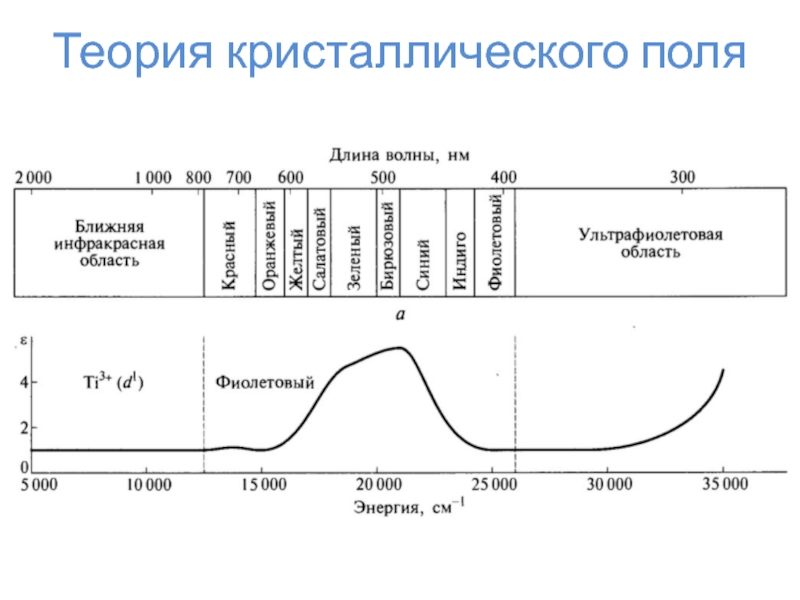
Слайд 24Теория кристаллического поля
Δо
Энергия стабилизации
кристаллическим полем
ЭСКП = n*⅖Δо – m*⅗Δо
– kP
n – число электронов на t2g
m – число
электронов на egk – число спариваний
P – энергия спарисания




![Строение соединений d - элементов Давайте посчитаемHRe3(CO)14Mn2(CO)7(NO)3[H2Re4(CO)12]2-[HCr2(CO)10]-MoCp2H2[Fe(CN)5(NO)]2-[VCp(CO)4][Co3(CO)10]- Давайте посчитаемHRe3(CO)14Mn2(CO)7(NO)3[H2Re4(CO)12]2-[HCr2(CO)10]-MoCp2H2[Fe(CN)5(NO)]2-[VCp(CO)4][Co3(CO)10]-](/img/thumbs/ab249096eaa1d9b8378616c75224e719-800x.jpg)