Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА ЛЕКЦИЯ
Содержание
- 1. СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА ЛЕКЦИЯ
- 2. Строение ядра. Электроны
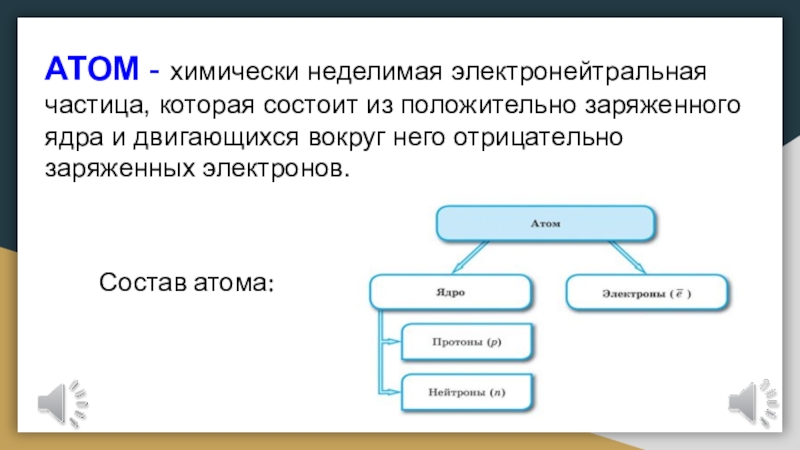
- 3. АТОМ - химически неделимая электронейтральная частица, которая
- 4. Состояние электронов в атомеПод состоянием электрона в
- 5. Состояние
- 6. Слайд 6
- 7. Обозначения и порядок заполнения орбиталей
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Наименьшей энергией обладают электроны первого энергетического уровня,
- 16. Подуровни принято обозначать латинскими буквами, равно как
- 17. По сравнению с электронами первого уровня, электроны
- 18. В зависимости от того, какой подуровень атома
- 19. s-элементыЭлектронами заполняется s-подуровень внешнего уровня атома; к
- 20. р-элементыЭлектронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III— VIII групп
- 21. d-элементыЭлектронами заполняется d-подуровень предвнешнего уровня атома; к
- 22. f-элементыЭлектронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
- 23. Протоны и нейтроны
- 24. Слайд 24
- 25. Элементарные частицы
- 26. Сумма числа протонов и нейтронов в атоме
- 27. Пример:
- 28. Изотопы
- 29. Разновидности атомов одного и того же элемента,
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. СПАСИБО ЗА ВНИМАНИЕ!
- 34. Скачать презентанцию
Строение ядра. Электроны
Слайды и текст этой презентации
Слайд 3АТОМ - химически неделимая электронейтральная частица, которая состоит из положительно
заряженного ядра и двигающихся вокруг него отрицательно заряженных электронов.
Состав атома:Слайд 4Состояние электронов в атоме
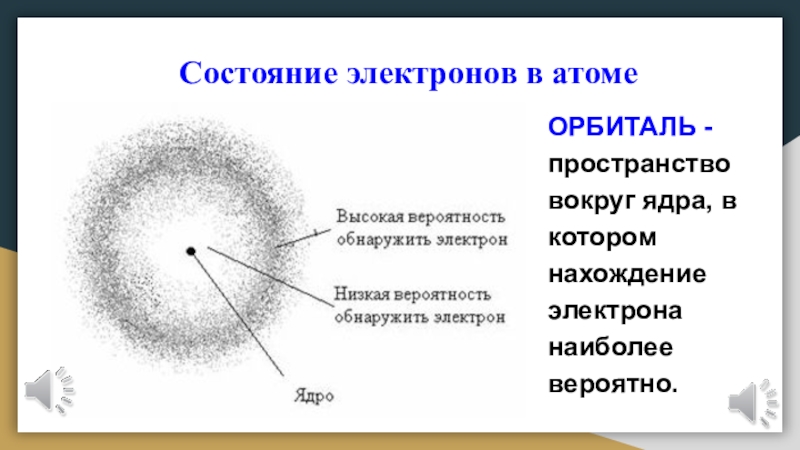
Под состоянием электрона в атоме понимают совокупность
информации об энергии определенного электрона и пространстве, в котором он
находится.Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
Слайд 5 Состояние электронов в атоме
ОРБИТАЛЬ
- пространство вокруг ядра, в котором нахождение электрона наиболее вероятно.
Слайд 8
Квантовые числа
Важнейшей характеристикой движения
электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра,— 1, 2, 3, 4, 5, 6, 7.
Электронная орбиталь каждого электрона в атоме называется атомной орбиталью (АО), в молекуле – молекулярной орбиталью (МО).
Слайд 9
Квантовые числа
Полное описание состояния электронного
облака возможно лишь при определенных значениях квантовых чисел:Главное квантовое число n
Орбитальное (побочное) квантовое число l (ln )
Магнитное квантовое число m (ml )
Спиновое квантовое число S(ms )
Слайд 10
Главное квантовое число
Главное квантовое число
(n) определяет основной запас энергии электрона, т.е. степень его удаления от ядра или размер электронного облака (орбитали). Оно принимает любые целочисленные значения, начиная с единицы.
Для реально существующих атомов в основном состоянии n = 1÷7.
Слайд 11
Орбитальное квантовое число
Орбитальное (побочное) квантовое число l определяет орбитальный
момент количества движения электрона и характеризует форму электронного облака. Оно может принимать целочисленные значения от 0 до (n-1).
Для реально существующих атомов в основном состоянии l принимает значение 0,1,2,3.
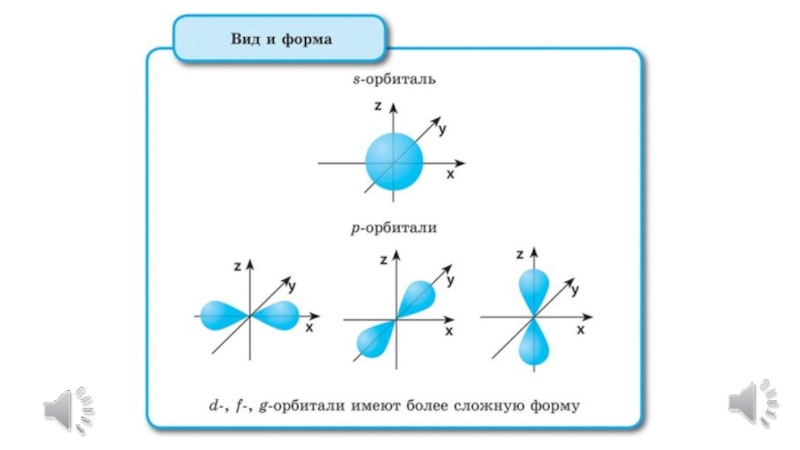
Каждому значению l соответствует орбиталь особой формы.
При l=0 атомная орбиталь, независимо от значения главного квантового числа, имеет сферическую форму (S-орбиталь).
Значению l=1 соответствует атомная орбиталь, имеющая форму гантели (p- орбиталь).
Более сложные формы у d- и f-орбиталей (l=2, l=3).
Слайд 12
Магнитное квантовое число
Магнитное квантовое число определяет значение проекции орбитального
момента количества движения электрона на произвольно выделенную ось, т.е. характеризует пространственную ориентацию электронного облака. Оно принимает все целочисленные значения от –l до +l, в том числе значение 0.
Слайд 13
Спиновое квантовое число
Спиновое квантовое число S(ms) характеризует собственный механический
момент электрона, связанный с вращением его вокруг своей оси. Оно имеет только два значения +1/2 и –1/2.
Слайд 15Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к
ядру.
Начиная со второго энергетического уровня (n=2) каждый из уровней
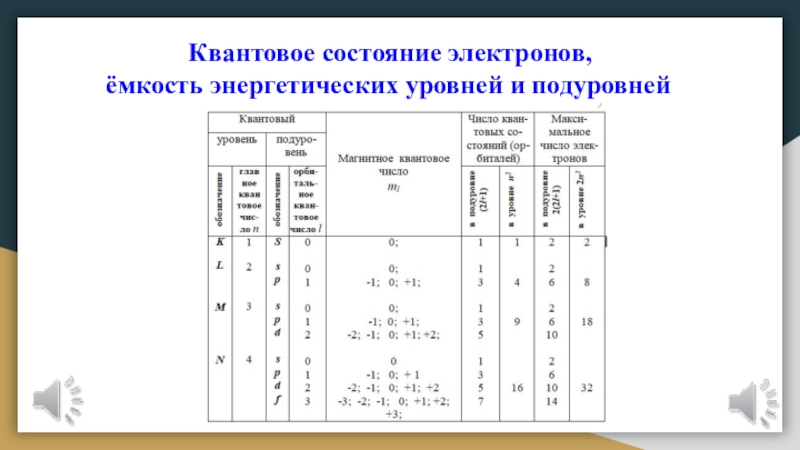
подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа:
первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня.
Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
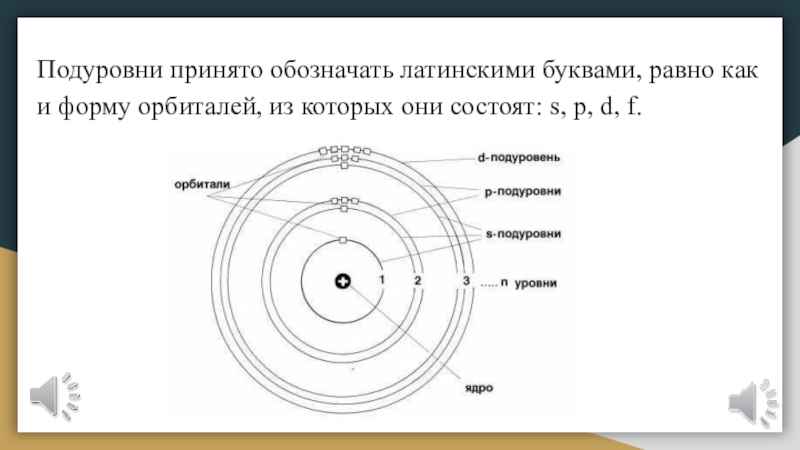
Слайд 16Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей,
из которых они состоят: s, p, d, f.
Слайд 17По сравнению с электронами первого уровня, электроны последующих уровней будут
характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром
атома электроны внешнего уровня.Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n2,
где N — максимальное число электронов; n — номер уровня, или главное квантовое число.
Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более 8; на третьем — не более 18; на четвертом — не более 32.
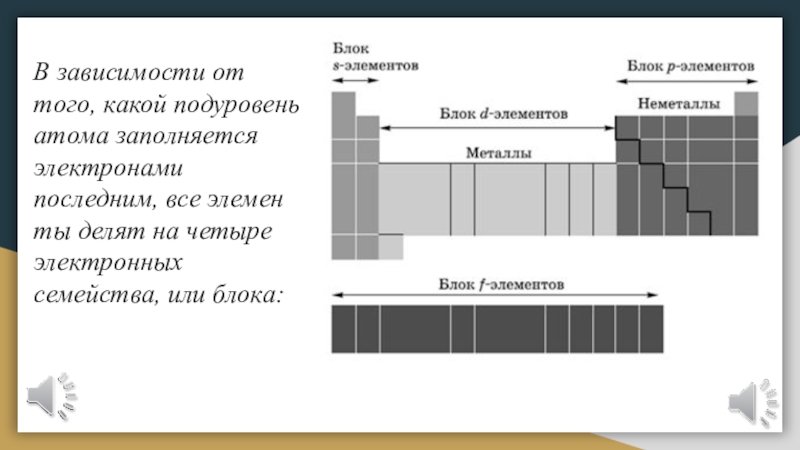
Слайд 18В зависимости от того, какой подуровень атома заполняется электронами последним,
все элементы делят на четыре электронных семейства, или блока:
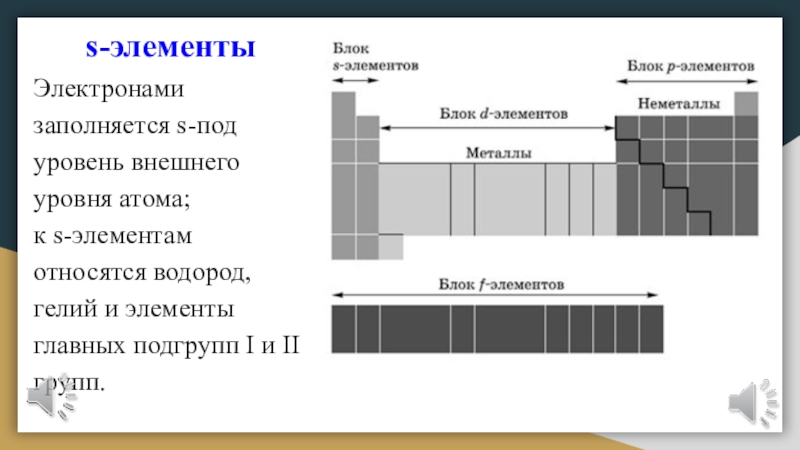
Слайд 19s-элементы
Электронами заполняется s-подуровень внешнего уровня атома;
к s-элементам относятся водород,
гелий и элементы главных подгрупп I и II групп.
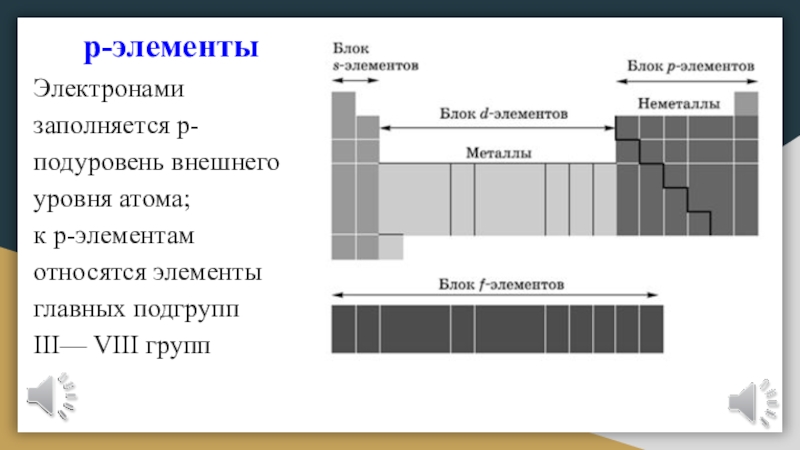
Слайд 20р-элементы
Электронами заполняется р-подуровень внешнего уровня атома;
к р-элементам относятся элементы
главных подгрупп
III— VIII групп
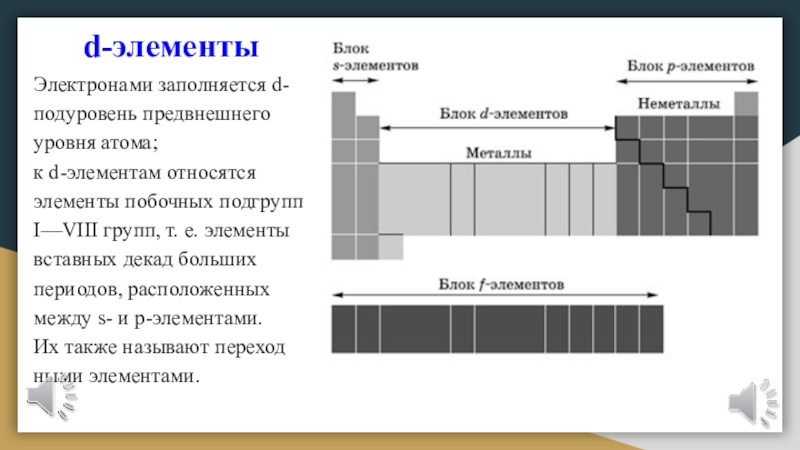
Слайд 21d-элементы
Электронами заполняется d-подуровень предвнешнего уровня атома;
к d-элементам относятся элементы
побочных подгрупп I—VIII групп, т. е. элементы вставных декад больших
периодов, расположенных между s- и р-элементами.Их также называют переходными элементами.
Слайд 22f-элементы
Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся
лантаноиды и актиноиды.
Слайд 24
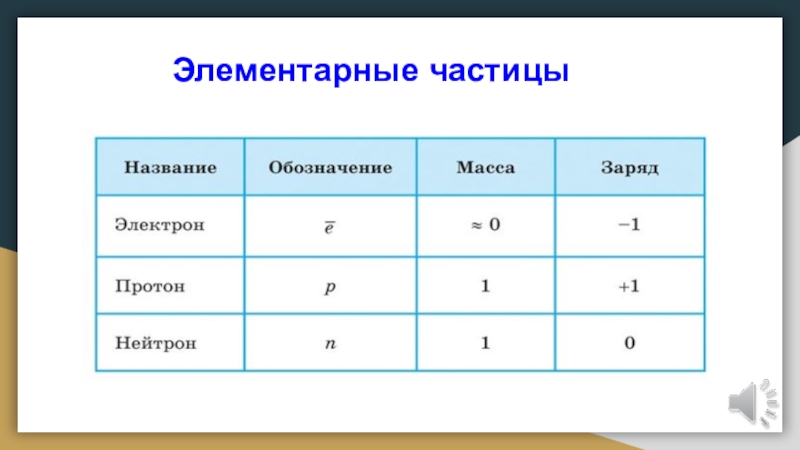
Протоны и нейтроны
Атом любого химического элемента сравним с
крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу).
Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
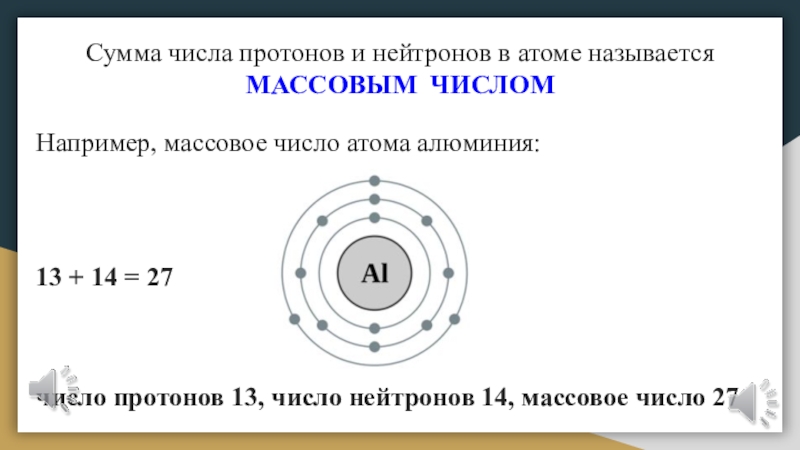
Слайд 26Сумма числа протонов и нейтронов в атоме называется
МАССОВЫМ ЧИСЛОМ
Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Слайд 29Разновидности атомов одного и того же элемента, имеющие одинаковый заряд
ядра, но разное массовое число, называются ИЗОТОПАМИ.
Химические элементы, встречающиеся в
природе, являются смесью изотопов. Химические свойства изотопов большинства химических элементов совершенно одинаковы.
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.