Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОРГАНИЧЕСКАЯ ХИМИЯ
Содержание
- 1. ОРГАНИЧЕСКАЯ ХИМИЯ
- 2. Лекция № 1 Тема: «Введение.
- 3. 1. Предмет и задачи органической
- 4. В состав орг.
- 5. 2. Роль русских ученых в
- 6. Зинин Николай Николаевич (1812-1880), русский химик-органик, академик
- 7. Марковников Владимир Васильевич (1837-1904),
- 8. Зайцев Александр Михайлович(1841-1910), русский
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Несмеянов Александр Николаевич (1899-1980),
- 13. 3. Теория строения орг. соединений А.М.Бутлерова. Гибридизация
- 14. 2. Атомы в молекулах орг. веществ соединяются
- 15. 3. Свойства орг.соединений зависят
- 16. 4. Атомы в молекулах орг. соединений
- 17. Слайд 17
- 18. Схема образования SP3-гибридных орбиталей (первое валентное состояние
- 19. Схема образования SP2-гибридных орбиталей (второе валентное состояние
- 20. Отличие от sp3
- 21. Схема образования SP-гибридных орбиталей (третье
- 22. В результате образуются две равноценные гибридные
- 23. 4. Классификация органических соединений.
- 24. Классификация соединений по строению
- 25. Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью.
- 26. Слайд 26
- 27. Слайд 27
- 28. Циклические соединения - соединения с замкнутой углеродной цепью.
- 29. Слайд 29
- 30. Гетероциклические соединения - содержат в цикле, кроме
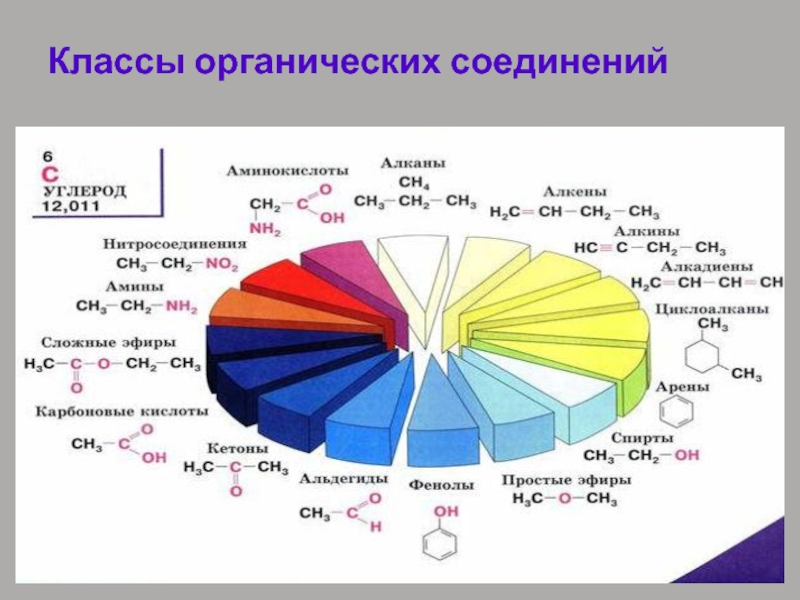
- 31. Классификация соединений по функциональным группам Соединения,
- 32. Классы органических соединений
- 33. Слайд 33
- 34. В состав молекул органических соединений могут
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Изомерия Атомы углерода в молекулах алканов
- 39. Номенклатура Для названия алканов с разветвлённой
- 40. Радикалы :
- 41. Слайд 41
- 42. Слайд 42
- 43. 2. Методы синтеза алканов.Для получения алканов используют
- 44. 3. Щелочной гидролиз солей карбоновых кислот
- 45. 3.
- 46. 1. Реакции галогенирования Галогенирование – это
- 47. При достаточном количестве хлора реакция продолжается дальше
- 48. При хлорировании или бромировании алкана с вторичными
- 49. 2. Реакция нитрования алканов (реакция
- 50. 3. Реакции горения алканов Горение
- 51. 4. Реакция дегидрирования алканов
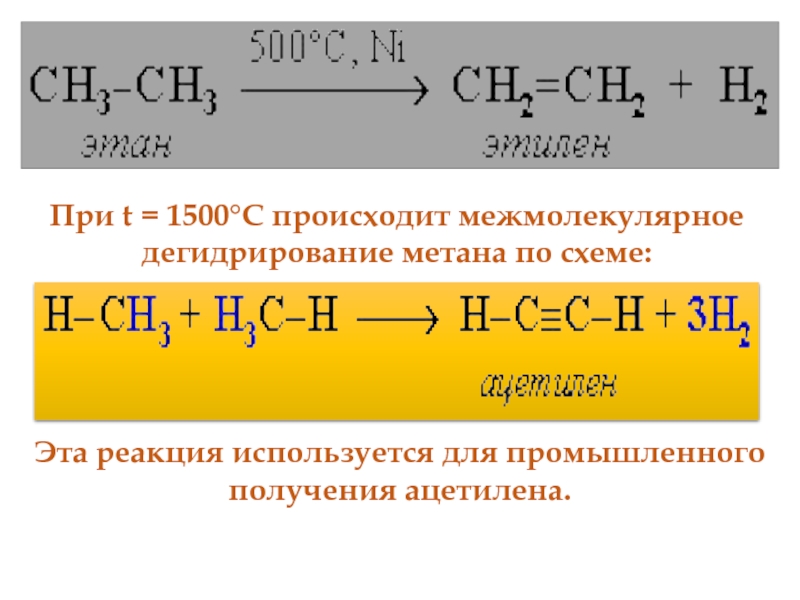
- 52. При t = 1500°С происходит межмолекулярное дегидрирование
- 53. 4. Отдельные представители.
- 54. Вазелиновое масло – смесь
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Лекция № 1 Тема: «Введение. Теория строения органических соединений А.М.Бутлерова» План: 1. Предмет
и задачи органической химии. Значение орг. химии для медицины и
фармации. 2. Роль русских ученых в становлении и развитии органической химии. 3. Теория строения орг. соединений А.М.Бутлерова. Гибридизация атома углерода. Виды гибридизации. 4. Классификация органических соединений.Слайд 3 1. Предмет и задачи органической химии. Значение орг. химии для
медицины и фармации. Объектом изучения органической химии являются соединения углерода,
называемые органическими веществами. В связи с этим органическую химию называют химией соединений углерода. Первые органические вещества, с которыми познакомился человек, были выделены из растительных и животных организмов или из продуктов их жизнедеятельности, а также каменный уголь, торф, природный газ, нефть. Каждый растительный или животный организм представляет собой своеобразную химическую лабораторию, в которой протекает множество сложнейших реакций, приводящих к образованию огромного числа органических веществ, как весьма простых (например, метан, муравьиная, щавелевая кислоты и т. п.), так и самых сложных (например, алкалоиды, стероиды, белки).Слайд 4 В состав орг. соединений кроме углерода входят и другие элементы,
чаще всего водород, кислород , азот, фосфор, сера. Существуют орг.
соединения в своём составе атомы металлов. Органическая химия способствует развитию смежных отраслей науки как биологии, биохимии, агрохимии, фармации и медицины. 95 % лекарственных веществ имеют органическую природу. Велико значение для фармации органического синтеза, являющегося фундаментом для создания новых эффективных ЛС со специфическим фармакологическим действием.Слайд 5
2. Роль русских ученых в становлении и развитии органической химии.
Бутлеров
Александр Михайлович (1828-1886), русский химик, создатель теории химического строения, глава
крупнейшей казанской школы русских химиков-органиков, общественный деятель. Родился в семье помещика, офицера в отставке — участника Отечественной войны 1812. Первоначальное образование получил в частном пансионе, а затем в гимназии в Казани, в 1844—49 студент Казанского университета. С 1849 - преподаватель Казанского университета, а с 1857 ординарный профессор химии в том же университете. В 1860—63 был дважды его ректором. В 1868—85 профессор химии Петербургского университета. В 1885 вышел в отставку, но продолжал читать в университете специальные курсы лекций. В 1870 был академиком Петербургской АН. В 1878—82 преемник Н. Н. Зинина на посту председателя Отделения химии Русского физико-химического общества. Почётный член многих др. научных обществ в России и за рубежом.Слайд 6Зинин Николай Николаевич (1812-1880), русский химик-органик, академик Петербургской АН с
1865 г. По окончании Казанского университета (1833) преподавал там же
физику и механику. По получении степени магистра химии (1836). В 1837 г. и командирован за границу, где посетил лаборатории и заводы Германии, Франции, Англии; свыше года (1839—40) работал у Ю. Либиха. После защиты докторской диссертации (1841) избран профессором Казанского университета; в 1848—64 профессор Медико-хирургической академии в Петербурге и там же директор химических работ (1864—74).Слайд 7 Марковников Владимир Васильевич (1837-1904), русский химик. Ученик А. М. Бутлерова.
Окончил в 1860 Казанский университет; с 1862 читал там же
лекции (с 1869 профессор). В 1871 вместе с группой передовых учёных ушёл из Казанского университета в знак протеста против увольнения профессора П. Ф. Лесгафта, в 1871—73 профессор Новороссийского университета (в Одессе). С 1873 профессор Московского университета.Слайд 8 Зайцев Александр Михайлович(1841-1910), русский химик-органик, член-корреспондент Петербургской АН (1885). Ученик
А. М. Бутлерова. По окончании Казанского университета работал (1862—65) в
лабораториях Кольбе и Вюрца. В 1870 защитил докторскую диссертацию «Новый способ превращения жирных кислот в соответствующие им алкоголи» и был утвержден профессором Казанского университета.Слайд 9 3елинский Николай Дмитриевич(1861-1953), советский химик-органик, академик АН СССР (1929), один
из основоположников учения об органическом катализе. Герой Социалистического Труда (1945).
В 1884 окончил Новороссийский университет (Одесса), там же защитил магистерскую (1889) и докторскую (1891) диссертации. В 1893—1953 профессор Московского университета, кроме периода 1911—1917, когда он покинул университет вместе с группой учёных в знак протеста против реакционной политики царского министра народного просвещения Л. А. Кассо (в эти годы Зелинский был в Петербурге директором Центральной лаборатории министерства финансов и заведующим кафедрой в Политехническом институте). В 1935 активно участвовал в организации института органической химии АН СССР, в котором затем руководил рядом лабораторий; этот институт с 1953 носит его имя.Слайд 10 Кучеров Михаил Григорьевич (1850-1911), русский химик-органик. В 1871 окончил Петербургский
земледельческий (с 1877 — лесной) институт и работал там же
(до 1910). Основные работы посвящены изучению непредельных углеводородов. В 1881 Кучеров открыл метод гидратации соединений ацетиленового ряда в присутствии ртутных солей (см. Кучерова реакция), за что получил (1885) премию Русского физико-химического общества. Это общество учредило (1915) премию имени Кучерова, присуждавшуюся начинающим исследователям в области химии.Слайд 11 Лебедев Сергей Васильевич (1874-1934), советский химик, академик АН СССР (1932;
член-корреспондент 1928). Ученик А. Е. Фаворского. Гимназическое образование получил в
Варшаве. В 1900 окончил Петербургский университет. С 1902 работал в Петербургском университете, где в 1925 организовал Лабораторию по химической переработке нефти и каменного угля. В 1928—1930 Лебедев заведовал созданной по его инициативе Лабораторией синтетического каучука. В 1934 организовал Лабораторию высокомолекулярных соединений АН СССР.Слайд 12 Несмеянов Александр Николаевич (1899-1980), советский химик-органик, академик АН СССР (1943;
член-корреспондент 1939), общественный деятель, Герой Социалистического Труда (1969). Член КПСС
с 1944. После окончания МГУ (1922) работает там же (с 1935 профессор, с 1944 заведующий кафедрой органической химии, в 1944—48 декан химического факультета, в 1948—51 ректор, руководил организацией строительства МГУ на Ленинских горах). Одновременно работал в институте удобрений и инсектофунгицидов (1930—34), в АН СССР: в институте органической химии (с 1934, в 1939—54 директор), академик-секретарь Химического отделения (1946—51). Президент АН СССР (1951—61), директор института элементоорганических соединений (с 1954), академик-секретарь Отделения общей и органической химии (с 1961). В 1947—1961 председатель Комитета по Ленинским и Государственным премиям в области науки и техники. Принимал деятельное участие в работе Всемирного Совета Мира и Советского комитета защиты мира.Слайд 133. Теория строения орг. соединений А.М.Бутлерова. Гибридизация атома углерода. Виды
гибридизации. Основные положения теории: 1. Атомы в молекулах соединены друг с другом
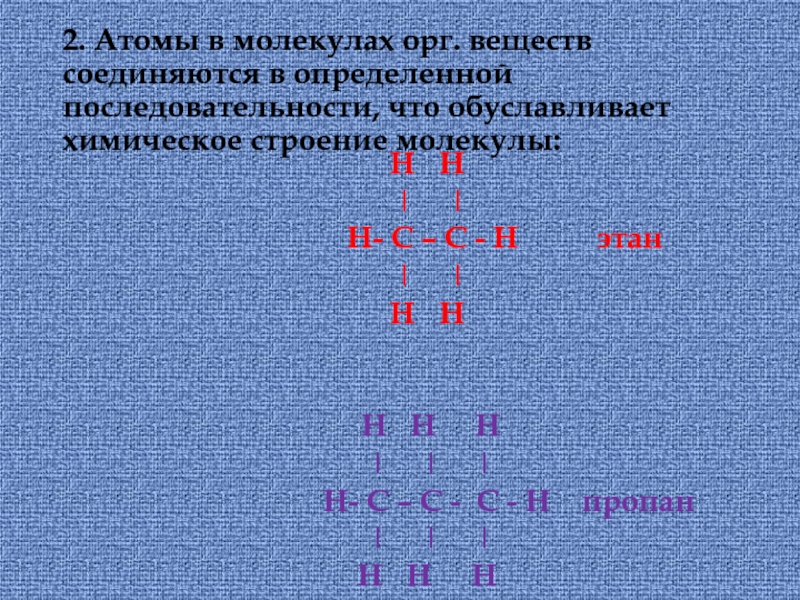
химическими связями в соответствии с их валентностью, : С – IV; Н, Наl, щелочные металлы – I; S, O – II; N – III,V Например: Н ǀ Н- С – Н; ǀ НСлайд 142. Атомы в молекулах орг. веществ соединяются в определенной последовательности,
что обуславливает химическое строение молекулы:
Н
Н
ǀ ǀ
Н- С – С - Н этан
ǀ ǀ
Н НН Н Н ǀ ǀ ǀ Н- С – С - С - Н пропан ǀ ǀ ǀ Н Н Н
Слайд 15 3. Свойства орг.соединений зависят не только от числа и природы
входящих в их состав атомов, но и от химического строения
молекул: а). Изомеры - орг. соединения, имеющие одинаковый количественный и качественный состав, но различное химическое строение: СН3 - СН2 – СН2 –СН3 бутан СН3 - СН –СН3 изобутан ǀ СН3 б). Гомологи – орг. соединения, имеющие сходное химическое строение и качественный состав, но различный количественный состав: СН4 метан Н3С-СН3 этан Н3С- СН2-СН3 пропан СН3 - СН2 – СН2 –СН3 бутанСлайд 16 4. Атомы в молекулах орг. соединений оказывают взаимное влияние друг
на друга. Наибольшее влияние оказывают атомы, непосредственно связанные друг с
другом. Влияние атомов или групп атомов, не связанных непосредственно, ослабевает по мере их удаления друг от друга. 5. Химическое строение вещества можно определить в результате его химических превращений, и наоборот, по строению вещества можно характеризовать его свойства.Слайд 17 Гибридизация атомов углерода Гибридизация – это смещение валентных электронных облаков и
образование качественно новых, равноценных гибридных валентных электронных облаков. В ПСХЭ Д.И.Менделеева
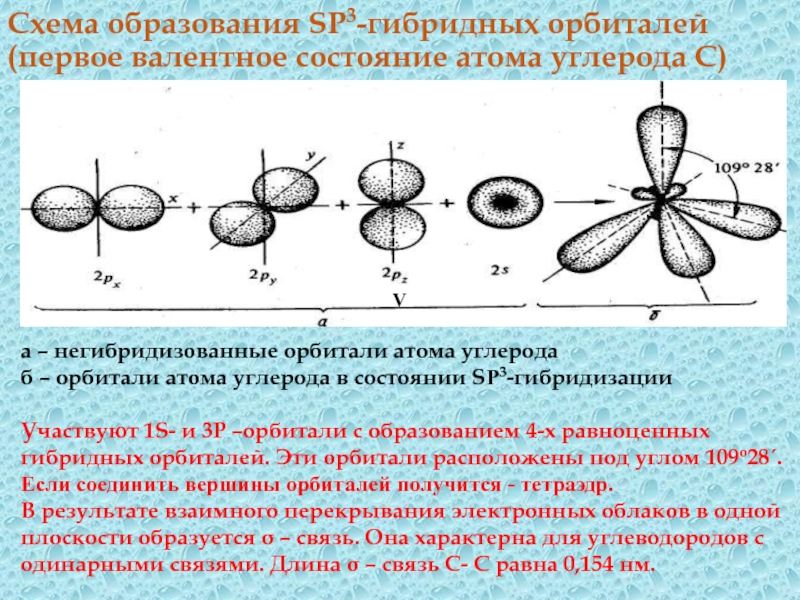
углерод расположен в главной подгруппе IV группы, поэтому электронная структура атома С , если : 1) атом углерода С6 в невозбужденном состоянии - имеет электронную формулу - 1S22S22P2 , т. е на внешнем электронном слое находятся 2 неспаренных электрона (валентность – II) 2) атом углерода С6 в возбужденном состоянии - имеет электронную формулу - 1S22S12P3 , т.е. 4 неспаренных электрона (валентность – IV) S –орбиталь имеет сферическую форму; Р-орбиталь - форму объёмной восьмерки, ориентированной в пространстве определенным образомСлайд 18Схема образования SP3-гибридных орбиталей (первое валентное состояние атома углерода С)
V
а
– негибридизованные орбитали атома углерода б – орбитали атома углерода в
состоянии SP3-гибридизацииУчаствуют 1S- и 3Р –орбитали с образованием 4-х равноценных гибридных орбиталей. Эти орбитали расположены под углом 109о28´.
Если соединить вершины орбиталей получится - тетраэдр.
В результате взаимного перекрывания электронных облаков в одной плоскости образуется σ – связь. Она характерна для углеводородов с одинарными связями. Длина σ – связь С- С равна 0,154 нм.
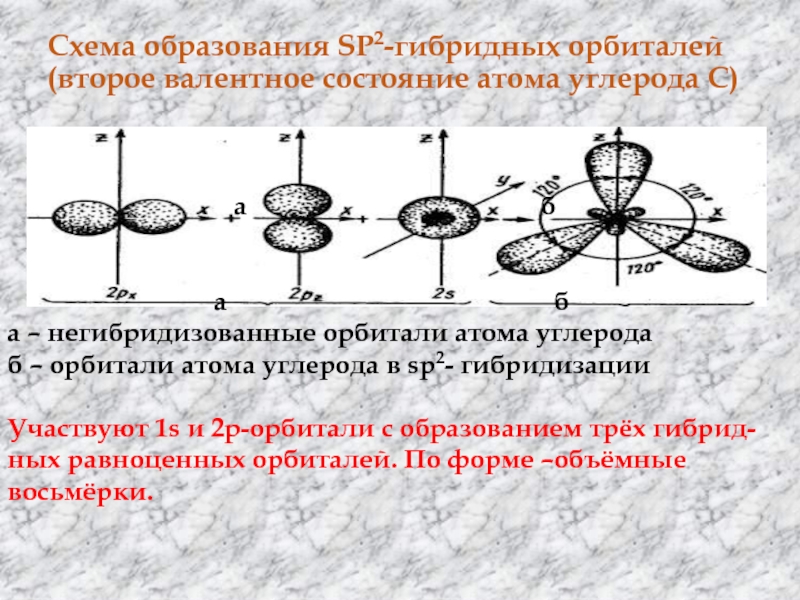
Слайд 19Схема образования SP2-гибридных орбиталей (второе валентное состояние атома углерода С)
а б
а б
а – негибридизованные орбитали атома углерода
б – орбитали атома углерода в sp2- гибридизации
Участвуют 1s и 2р-орбитали с образованием трёх гибрид-
ных равноценных орбиталей. По форме –объёмные восьмёрки.
Слайд 20 Отличие от sp3 –орбиталей –большая лопасть объёмной восьмёрки короче.
sp2- орбитали лежат в одной плоскости и направлены по углом
120о друг к другу, их вершины образуют равносторонний треугольник. Одна р-орбиталь остается свободной (негибридизованной). Она сохраняет форму правильной объёмной восьмёрки и располагается перпендикулярно плоскости, в которой лежат 3 sp2- гибридных орбитали. В результате перекрывания электронных облаков в 2-х взаимно перпендикулярных областях образуется π –связь. Этот тип гибридизации характерен для соединений с двойными связями, одна из которых σ – связь , вторая π –связь . Длина связи С-С равна 0,134 нм.Слайд 21
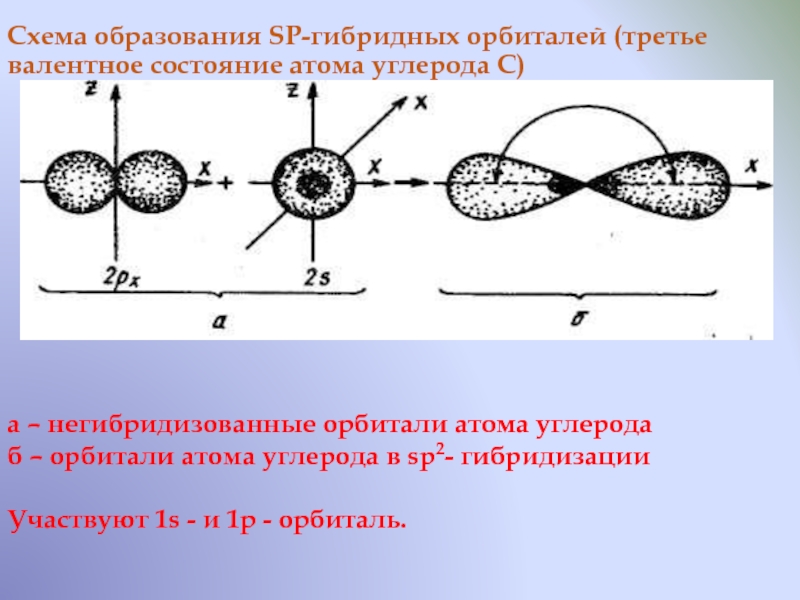
Схема образования SP-гибридных орбиталей (третье валентное состояние атома углерода С)
а
– негибридизованные орбитали атома углерода
б – орбитали атома углерода в
sp2- гибридизацииУчаствуют 1s - и 1p - орбиталь.
Слайд 22 В результате образуются две равноценные гибридные орбитали, имеющие форму объёмных
восьмёрок с еще более короткой лопастью. Они расположены под углом
180о друг другу, т.е. на одной прямой и направлены в противоположные стороны от ядра атома Две не участвующие в гибридизации р-орбитали сохраняют форму правильных восьмёрок и располагаются взаимно перпендикулярно. Этот тип гибридизации характерен для соединений с тройными связями, одна из которых σ – связь и две π – связи. Длина связи С-С равна 0,12 нм. В органических соединениях в основном ковалентная химическая связьСлайд 23 4. Классификация органических соединений. Органические соединения отличаются своей многочисленностью и
разнообразием. Поэтому необходима их систематизация. Органические соединения классифицируют, учитывая два
основных структурных признака: - строение углеродной цепи (углеродного скелета); - наличие и строение функциональных групп. · Углеродный скелет (углеродная цепь) - последовательность химически связанных между собой атомов углерода. · Функциональная группа - атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его химические свойства.Слайд 24 Классификация соединений по строению углеродной цепи В зависимости от строения углеродной
цепи орг. соединения делят на ациклические и циклические.
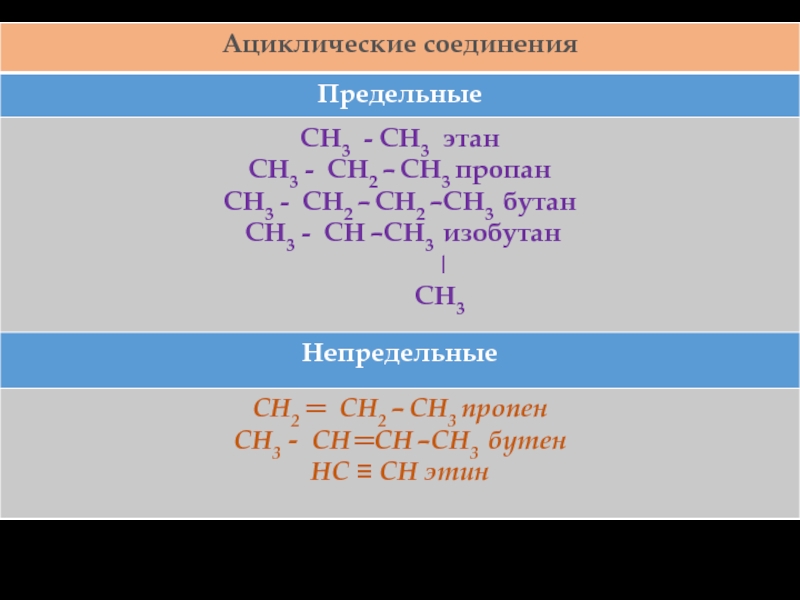
Слайд 25Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются
также алифатическими. Среди ациклических соединений различают предельные (насыщенные), содержащие в скелете только одинарные связи
C-C и непредельные (ненасыщенные), включающие кратные связиC=C и C ≡ C.
Слайд 27 Ациклические соединения подразделяют также на соединения с неразветвленной и разветвленной цепью. В этом
случае учитывается число связей атома углерода с другими углеродными атомами.
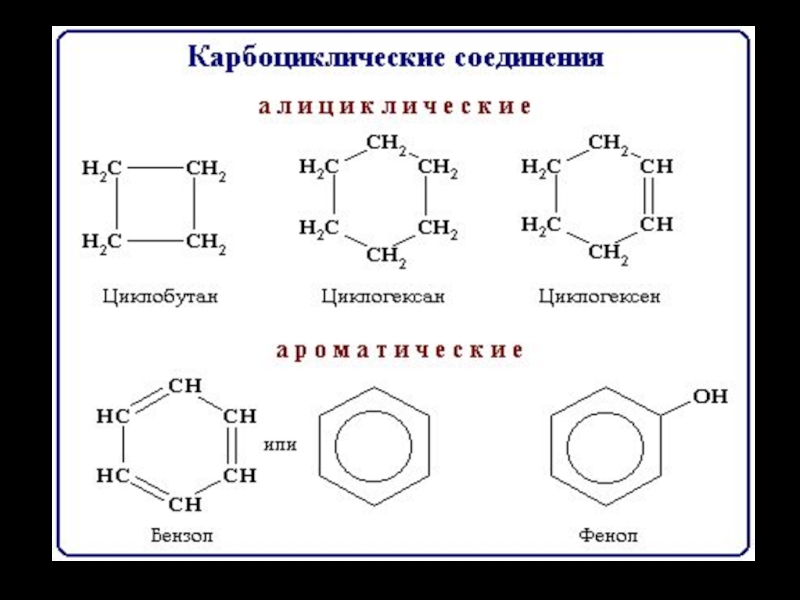
Слайд 28 Циклические соединения - соединения с замкнутой углеродной цепью. В зависимости от природы атомов, составляющих
цикл, различают карбоциклические и гетероциклические соединения. Карбоциклические соединения содержат в цикле только
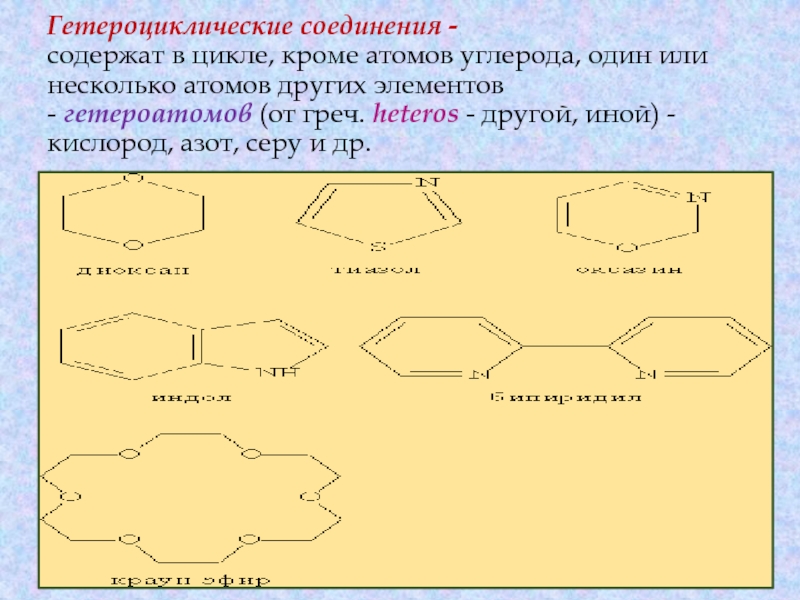
атомы углерода. Они делятся на две существенно различающихся по химическим свойствам группы: алифатические циклические - сокращенно алициклические - и ароматические соединения.Слайд 30Гетероциклические соединения - содержат в цикле, кроме атомов углерода, один или
несколько атомов других элементов - гетероатомов (от греч. heteros - другой, иной) - кислород,
азот, серу и др.Слайд 31 Классификация соединений по функциональным группам Соединения, в состав которых входят только
углерод и водород, называются углеводородами. Другие, более многочисленные, органические соединения можно
рассматривать как производные углеводородов, которые образуются при введении в углеводороды функциональных групп, содержащих другие элементы. В зависимости от природы функциональных групп органические соединения делят на классы. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице:Слайд 34 В состав молекул органических соединений могут входить две или более
одинаковых или различных функциональных групп. Например: HO-CH2-CH2-OH (спирт : этиленгликоль); NH2-CH2-COOH (аминокислота: глицин). Все классы органических соединений
взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращения функциональных групп без изменения углеродного скелета.Слайд 35 Лекция № 2 Тема: «АЛКАНЫ» План: 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. 2.
Методы синтеза алканов.
3. Физико-химические свойства.
4. Отдельные представители.
Слайд 36 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. Алканы – алифатические углеводороды,
в молекулах которых атомы углерода связаны между собой одинарной σ
– связью, а остальные их валентности предельно насыщены атомами водорода, отсюда их название – предельные (насыщенные углеводороды). Простейший представитель - СН4. Общая формула : СnН2n+2Слайд 38Изомерия Атомы углерода в молекулах алканов находятся в SP3 – гибризизации.
Для алканов характерна структурная изомерия- изомерия углеродного скелета. СН3 – СН2-
СН2 - СН3 н- бутан СН3 – СН - СН3 СН3 изобутанСлайд 39Номенклатура Для названия алканов с разветвлённой углеродной цепью необходимо знать названия
органических радикалов –алкилов. Алкил – частица, образующаяся при отщеплении от
молекулы алкана одного атома водорода: Общая формула алкилов (радикалов): СnН2n+1 Алкил обозначают R или AlkСлайд 41 Систематическая (научная) номенклатура – ИЮПАК 1. Выбираем самую длинную цепочку. 2. Нумеруем
её с той стороны, где ближе разветвления ( радикалы). 3. Цифрой
указываем номера углеродных атомов, у которых есть радикалы. 4. Называем эти радикалы. Если 2 одинаковых радикала – добавляем частицу «ди», если 3 - «три», если 4 – «тетра» и т.д. 5. Называем всю цепочку. СН3
1 2 ǀ 3 4 5
СН3–СН – СН2 - СН2 -СН3
2-метилпентан
Слайд 42 Рациональная номенклатура 1. Выбираем центральный атом и обозначаем его *. Центральный атом
тот, который имеет максимальное количество связей С-С. 2. Отсекаем все связи,
отходящие от центрального атома. 3. Называем радикалы от младшего к старшему, используя п.4 систематической номеклатуры. Если радикал имеет разветвление, то его названию добавляется частица «изо». 4. К названию радикалов добавляем слово «МЕТАН» СН3
ǀ *
СН3–СН – СН2 - СН2 -СН3
диметилпропилметан
Слайд 432. Методы синтеза алканов.
Для получения алканов используют в основном природные
источники. Газообразные алканы получают из природного и попутных нефтяных газов,
а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск(озокерит) — разновидность твердого природного битума.1. Гидрирование алкенов : CH2 = CH2 + H2 -> CH3 - CH3 (кат. Pt или Ni при tº)
2. Реакция Вюрца (взаимодействие галогенпроизводных алканов с Na) : CH3Cl + 2Na + ClCH3 -> 2NaCl + CH3 - CH3
2C2H5Cl + 2Na -> 2 Nacl + C4H10
CH3Cl + 2Na + C2H5Cl -> 2 NaCl + C3H8
Слайд 443. Щелочной гидролиз солей карбоновых кислот ( лабораторный способ получения
– берём смесь Na2CO3 + Са(ОН)2, которая наз. Натронной известью: CH3COONa
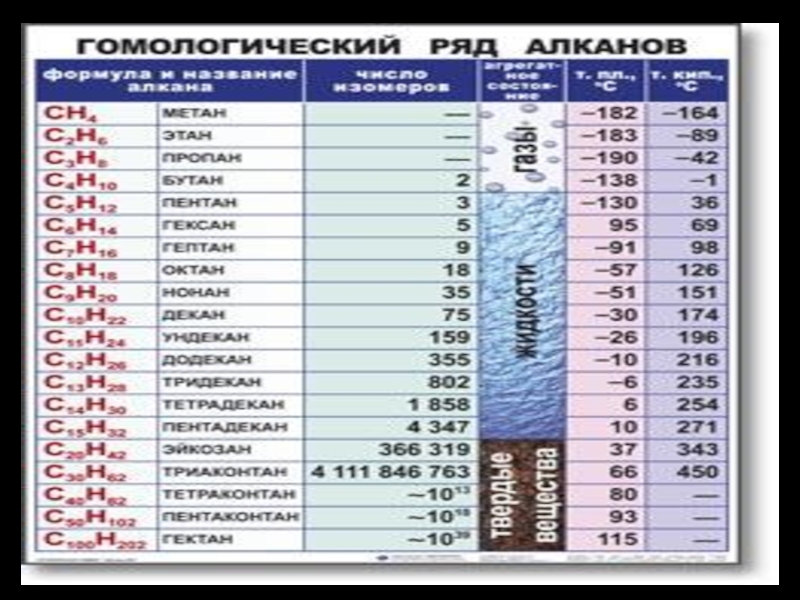
+ NaOH -> CH4 + Na2CO3 4. Гидролиз карбидов : Al4C3 + 12H2O -> 3CH4 + 4Al(OH3) 5. Электролиз одноосновных карбоновых кислот: СН3СООNа -> СНСОО- + Nа+ Аn(+) -2е 2СНСОО- -> 2СО2 ↑+ СН3 – СН3 6. Омыление элементорганических соединений: СН3МgСl + НОН -> СН4+ МgОНСl 7. Восстановление галогенпроизводных углеводородов: СН3Сl + НСl -> СН4+ Сl2 8. Прямой синтез из углерода и водорода при tº= 400º- 500 º и повышении давления в присутствии катализатора Кt: С + 2Н2 -> СН4Слайд 45 3. Физико-химические свойства. 1).Физические свойства алканов указаны в таблице «Гомологический ряд
алканов» (смотри слайд № 36). 2)Химические свойства алканов. В обычных условиях алканы
инертны. Химическая устойчивость алканов объясняется σ –связями С-С и С-Н.В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C. В определенных условиях происходит разрыв именно С-Н-связей и атомы водорода заменяются другими атомами или группами атомов. Алканы вступают в реакции, протекающие по механизму радикального замещения
Слайд 46 1. Реакции галогенирования Галогенирование – это реакция замещения одного или более
атомов водорода в молекуле углеводорода на галоген. Продукты реакции называют
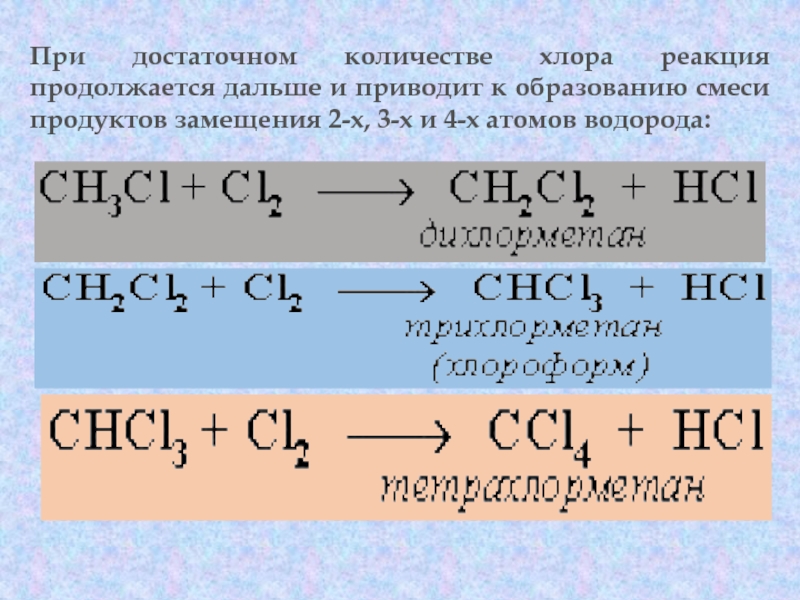
галогенопроизводными углеводородов. Реакция алканов с хлором и бромом идет на свету или при нагревании. Хлорирование метана:Слайд 47При достаточном количестве хлора реакция продолжается дальше и приводит к
образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Слайд 48При хлорировании или бромировании алкана с вторичными или третичными атомами
углерода легче всего идет замещение водорода у третичного атома, труднее
у вторичного и еще труднее у первичного. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:Слайд 49 2. Реакция нитрования алканов (реакция Коновалова) На алканы действует pазбавленная
азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение
атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями. В молекулах алканов легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов водорода. Схема реакции:Слайд 50 3. Реакции горения алканов Горение углеводородов приводит к разрыву всех связей
С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая
реакция):Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. Неполное сгорание алканов приводит к образованию угарного газа СО ( при недостатке кислорода)