Слайд 1Свободный объем и плотность упаковки полимеров
Понятие о свободном объеме вещества
связано с понятием плотности упаковки его молекул; которая оценивается коэффициентом
упаковки, представляющим собой отношение собственного объема макромолекул к истинному объему тела, составленного из данных макромолекул. Собственный объем рассчитывается теоретически по известным значениям радиусов атомов при условии, что все атомы в молекуле касаются друг друга; истинный объем вещества вычисляется на основе экспериментальных значений его плотности
(V = М/р).
Слайд 2http://www.youtube.com/watch?v=zAZ9V9XVIko
Лекция 1 Чалых А.Е. Физическая химия полимеров.
http://www.youtube.com/watch?v=0n5mMkMSs74
http://www.youtube.com/watch?v=pVkimGnzsBw
http://www.youtube.com/watch?v=ojoQEAaKPiE
http://www.youtube.com/watch?v=Pqx1u6n3CvU
Слайд 3Лекция 3-1. Растворы полимеров.
http://www.youtube.com/watch?v=Go5A9FNIK5c
Лекция 2-1. Молекулярная масса полимеров.
http://www.youtube.com/watch?v=Go5A9FNIK5c
Лекция 2-2. Свойства
макромолекул. Гибкость.
http://www.youtube.com/watch?v=Go5A9FNIK5c
Слайд 4Если обозначить молекулярную массу звена полимера Мзв и плотность полимера ρп, то
истинный объем, занимаемый одним молем звеньев полимера, составит
Vn=M3e/pn.
Пусть
собственный объем 1 моль звеньев полимера равен V„ Тогда коэффициент упаковки полимера
К„ = Vn'/ V„.
Слайд 5Другой важной величиной, характеризующей плотность упаковки полимеров, является величина AV, равная разности
истинных объемов полимера V„ и мономера VM. Плотность полимера всегда больше плотности мономера, поскольку
в процессе полимеризации вещество уплотняется. Поэтому V„ всегда меньше VM и AV отрицательна. Однако сравнивать плотности полимера и мономера не вполне правильно, так как в мономере имеются двойные связи, тогда как они отсутствуют в цепи полимера, а расстояния между атомами углерода С-С и С=С различны. Поэтому правильнее сравнить плотности и свободные объемы полимера и его гидрированного мономера. Например, полиэтилен - этан, полистирол - этилбензол, полиизобутилен - изобутан и т. д. Расчеты показывают, что коэффициенты упаковки у большинства полимеров лежат в пределах 0,62-0,65 и близки к коэффициентам упаковки обычных твердых тел.
Слайд 6Для прямого определения плотности каучуков применяют [4] три метода: гидростатический,
пикнометрический и взвешивание на весах Жоли. В любом случае для
определения берут образец объемом не менее 1 см3, без язв, пор и других дефектов и с чистой поверхностью. Для удаления пузырьков воздуха с поверхности образца его опускают на 2-3 с в бюкс с этиловым спиртом, а затем на такое же время в сосуд с дистиллированной водой.
Слайд 7 Природа растворов полимеров
Вопрос о природе полимерных растворов долгое
время оставался
дискуссионным, так как размеры макромолекул соизмеримы с размерами коллоидных
частиц, и растворы полимеров обнаруживают ряд свойств, характерных для коллоидных золей (эффект Тиндаля, замедленная диффузия,тиксотропия и др.).
В конце 30-х годов Каргиным, Папковым и Роговиным было доказано,
что растворы полимеров являются истинными.
Истинный раствор – это молекулярно-дисперсная система, для которой характерны следующие признаки:
самопроизвольность образования и термодинамическая
устойчивость, равновесность;
постоянство концентрации во времени;
однофазность, гомогенность.
Слайд 8Основным доказательством термодинамической устойчивости системы является подчинение ее правилу фаз
Гиббса, основному закону равновесия гетерогенных систем, который для конденси-рованных систем
(не имеющих газовой фазы) имеет вид:
Ф + С = К + 1,
где Ф - число фаз, К - число компонентов и С- число степеней свободы, т.е.
число переменных, полностью определяющих состояние системы, которое можно произвольно менять без нарушения числа фаз.
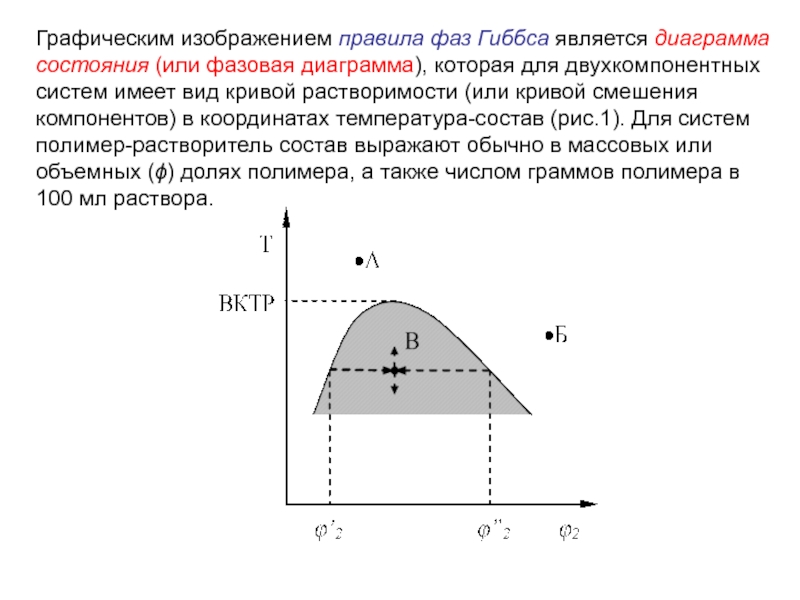
Слайд 9Графическим изображением правила фаз Гиббса является диаграмма состояния (или фазовая
диаграмма), которая для двухкомпонентных систем имеет вид кривой растворимости (или
кривой смешения компонентов) в координатах температура-состав (рис.1). Для систем полимер-растворитель состав выражают обычно в массовых или объемных () долях полимера, а также числом граммов полимера в 100 мл раствора.
Слайд 10 Кривая растворимости, называемая бинодалью, разделяет каждую из диаграмм на две
области.
Область выше кривой соответствует однофазной гомогенной системе. Например в
точке А: 1+С=2+1, С=2, т.е. температуру и состав можно менять одновременно без изменения числа фаз в системе.
В точке Б имеет место истинный раствор низкомолекулярного растворителя в полимере.
Область ниже кривой (заштрихована на рисунке 1) отвечает двухфазной, гетерогенной системе. Так в точке В система расслаивается на две фазы – раствор полимера в растворителе состава ’2 и раствор растворителя в полимере состава ”2: 2+C=2+1, С=1.
Слайд 11Каждой температуре соответствует определенная концентрация вещества в каждой фазе. При
этом свойства системы не зависят от пути достижения равновесия: разбавление,
концентрирование, охлаждение или нагревание (на рисунке 1 показано стрелками вокруг точки В).
Если молекулы компонентов соизмеримы по размерам, как в случае низкомолекулярных веществ, то фазовая диаграмма симметрична относительно оси составов. Кривые смешения полимер-растворитель всегда резко асимметричны, а именно, они сильно сдвинуты в сторону низких концентраций полимера.
Слайд 12Максимум бинодали отвечает верхней критической температуре растворения (смешения) (ВКТР или
ВКТС).
ВКТР – это та минимальная температура выше которой ни
при какой концентрации раствора полимера не наблюдается расслоения в системе.
Отвечающая ей концентрация называется критической концентрацией. Примером систем с ВКТР могут служить ацетилцеллюлоза-хлороформ, полиизобутилен-бензол, полистирол-циклогексан.
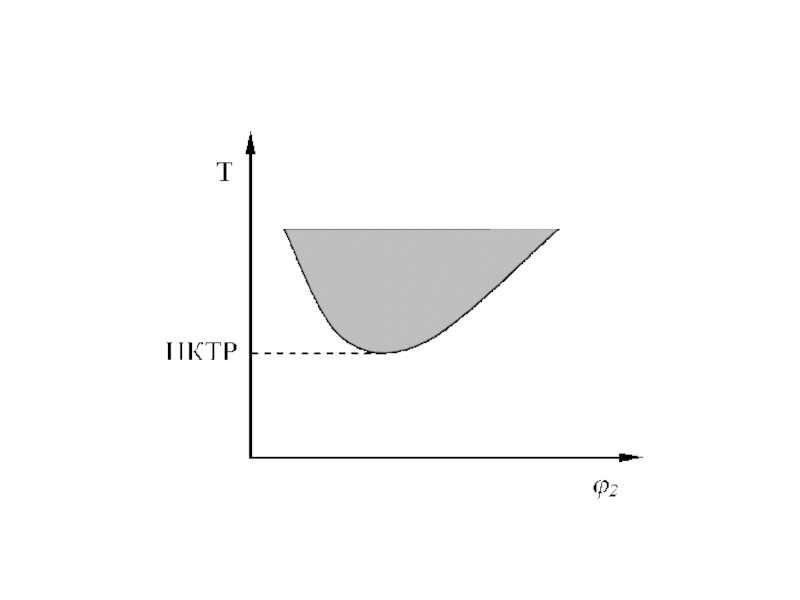
Слайд 13Существуют системы, характеризующиеся нижней температурой растворения (смешения) (НКТР или НКТС).
НКТР – это максимальная температура, ниже которой ни при какой
концентрации раствора не наблюдается расслоения в системе. Например, полиэтиленоксид-вода, метилцеллюлоза-вода, нитроцеллюлоза-этиловый спирт обладают НКТР (рис.2а). Обычно НКТР реализуется при высоких температурах, как правило, превышающих температуру кипения растворителя, вследствие чего система оказывается под значительным давлением.
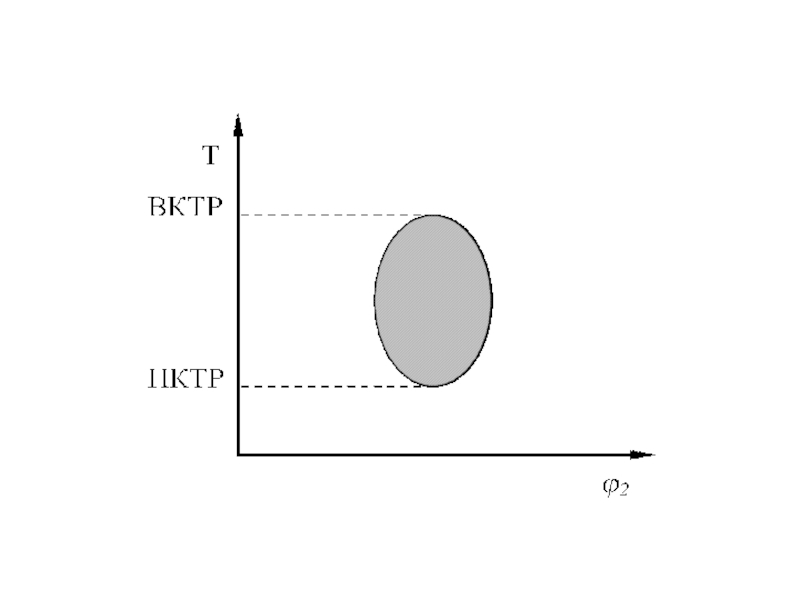
Слайд 15Для некоторых систем полимер-растворитель, например, полипропиленоксид-вода, получены замкнутые кривые растворимости
с ВКТР и НКТР, причем НКТР ВКТР и ниже
температуры кипения растворителя (рис. 2б). Такая диаграмма характерна для сильно взаимодействующих компонентов, например, когда растворение сопровождается образованием водородных связей между молекулами. При нагревании тепловое движение нарушает эти связи, и взаимная смешиваемость ухудшается, система расслаивается.
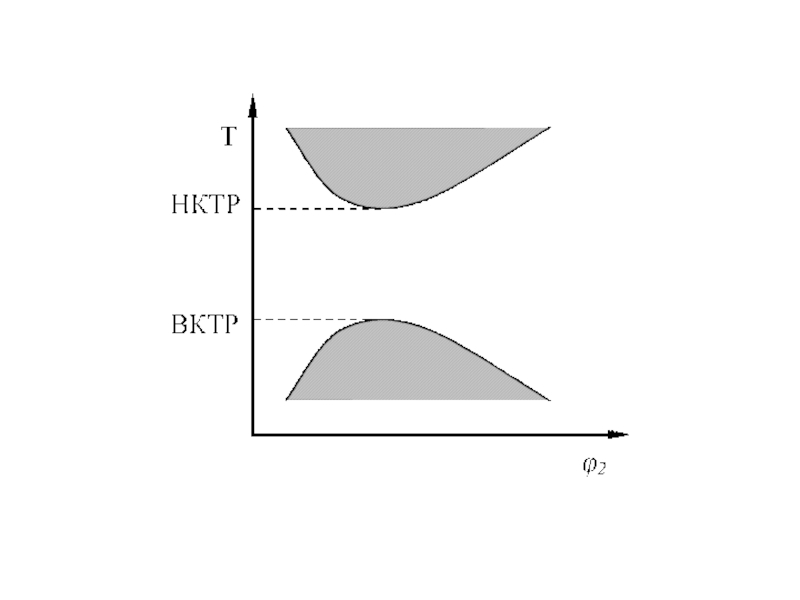
Слайд 17 Известен еще один тип диаграммы (рис. 2в), когда НКТРВКТР
и выше температуры кипения растворителя, но ниже критической температуры перехода
жидкость-пар для растворителя.
Такая диаграмма наблюдается в случае компонентов, идентичных по химическому строению, но сильно различающихся по размерам (полимер в своем гидрированном мономере). Расслоение системы обусловлено большой разницей в термических коэффициентах расширения компонентов. При повышении температуры растворитель стремится расшириться сильнее, чем полимер, но, находясь в растворе, сделать этого не может. В результате растворитель оказывается в более сжатом состоянии, его молекулы ассоциированы, как и молекулы полимера, вызывая фазовое разделение системы. Диаграммы состояния типа изображенной на рисунке 2в получены для систем полиэтилен-алканы, полистирол-циклогексан, поливинилацетат-этилацетат, поливиниловый спирт-вода и другие.
Слайд 19Применимость правила фаз к системам полимер-растворитель однозначно доказывает, что это
термодинамически устойчивые, равновесные системы. Однако из-за большой разницы в размерах
молекул полимера и растворителя равновесие в растворах полимеров устанавливается медленно и сильно зависит от природы полимера и растворителя, молекулярной массы и концентрации полимера.
Слайд 20Особенности процесса растворения полимеров
Первой стадией растворения любого полимера является
его набухание.
Набухание – это процесс поглощения полимером низкомолекулярной жидкости,
сопровождающийся увеличением массы, объема полимера и изменением конформаций его макромолекул.
Набухание обусловлено большой разницей в размерах и, следовательно, в скоростях диффузии молекул полимера и низкомолекулярного растворителя, а также сильным межмолекулярным взаимодействием в полимере.
Слайд 21При соприкосновении полимера с растворителем более подвижные молекулы растворителя проникают
в фазу полимера, не только заполняя пустоты между макромолекулами (процесс
аналогичный капиллярной конденсации в твердых пористых телах), но и увеличивая расстояние между центрами масс полимерных клубков, не нарушая сплошности полимерного тела. Набухший полимер представляет раствор низкомолекулярной жидкости в полимере.
сплошность непролазность, беспрерывность, непрерывность, стопроцентность
Слайд 22Если растворение полимера останавливается на стадии набухания, то говорят об
ограниченном набухании. Ограничено набухают, образуя студни (гели), сшитые полимеры, в
которых пространственный каркас образован за счет химических связей между цепями и (или) физических узлов (взаимодействий, зацеплений и т.п.). Количественно набухание характеризуется степенью набухания ()
или
,
где m0, V0 – масса и объем исходного полимера;
m, V – набухшего полимера
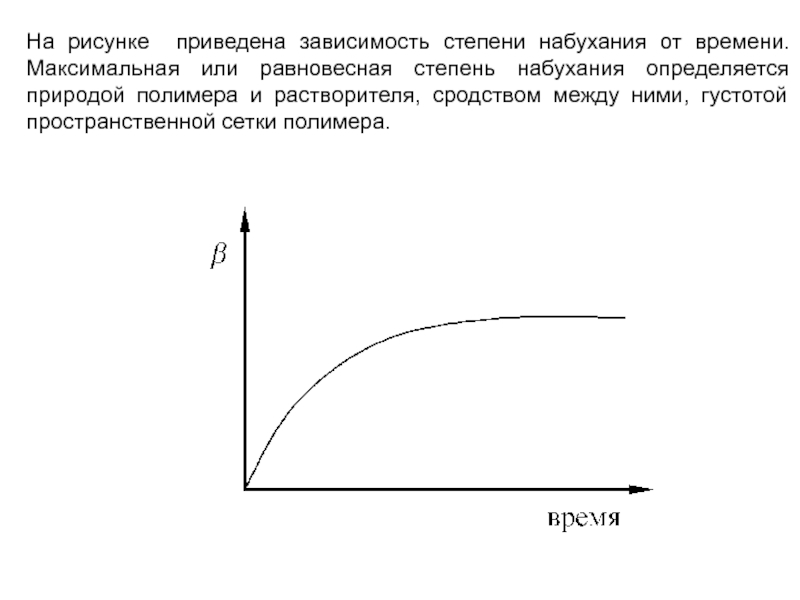
Слайд 23На рисунке приведена зависимость степени набухания от времени. Максимальная или
равновесная степень набухания определяется природой полимера и растворителя, сродством между
ними, густотой пространственной сетки полимера.
Слайд 24В случае полимеров линейного строения при изменении условий (температуры, концентрации)
ограниченное набухание может перейти в неограниченное, т.е. в растворение полимера.
Малоподвижные макромолекулы начинают диффундировать в растворитель до образования гомогенного раствора. Поскольку растворы полимеров образуются самопроизвольно, их образование сопровождается уменьшением изобарно-изотермического потенциала в процессе растворения, т.е.
G = (Gр-ра–Gкомп) = H–TS<0,
где Gр-ра – изобарно-изотермический потенциал раствора;
Gкомп – сумма изобарно-изотермических потенциалов компонентов до растворения;
H=Hр-ра–Hкомп – изменение энтальпии системы при растворении;
S = Sр-ра–Sкомп – изменение энтропии системы при растворении.
Слайд 25Самопроизвольное растворение полимера возможно в следующих случаях:
H0.
Растворение
сопровождается возрастанием энтропии и выделением тепла (экзотермическое растворение). В этом
случае энергия взаимодействия между разнородными молекулами больше, чем между однородными. Например, растворение нитроцеллюлозы в ацетоне.
уменьшением энтропии. Это происходит, например, при растворении полярных полимеров в
полярных растворителях. Энтропия уменьшается за счет иммобилизации растворителя в сольватных оболочках макромолекул. Такая сольватная оболочка делает макромолекулу более жесткой. При повышении температуры, когда H TS, такие системы расслаиваются, т.е. обладают НКТР. Например, яичный альбумин в воде.
Слайд 27H>0 и S>0, при условии H
возрастания энтропии и сопровождается поглощением тепла, т.е. растворение эндотермическое. Это
наблюдается при растворении гибкоцепных полимеров в неполярных растворителях. При понижении температуры, когда HTS в системе наблюдается расслаивание, т.е. система обладает ВКТР.
Слайд 28H=0 и S>0.
Растворение происходит за счет возрастания энтропии и
сопровождается нулевым тепловым эффектом (атермическое растворение). Это наблюдается иногда при
растворении полимера в своем гидрированном мономере. Например, поливинилацетат в этилацетате, полиизобутилен в изооктане.
Слайд 29Как известно, величина H=U+pV характеризует изменение внутренней энергии (U) и
объема системы при растворении. Поэтому условие H=0 означает, что силы
взаимодействия молекул, как и плотность их упаковки, при растворении полимера в низкомолекулярной жидкости не изменяются.
Действительно, плотность полимера в высокоэластичном состоянии (полиизобутилен и поливинилацетат при комнатной температуре находятся в эластичном состоянии) близка к плотности низкомолекулярной жидкости.
В случае разбавленных растворов низкомолекулярных веществ условие H=0 обычно приводит к подчинению их Законам идеальных растворов. Однако растворы полимеров, даже будучи атермическими, обнаруживают существенные отклонения от идеального поведения.
Слайд 30Особенности термодинамического поведения макромолекул в растворе





![Свободный объем и плотность упаковки полимеров Для прямого определения плотности каучуков применяют [4] три метода: гидростатический, пикнометрический Для прямого определения плотности каучуков применяют [4] три метода: гидростатический, пикнометрический и взвешивание на весах Жоли. В](/img/thumbs/ebb435796e728d526d1ebc7728ec2e90-800x.jpg)