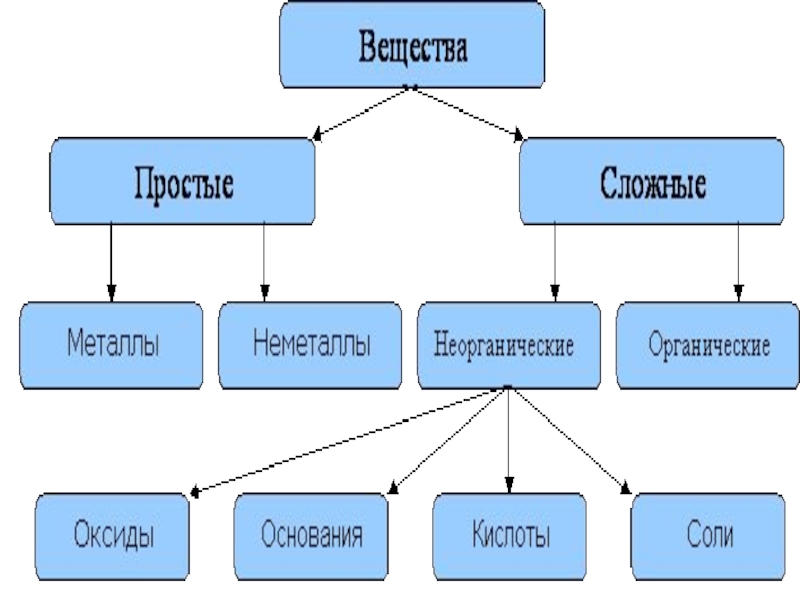
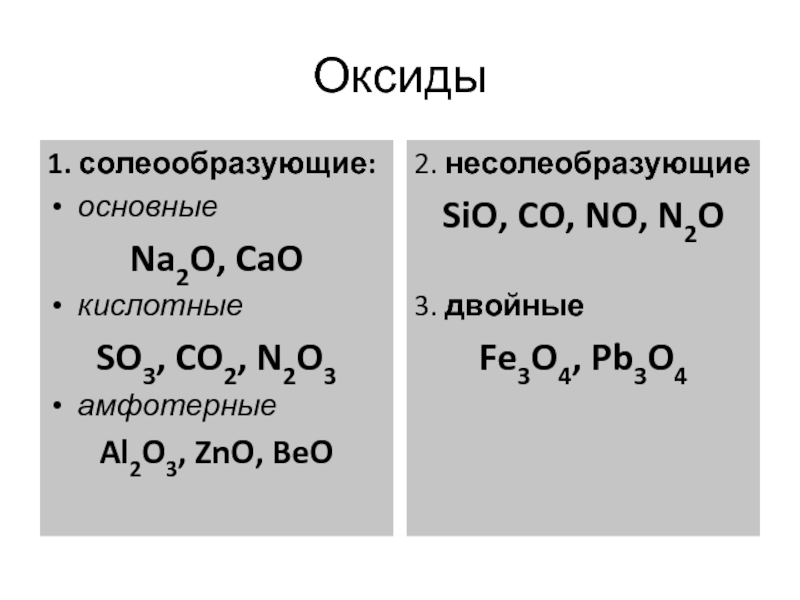
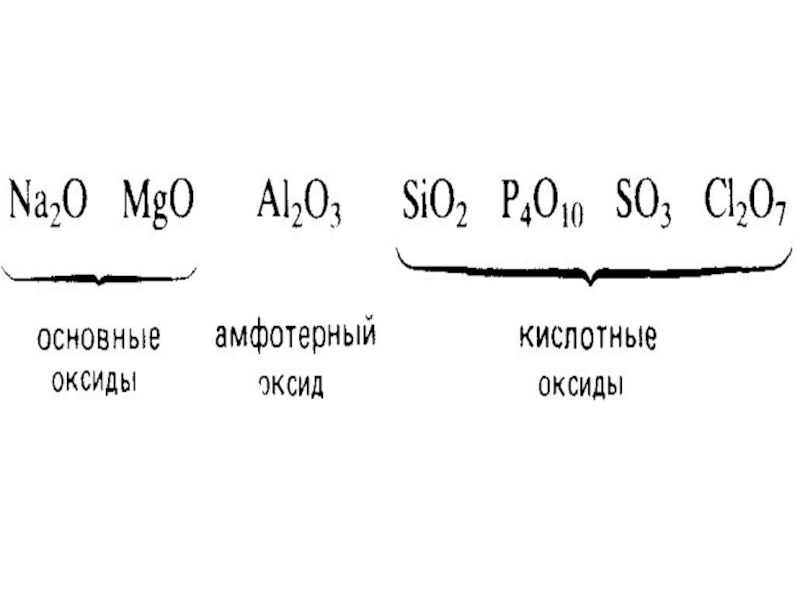
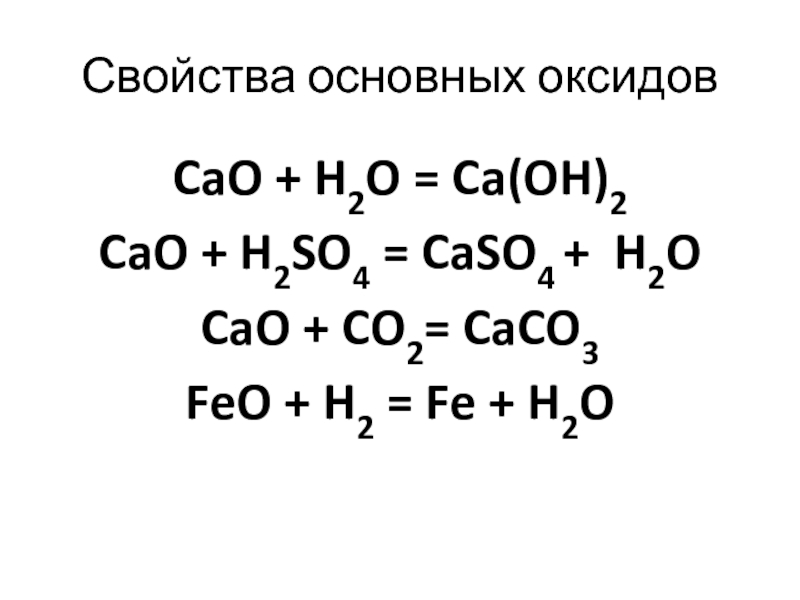
показать зависимость свойств химического элемента и образованных им веществ от
положения в Периодической системе Д.И. Менделеева и строения атома.Развивающая: развивать умение применять теоретические знания при выполнении практических заданий.
Воспитательная: воспитывать интерес к дисциплине; воспитывать аккуратность и внимательность.