Слайд 1“Технологія лікарських засобів для парентерального застосування у відповідності з вимогами
ДФ України. Номенклатура, стабілізація, стерилізація, зберігання.”
Курсова робота
з аптечної технології лікарських
засобів:
МІНСТРЕСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
Вінницький національний медичний Університет
імені М.І.Пирогова
Виконавець:
Студент 51 групи III курсу
Фармацевтичного факультету
Лижов Д.В
Керівник
Доцент, к. фарм.н.
Кривов’яз Олена Вікторівна
Вінниця, 2016 р
Слайд 2Актуальність теми
Парентеральні лікарські засоби в Україні виготовляють як потужні
фармацевтичні підприємства, так і аптеки. Але промисловість на сьогодні не
в змозі забезпечити в повному обсязі потреби лікувальних закладів в ін’єкційних та інфузійних розчинах. Згідно з класифікацією Державної Фармакопеї України, в аптечних умовах виготовляють тільки два види парентеральних розчинів: ін’єкційні та внутрішньовенні інфузійні.
Для вітчизняного фармацевтичного ринку характерна передусім цінова конкуренція. Середня ціна ін’єкційних розчинів аптечного виготовлення, які найбільш часто використовуються, нижче середніх роздрібних цін в промисловості. Тому використання лікувальними закладами ліків, виготовлених в аптеках, дає економію бюджетних коштів.
Слайд 3Переваги і недоліки парентерального введення
Парентеральне введення: переваги
Основними перевагами при парентеральному введенні
ліків є точність дозування і швидкість дії препаратів. Адже вони
надходять безпосередньо в кров і що важливо – у незмінному вигляді на відміну від ентерального (через рот) введення.
При використанні парентерального введення є можливість проведення лікування у людей, які перебувають без свідомості або дуже ослаблені.
Недоліки
Обов’язкова присутність медичного працівника. Хоча багато людей вміють робити уколи самостійно, не вдаючись до допомоги інших.
Можливість проникнення хвороботворних бактерій в організм під час проколу шкіри. Тому всі інструменти і розчини повинні бути стерильні, а місце уколу ретельно опрацьовано спиртом.
Поява на місці уколу синців і гематом. З цим наслідком можна впоратися шляхом накладення компресів зі спирту, навпіл розведеного з водою.
Можливість виникнення емболії – потрапляння бульбашок повітря в судинне русло, яке може привести до летального результату. Але при правильній техніці проведення ін’єкцій розвиток такого наслідку виключений.
У багатьох людей з дитинства спостерігається патологічна боязнь уколів, яка може не пройти навіть у дорослому житті.

Слайд 4Класифікація парентеральних лікарських засобів
Згідно ДФУ Доповнення 2
ін'єкційні лікарські засоби
- це стерильні розчини, емульсії або суспензії.;
внутрішньовенні інфузійні ЛЗ це
стерильні розчини водні розчини або емульсії, мають бути вільними від пірогенів і ізотонічними до крові. Призначають для застосування у великих дозах.
концентрати для ін'єкційних або внутрішньовенних інфузійних - це стерильні розчини призначення для ін'єкцій та інфузій після розведення;
порошки для ін'єкційних або внутрішньовенних ЛЗ -це тверді стерильні речовини, уміщенні в стерильні контейнери;
імплантати - стерильні тверді ЛЗ, які вивільняють діючу речовини протягом тривалого часу;
Гелі для ін’єкцій.
Слайд 5Загальні правила згідно наказу №398 додаток 2
Ін’єкційні та внутрішньовенні інфузійні
розчини необхідно виготовляти в асептичних умовах з подальшою стерилізацією. Спосіб
та режим стерилізації повинні бути зазначені в чинних нормативних документах.
При виготовленні парентеральних лікарських засобів використовують розчинники (вода для ін’єкцій, жирні олії, етилолеат та ін.), які повинні бути вказані в рецептах, замовленнях (вимогах) ЛЗ або офіцинальних прописах (ДФУ, НД).
Водні розчини для ін’єкцій виготовляють масооб’ємним методом: лікарську речовину беруть за масою, а розчинник — до одержання визначеного об’єму розчину. Розчинення та змішування компонентів проводять з використанням мірного посуду (мірних колб) або кількість розчинника, необхідного для виготовлення розчину, визначають розрахунковим способом з урахуванням густини розчину даної концентрації чи коефіцієнта збільшення об’єму.
Розчинення лікарських речовин проводять з урахуванням їх фізико-хімічних властивостей. Легкорозчинні речовини розчиняють при кімнатній температурі, повільно- та важкорозчинні (фурацилін, глюкоза та ін.) — при нагріванні. Натрію гідрокарбонат розчиняють при температурі 18-20 °С, обережно перемішуючи, оскільки при енергійному перемішуванні відбувається деструкція натрію гідрокарбонату з виділенням вуглекислого газу.

Слайд 6Технологія ін’єкційних та внутрішньовенних інфузійних розчинів включає такі технологічні стадії:
Підготовча
стадія
розчинення (стабілізація, ізотонування — за необхідності);
первинний контроль якості;
фільтрування, фасування,
закупорювання;
контроль на відсутність механічних включень;
стерилізація;
вторинний контроль якості;
маркування (оформлення).
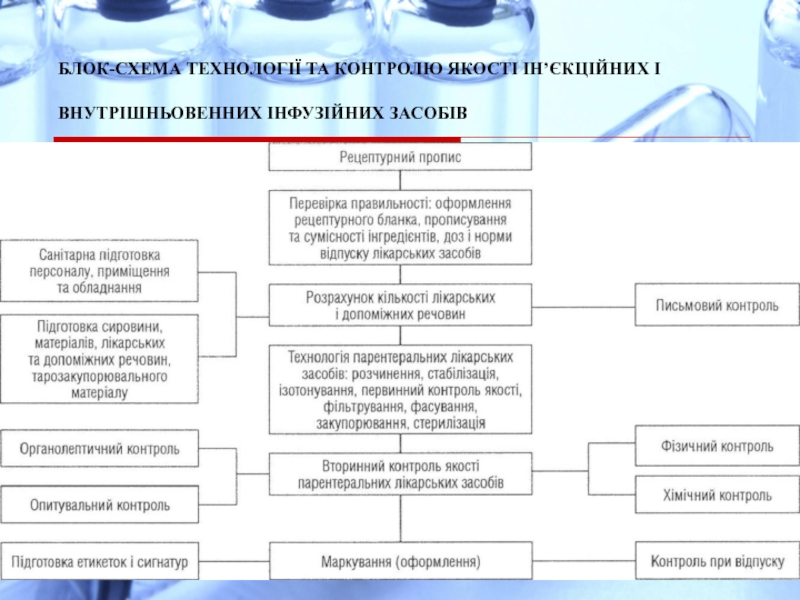
Слайд 7БЛОК-СХЕМА ТЕХНОЛОГІЇ ТА КОНТРОЛЮ ЯКОСТІ ІН’ЄКЦІЙНИХ І ВНУТРІШНЬОВЕННИХ ІНФУЗІЙНИХ ЗАСОБІВ
Слайд 8Стабілізація
Розчини лікарських речовин, які при стерилізації піддаються гідролізу, реакціям
окиснення-відновлення, декарбоксилювання, полімеризації та ін., необхідно стабілізувати.
Кількість стабілізатора, що
додають, повинна бути зазначена в чинних нормативних документах. Об’єм, який займають стабілізатор
Слайд 9Стерилізація
Флакони з розчинами підлягають стерилізації згідно з вимогами ДФУ
та інших чинних нормативних документів. Перед стерилізацією їх маркують шляхом
напису або штампування на кришці, використання металевих жетонів чи іншими методами. Стерилізацію розчинів необхідно здійснювати на пізніше 3 год від початку виготовлення під контролем спеціально призначеної особи (фармацевт або провізор).
Метод і режим стерилізації об’єктів мають бути визначені чинними нормативними документами (Додаток N «НАСТАНОВА ВИМОГИ ДО ВИГОТОВЛЕННЯ СТЕРИЛЬНИХ ТА АСЕПТИЧНИХ ЛІКАРСЬКИХ ЗАСОБІВ В УМОВАХ АПТЕК»). Для кожного циклу стерилізації проводять реєстрацію параметрів стерилізації. Повинні бути визначені способи диференціації непростерилізованої та простерилізованої продукції.
Важливо проконтролювати ефективність процесу стерилізації, який досягається забезпеченням відповідного температурного режиму роботи стерилізаторів і періоду сте- рилізації. Необхідно контролювати показники манометрів стерилізатора і термометрів на різних місцях стерилізаційної камери. Перевірку режиму роботи парових стерилізаторів виконують за допомогою хімічних термотестів і термоіндикаторів

Слайд 10ВИСНОВОК
В даний час проводиться велика робота по вдосконаленню виготовлення ін'єкційних
розчинів.
1. Розробляються нові способи та апарати для одержання води для
ін'єкцій високої якості.
2. Вишукуються можливості забезпечення необхідних асептичних умов виготовлення, що дозволяють виконати вимоги стандарту GMR.
3. Розширюється асортимент миючих, дезинфікуючих засобів.
4. Удосконалюється технологічний процес, використовуються сучасні виробничі модулі, розробляються нові сучасні прилади і апарати (змішувачі, фільтруючі установки, установки ламінарного потоку повітря, стерилізують апарати, прилади для контролю відсутності механічних включень та ін.).
5. Удосконалюється якість вихідних субстанцій, розчинників, розширюється асортимент стабілізаторів різного призначення.
6. Розширюються можливості внутрішньоаптечної заготовки розчинів.
7. Удосконалюються методи оцінки якості та безпеки ін'єкційних розчинів.
8. Впроваджуються нові допоміжні матеріали, пакувальні й закупорювальні засоби.
Слайд 11Ін’єкційні та внутрішньовенні інфузійні розчини оформлюють загальними етикетками «Для ін’єкцій».
На етикетці повинні бути попереджувальні написи: «Берегти від дітей», «Стерильно»
або «Виготовлено асептично» (на флаконі з розчинами, виготовленими в асептичних умовах без стерилізації), «Зберігати в прохолодному місці», «Зберігати в захищеному від світла місці» та ін. За наявності отруйних або наркотичних (психотропних) речовин оформлюють сигнатурою, на якій зазначають склад лікарської форми, що відповідає пропису, і попереджувальним написом «Поводитись обережно».
Маркування (оформлення)
Слайд 12Ін’єкційні та внутрішньовенні інфузійні розчини, виготовлені в аптеках, зберігають в
умовах, що запобігають дії зовнішнього середовища і забезпечують їх стабільність:
за необхідності — у прохолодному, захищеному від світла місці. Терміни придатності ін’єкційних та внутрішньовенних інфузійних розчинів зазначені в Додатку N додатку 2 наказу №398. Розчини, не наведені в Додатку N, зберігають 2 дні або протягом терміну, визначеного експериментальними дослідженнями і зазначеного в технологічній інструкції на конкретний пропис.
Умови і термін зберігання
Слайд 13Взяту за масою лікарську речовину поміщають у стерильну мірну колбу,
розчиняють у невеликій кількості води для ін’єкцій (1/3 —1/4 загального
об’єму), за необхідності додають стабілізатор та ізотонічну речовину, а потім доводять до необхідного об’єму.
Найменування стабілізатора та його кількість визначають чинні нормативні документи (Додаток N настанови ВИМОГИ ДО ВИГОТОВЛЕННЯ СТЕРИЛЬНИХ ТА АСЕПТИЧНИХ ЛІКАРСЬКИХ ЗАСОБІВ В УМОВАХ АПТЕК ) та офіцинальні прописи. Найменування та кількість стабілізатора можуть бути визначені експериментальними дослідженнями в установленому законодавством порядку і зазначені в технологічній інструкції на конкретний пропис.
Ін’єкційні та внутрішньовенні інфузійні розчини ізотонують за вказівкою лікаря або згідно з чинними нормативними документами. Найменування ізотонічної речовини та її кількість додають згідно з Додатком N або розраховують за методами, наведеними у Додатку Р.
Найменування і кількість стабілізатора та ізотонічної речовини обов’язково відзначають на зворотному боці рецепта і на лицевому боці паспорта письмового контролю.
Приклади розрахунків кількості інгредієнтів, технологія і методики хімічного аналізу інфузійних та ін’єкційних розчинів наведені у Додатку Q «Приклади екстемпоральної рецептури ін’єкційних та інфузійних розчинів».

Слайд 14контроль якості
Перевірка якості включає усі види внутрішньоаптечного контролю: письмовий,
опитувальний, органолептичний, фізичний, відсутність механічних включень, хімічний контроль і контроль
при відпуску. Контроль розчинів для ін’єкцій на стерильність і бактеріальні ендотоксини здійснюють відповідно до вимог ДФУ та інших чинних документів.
При відпуску кожен флакон виготовленого розчину в обов’язковому порядку контролюють на правильність і чіткість нанесення напису інгредієнтів та їх концентрації, перевіряють дози сильнодіючих, отруйних та наркотичних (психотропних) лікарських речовин, зовнішній вигляд і оформлення.
При проведенні кількісного аналізу вмісту лікарських та ізотонічних речовин, а також стабілізаторів враховують допустимі відхилення.
Слайд 15контроль якості (продовження)
Контроль ін’єкційних та внутрішньовенних інфузійних лікарських засобів, води
для ін’єкцій на відсутність бактеріальних ендотоксинів або пірогенів здійснюється вибірково
один раз на місяць в атестованих лабораторіях.
Контроль на стерильність ін’єкційних, внутрішньовенних інфузійних лікарських засобів, офтальмологічних та інших лікарських засобів, до яких висуваються вимоги щодо їх стерильності, здійснюють щомісячно (вибірково) в лабораторіях, атестованих згідно з установленим порядком.
Лікарські засоби вважаються забракованими у разі невідповідності їх одному з показників якості: невідповідність їх фізико-хімічних показників; наявність видимих механічних включень;
•недостатність об’єму наповнення флаконів;
•невідповідність за величиною pH (кислотності чи лужності); •невідповідність за стерильністю;
•невідповідність за мікробіологічною чистотою; порушення герметичності закупорювання флаконів
•порушення чинних правил оформлення лікарських засобів, призначених до відпуску.
. Виявлений брак вилучають у карантин, утилізують чи знищують в установленому законодавством порядку. Лікарський засіб виготовляють заново і перевіряють

Слайд 16фільтрування, фасування, закупорювання;
Фільтрування розчинів поєднують з одночасним їх дозуванням (розливом)
у підготовані стерильні флакони.
Розчини солей алкалоїдів, окисників, ферментів, барвних
речовин (апоморфіну гідрохлориду, адреналіну гідрохлориду, натрію бензоату, кофеїн-бензоату натрію, натрію саліцилату, пара-аміносаліцилової кислоти, сульфацил-натрію тощо) фільтрують лише через скляні фільтри. Невеликі об’єми розчинів незалежно від їх властивостей, щоб запобігти втраті розчину та лікарських речовин внаслідок адсорбції фільтрувальним матеріалом, фільтрують лише через скляні фільтри
Слайд 17Контроль на відсутність механічних включень
Якість фільтрації перевіряють за допомогою методу,
що наведений у Додатку К (Настанова ВИМОГИ ДО ВИГОТОВЛЕННЯ СТЕРИЛЬНИХ
ТА АСЕПТИЧНИХ ЛІКАРСЬКИХ ЗАСОБІВ В УМОВАХ АПТЕК ), або іншими. Якщо виявлено механічні включення, розчин повторно фільтрують, знову переглядають, закупорюють (перевіряють герметичність), маркують і стерилізують.
Флакони закупорюють новими гумовими пробками після їх відповідної обробки (Додаток М настанови ВИМОГИ ДО ВИГОТОВЛЕННЯ СТЕРИЛЬНИХ ТА АСЕПТИЧНИХ ЛІКАРСЬКИХ ЗАСОБІВ В УМОВАХ АПТЕК ). Пробки закріплюють алюмінієвими ковпачками і маркують (зазначають найменування та концентрацію розчину) шляхом напису або штамповки на ковпачку, з використанням металевих жетонів чи іншими методами.
Слайд 18Додаток К (обов’язковий) МЕТОДИКА ВІЗУАЛЬНОГО КОНТРОЛЮ ІН’ЄКЦІЙНИХ ТА ІНФУЗІЙНИХ ВНУТРІШНЬОВЕННИХ
РОЗЧИНІВ І ОЧНИХ КРАПЕЛЬ, ВИГОТОВЛЕНИХ В АПТЕКАХ, НА МЕХАНІЧНІ ВКЛЮЧЕННЯ
1. Порядок проведення контролю в аптеках Механічні включення — сторонні рухомі нерозчинні речовини, крім повітряних кульок, які випадково потрапили в розчин. У процесі виготовлення розчини підлягають первинному і вторинному контролю. Первинний контроль проводять після фільтрування і фасування розчину. При цьому пе- реглядають кожен контейнер (пляшку чи флакон) з розчином. При виявленні механічних включень розчин повторно фільтрують, знову переглядають, маркують і стерилізують. Вторинному контролю підлягають також 100% пляшок і флаконів з розчинами, що пройшли стерилізацію або виготовлені в асептичних умовах, перед їх оформленням в упаковку. Контроль розчинів на відсутність механічних включень проводить провізор-технолог з дотриманням умов і техніки контролю.
2. Умови контролю Для перегляду пляшок (флаконів) має бути спеціально обладнане робоче місце, захищене від прямих сонячних променів, де встановлюють «Прилад для контролю розчинів на відсутність механічних забруднень» (УК-2) чи інші. Допускається застосування чорно-білого екрана, освітленого таким чином, щоб виключити потрапляння світла в очі. Контроль розчинів проводять візуально неозброєним оком на чорному і білому фонах, освітлених електричною матовою лампою (60 Вт) або лампою денного освітлення (20 Вт), для забарвлених розчинів — 100 та 30 Вт відповідно. Відстань від ока до об’єкта має становити 25-30 см, а кут оптичної осі перегляду до напрямку світла — близько 90˚. Лінія зору має бути спрямована донизу при вертикальному положенні голови. Провізор повинен мати гостроту зору, що дорівнює одиниці, яка за необхідності коригується окулярами. Поверхня пляшок і флаконів має бути ззовні чистою і сухою.
3. Техніка контролю Залежно від об’єму пляшки чи флакона одночасно переглядають від 1 до 5 штук. Пляшки чи флакони беруть в одну або обидві руки за горловини, вносять у зону контролю, плавним рухом перевертають у положення «догори дном» і візуально оцінюють на чорному і білому фоні. Потім плавним рухом, без струшування, перевертають у попереднє положення «донизу дном» і також переглядають на чорному і білому фоні. Час контролю відповідно: 1 пляшка (флакон) місткістю 100-500 мл — до 20 с; 2 пляшки (флакони) місткістю 50-100 мл — 10 с; 2-5 пляшок (флаконів) місткістю 50 мл — 8-10 с. Зазначений час контролю не включає часу на допоміжні операції. Забраковані після стерилізації пляшки (флакони) вибирають і вкладають окремо у спеціальну тару.

Слайд 19Розчинення (стабілізація, ізотонування — за необхідності);
Взяту за масою лікарську речовину
поміщають у стерильну мірну колбу, розчиняють у невеликій кількості води
для ін’єкцій (1/3 —1/4 загального об’єму), за необхідності додають стабілізатор та ізотонічну речовину, а потім доводять до необхідного об’єму.
Найменування стабілізатора та його кількість визначають чинні нормативні документи та офіцинальні прописи. Найменування та кількість стабілізатора можуть бути визначені експериментальними дослідженнями в установленому законодавством порядку і зазначені в технологічній інструкції на конкретний пропис