Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема 11 Электролитическая диссоциация. Проводимость электролитов. Законы
Содержание
- 1. Тема 11 Электролитическая диссоциация. Проводимость электролитов. Законы
- 2. ОГЛАВЛЕНИЕ11.1. Электролитическая диссоциация11.2. Проводимость электролитов11.3. Законы Фарадея для электролиза11.4. Определение заряда иона11.5. Техническое применение электролиза
- 3. 11.1. Электролитическая диссоциация Электролиз обязан
- 4. 11.2. Проводимость электролитовРассмотрим протекание электрического тока через
- 5. Плотность тока можно представить какФизические величины
- 6. 11.3. Законы Фарадея для электролиза.
- 7. 11.4. Определение заряда иона.Пусть заряд иона q1
- 8. 11.5. Техническое применение электролиза В
- 9. Электролитическое выделение металла из
- 10. Металлические примеси, содержащиеся в
- 11. Гальванопластикой называются процессы получения
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Тема 11
Электролитическая диссоциация. Проводимость электролитов. Законы Фарадея для электролиза. Определение
заряда иона. Техническое применение электролиза
Слайд 2ОГЛАВЛЕНИЕ
11.1. Электролитическая диссоциация
11.2. Проводимость электролитов
11.3. Законы Фарадея для электролиза
11.4. Определение
заряда иона
11.5. Техническое применение электролиза
Слайд 311.1. Электролитическая диссоциация
Электролиз обязан своему существованию явлению
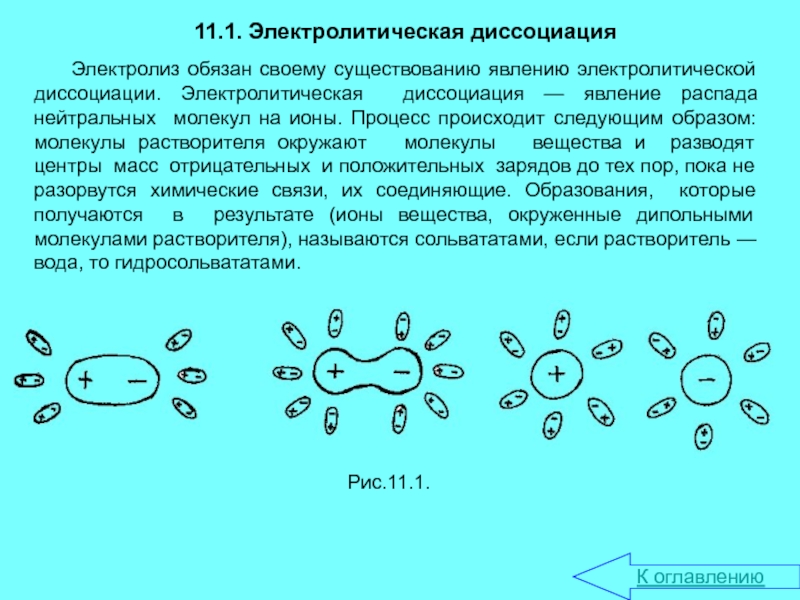
электролитической диссоциации. Электролитическая диссоциация — явление распада нейтральных молекул на
ионы. Процесс происходит следующим образом: молекулы растворителя окружают молекулы вещества и разводят центры масс отрицательных и положительных зарядов до тех пор, пока не разорвутся химические связи, их соединяющие. Образования, которые получаются в результате (ионы вещества, окруженные дипольными молекулами растворителя), называются сольвататами, если растворитель — вода, то гидросольвататами.Рис.11.1.
К оглавлению
Слайд 411.2. Проводимость электролитов
Рассмотрим протекание электрического тока через раствор электролита. На
примере
В водном растворе
диссоциирует по схеме
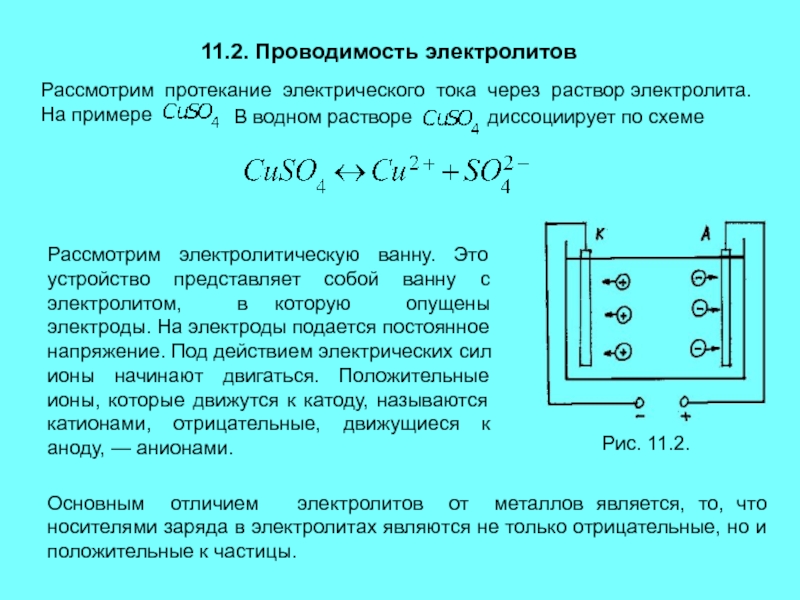
Рассмотрим электролитическую ванну. Это
устройство представляет собой ванну с электролитом, в которую опущены электроды. На электроды подается постоянное напряжение. Под действием электрических сил ионы начинают двигаться. Положительные ионы, которые движутся к катоду, называются катионами, отрицательные, движущиеся к аноду, — анионами.Рис. 11.2.
Основным отличием электролитов от металлов является, то, что носителями заряда в электролитах являются не только отрицательные, но и положительные к частицы.
Слайд 5Плотность тока можно представить как
Физические величины
называются подвижностью ионов, это физическая величина численно равная скорости ионов в единичном электрическом поле.
К оглавлению
(11.1)
(11.2)
Слайд 611.3. Законы Фарадея для электролиза.
Для электролиза
были получены экспериментально законы, которые открыл Майкл Фарадей.
Первый закон Фарадея
гласит, что масса вещества, выделяемая на электродах, прямопропорциональна заряду, протекающему через электролит.Электрохимический эквивалент — физическая величина, численно равная массе вещества, выделившегося на электродах при пропускании единичного заряда через электролит.
2.Второй закон Фарадея гласит, что электрохимический эквивалент вещества, прямо пропорционален его химическому эквиваленту, т. е.
химический эквивалент вещества,
А – атомная (молярная) масса, F=96500 Кл/моль – число Фарадея.
Объединяя I и II законы Фарадея, можно записать
К оглавлению
(11.3)
(11.4)
(11.5)
-где k электрохимический эквивалент вещества.
Слайд 711.4. Определение заряда иона.
Пусть заряд иона q1 и масса иона
m1, на электроде выделяется вещество массой
(11.6)
– число ионов.
Через
электролит проходит заряд, равныйПодставим (11.7) в (11.1), получим
Согласуя данное выражение со вторым законом Фарадея, видим, что отношение m1/q1 равно электрохимическому эквиваленту. Умножим числитель и знаменатель данного выражения на постоянную Авогадро.
Получаем
Заряд иона
К оглавлению
(11.7)
Слайд 811.5. Техническое применение электролиза
В металлургической промышленности электролизом
из расплавленных соединений и водных растворов получают металлы, а также
производят электролитическое рафинирование – очистку металлов от вредных примесей и извлечение ценных компонентов.Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз MgCl2 при получении магния) усложняется.
Электролитом обычно служат не индивидуально расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролиз расплавленных сред начинает приобретать значение для получения некоторых тугоплавких металлов.
Слайд 9 Электролитическое выделение металла из раствора называется электроэкстракцией.
Руда или обогащенная руда – концентрат – подвергается обработке определенными
реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор отправляют на электролиз. Металл выделяется на катоде и в большинстве случаев характеризуется высокой чистотой. Этим методом получают главным образом цинк, медь и кадмий.Электролитическому рафинированию металлы подвергаются для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению, переходя в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя компактный осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются.
Рассмотрим в качестве примера электрорафинирование меди, основным компонентом раствора служит сульфат меди – наиболее распространенная и дешевая соль этого металла. Но раствор CuSO4 обладает низкой электролитической проводимостью. Для ее увеличения в электролит добавляют серную кислоту. Кроме того, вводят небольшие количества добавок, способствующих получению более компактного осадка металла.
Слайд 10 Металлические примеси, содержащиеся в полученной (черновой) меди,
можно разделить на две группы.
Fe, Zn, Ni, Co.
Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите. В связи с этим электролит периодически подвергается очистке.Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный хлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
Электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
К гавальнотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование и никелирование.
Слайд 11 Гальванопластикой называются процессы получения точных металлических копий
с рельефных предметов электроосаждением металла. Путем гальванопластики изготовляют матрицы для
прессования различных изделий (граммофонных пластинок, пуговиц и др.), печатные и радиотехнические схемы, полиграфические клише. Гальванопластику открыл русский академик Б. С. Якоби (1801 – 1874) в 30 - е годы XIX века. К гальванотехнике также относятся другие виды электрохимической обработки поверхности металлов: электрополирование, оксидирование алюминия, магния. Последнее представляет собой анодную обработку металла, в ходе которой изменяется структура оксидной пленки на поверхности. Это приводит к повышению коррозионной стойкости металла. Кроме того, металл приобретает при этом красивый внешний вид.В химической промышленности методом электролиза получают различные химические элементы и их соединения; к ним относятся фтор, хлор, едкий натр, водород высокой чистоты, многие окислители, в частности пероксид водорода.
Составляя электрическую цепь из двух (или нескольких) проводников первого рода (электродов и электролитов), мы получаем гальванические элементы, или иначе, химические источники тока. В таких устройствах сторонние силы возникают в результате химических реакций на электродах, и энергия, освобождаемая в реакции, превращается в работу тока. Явление электролиза лежит в основе принципа действия кислотных и щелочных аккумуляторов, где используется важное свойство процесса электролиза – его обратимость.