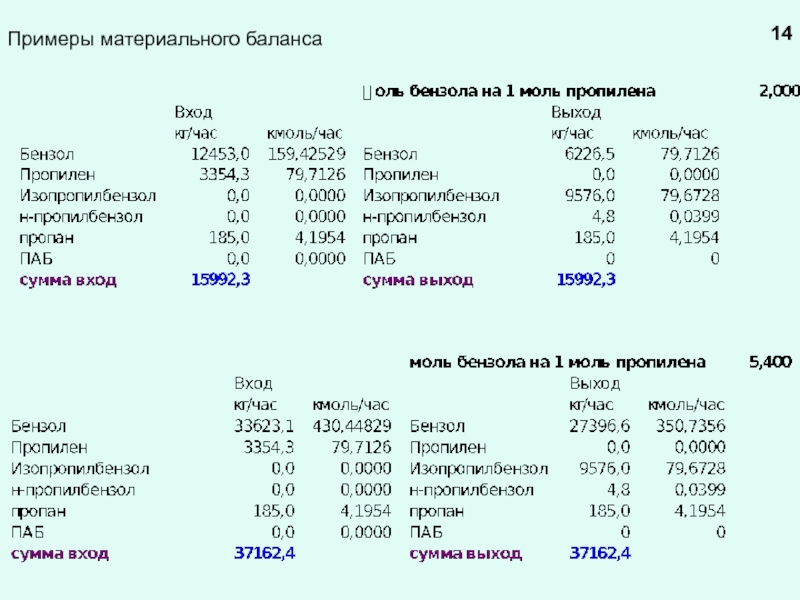
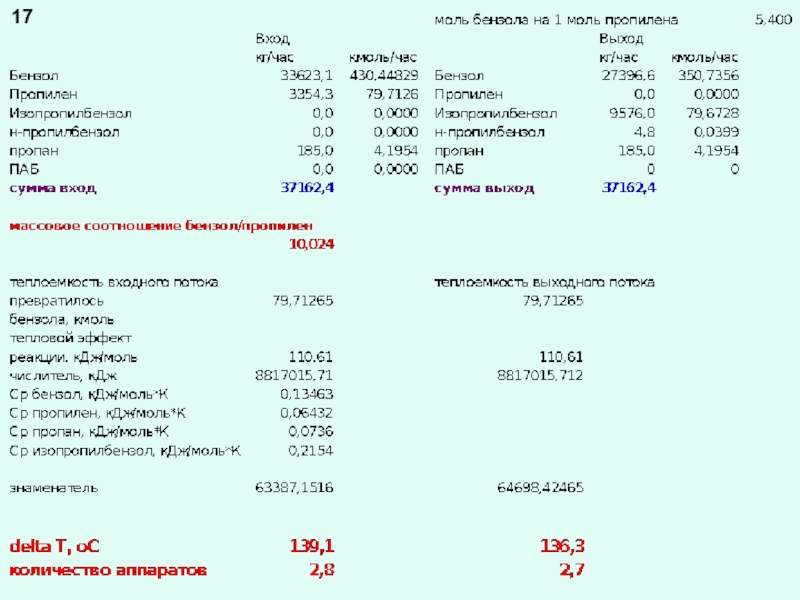
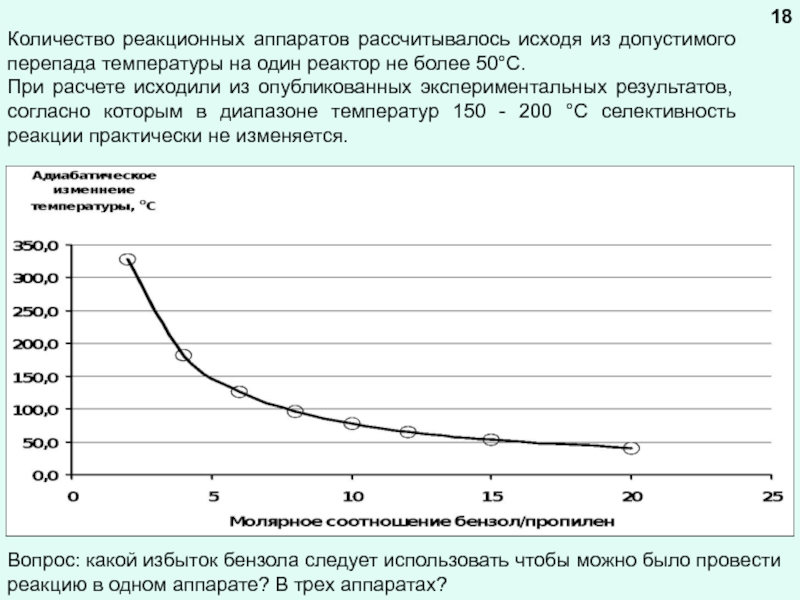
химической реакции (результат теплового эффекта реакции)
за счет фазовых переходов (испарения,
кристаллизации, растворения вещества) за счет теплообмена с окружающей средой (естественного и принудительного);
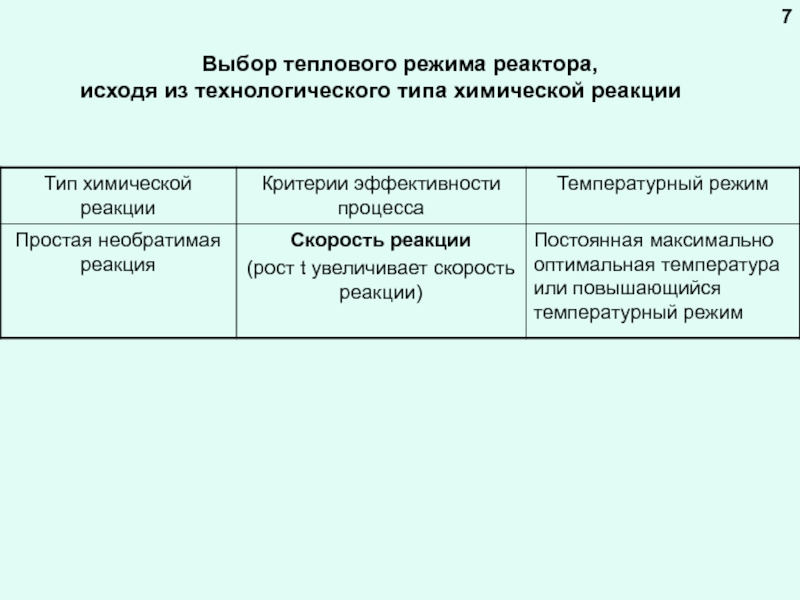
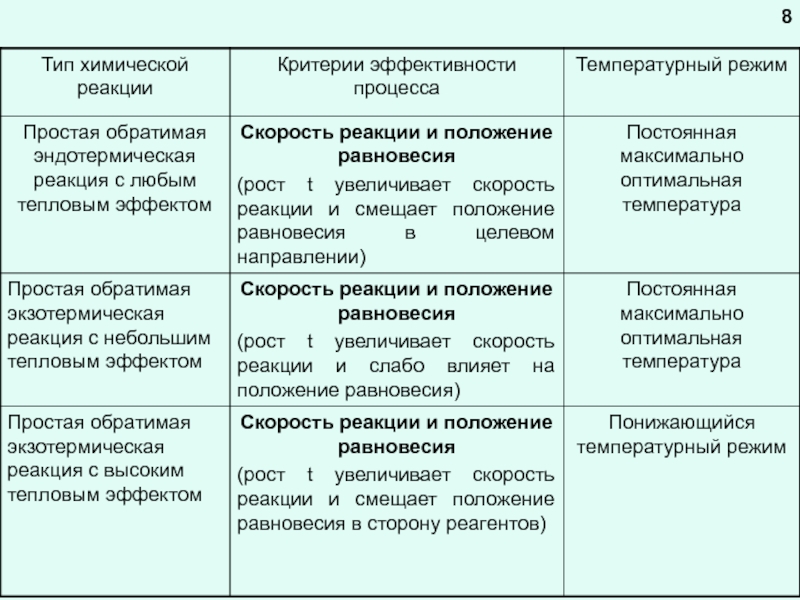
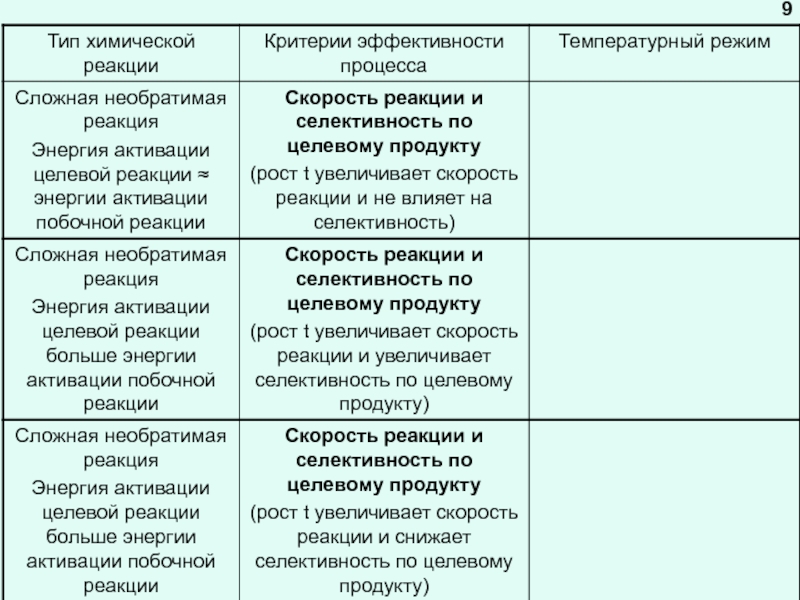
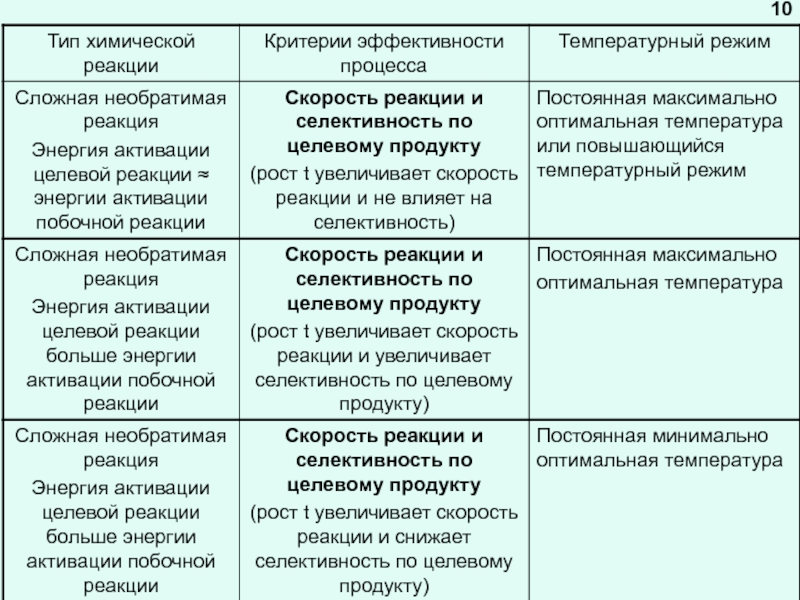
Под температурным режимом реактора подразумеваем поддержание в нем оптимальной для осуществления данной химической реакции температуры (температурного интервала)
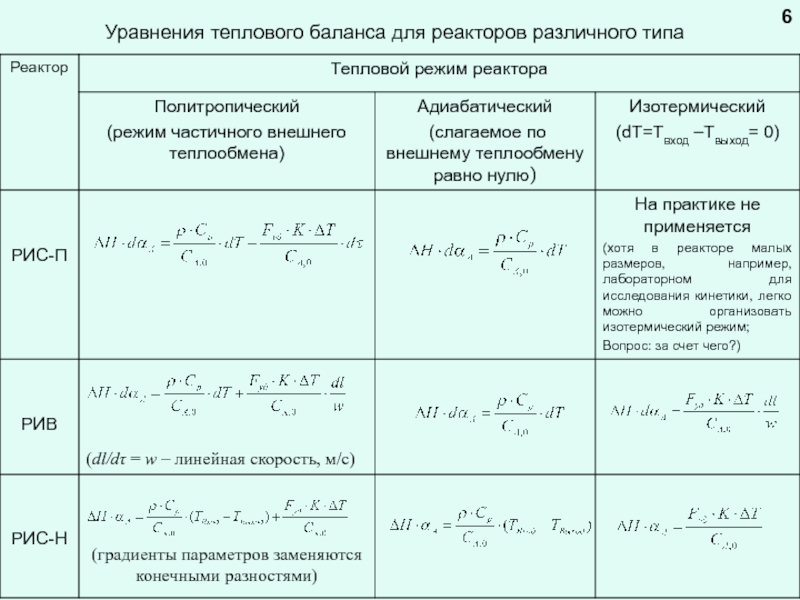
Три варианта теплового режима реактора :
1. Адиабатический
(принудительный теплообмен с окружающей средой отсутствует)
2. Изотермический
(путем подвода или отвода тепла в реакторе поддерживается постоянная рабочая температура)
3. Политропический
(принудительно осуществляется частичный подвод или отвод тепла)
1