Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тиолы, тиоэфиры, амины
Содержание
- 1. Тиолы, тиоэфиры, амины
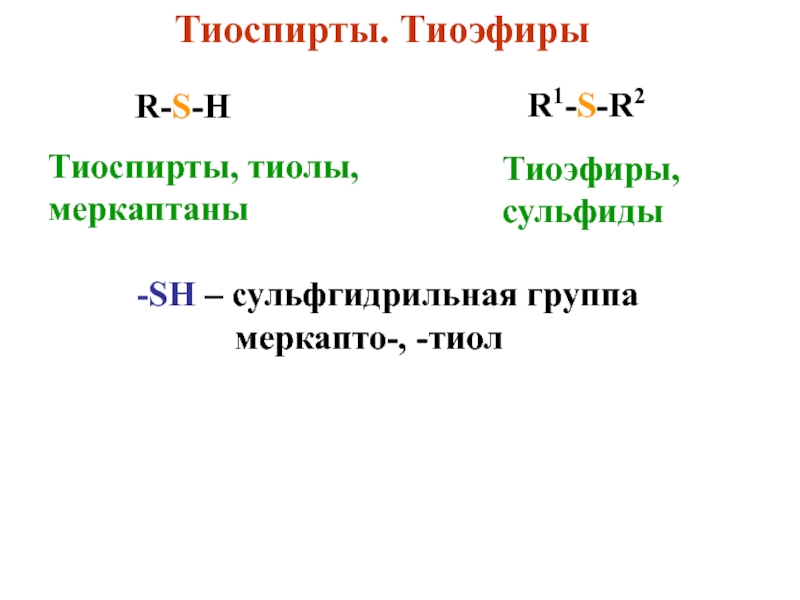
- 2. Тиоспирты. ТиоэфирыR-S-HR1-S-R2Тиоспирты, тиолы, меркаптаныТиоэфиры, сульфиды-SH
- 3. Номенклатура тиоспиртовC3H7-SH - пропантиол-1 (сок лука),
- 4. Номенклатура тиоэфировR1-S-R2 CH3-S-CH3 - диметилсульфидCH3-S-C2H5 - метилэтилсульфидCH3-S-CH2-CH2-CH-COOHNH2метионин2-амино-4-метилтиобутановая
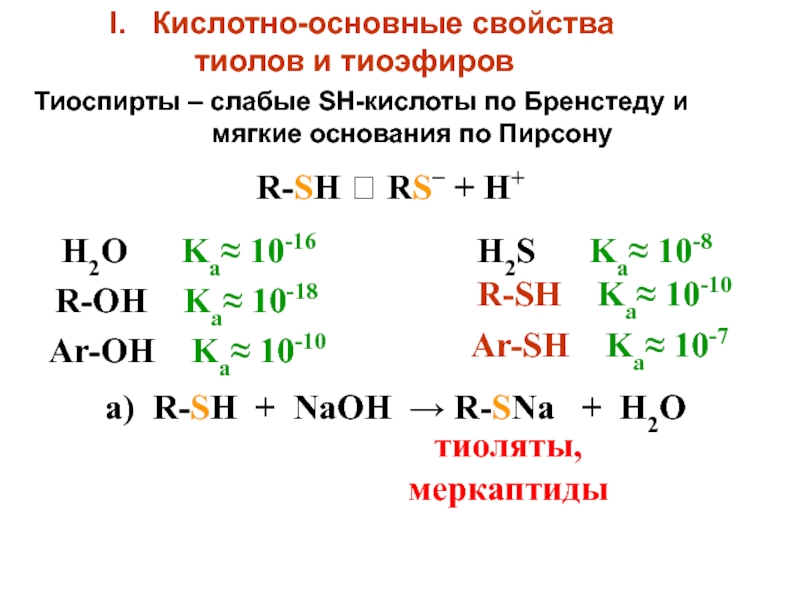
- 5. Кислотно-основные свойства тиолов
- 6. б) 2 R-SH + HgO → R-S-Hg-S-R
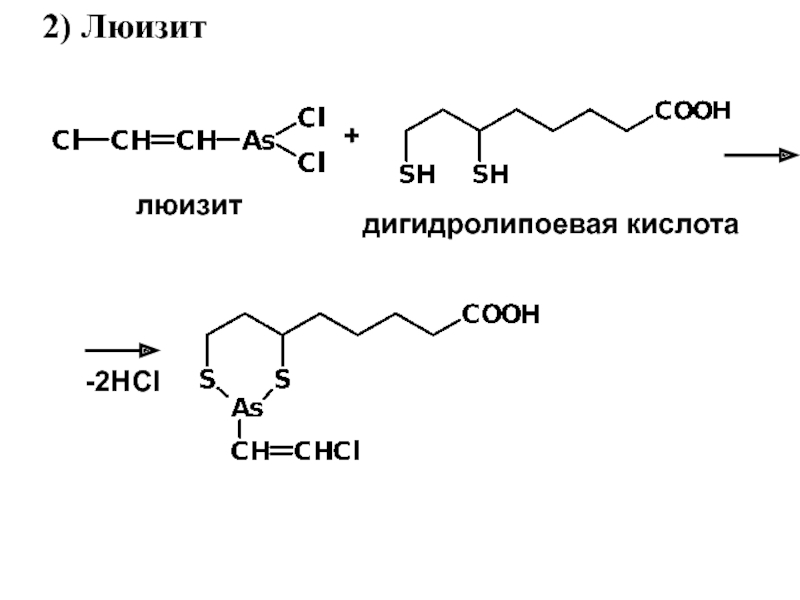
- 7. 2) Люизитлюизит+дигидролипоевая кислота-2HCl
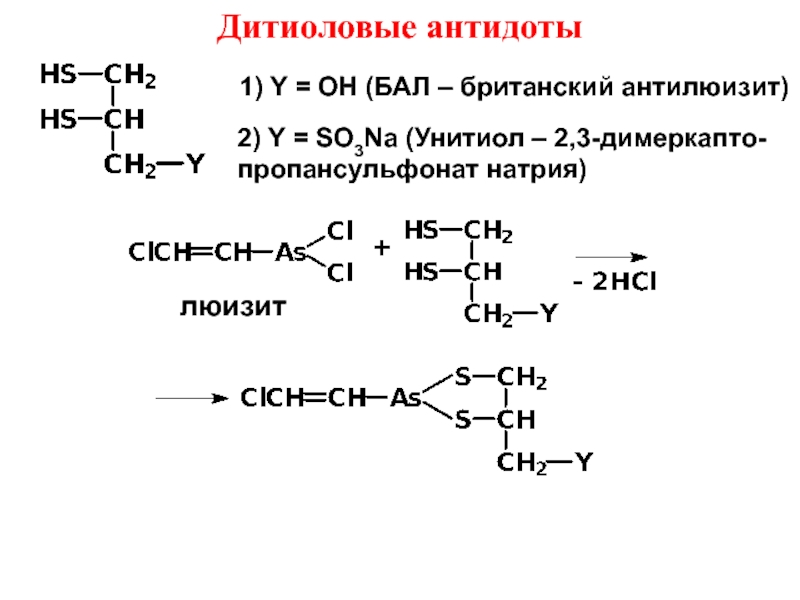
- 8. Дитиоловые антидоты1) Y = OH (БАЛ
- 9. Тиоэфиры – слабые основания по Бренстеду и
- 10. 2. АцилированиеR-S-H + HO-Ac R-S-Ac +
- 11. ацетилкофермент А+холин+кофермент Аацетилхолин
- 12. R1−S−R2..+R3−XВ организме – реакции трансметилирования
- 13. а) Слабым окислителем (О2 воздуха)2 R-S-H [O][H]R-S-S-Rдисульфидб) Сильным окислителемR-S-H [O]R-SO3Hсульфокислота1. Окисление тиоспиртов
- 14. 2[O][H]цистинцистеин
- 15. SHSHSHSHSHSHденатурацияренатурация
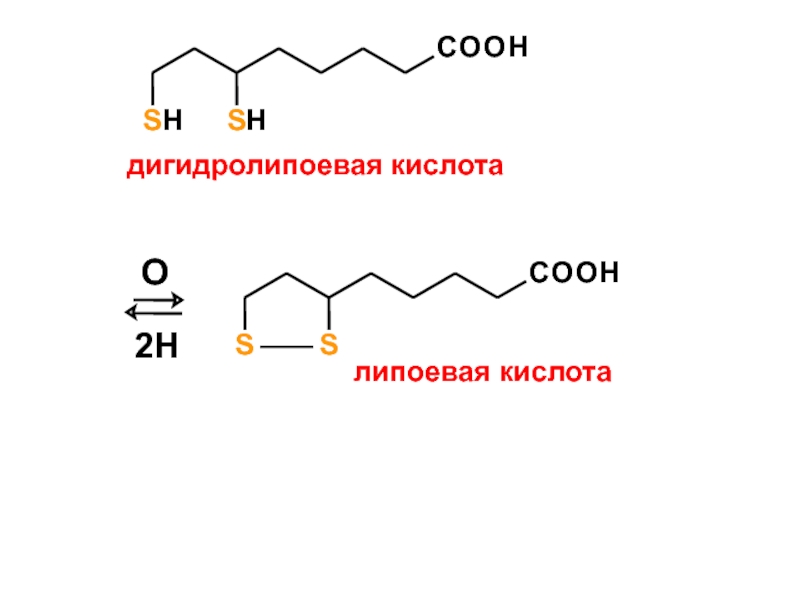
- 16. COOHSHSHдигидролипоевая кислотаCOOHSSлипоевая кислотаО2Н
- 17. 2. Окисление тиоэфиров диметил- сульфондиметилсульфоксид
- 18. Слайд 18
- 19. 1. Первичные (R-NH2)II. В зависимости от числа
- 20. ДиаминыH2N(CH2)4NH2H2N(CH2)5NH2путресцинкадаверинтоксичные продукты разложения белков
- 21. 1. Ацилирование (для первичных и вторичных аминов)+HO-Ac-
- 22. Особенности реакций SE у ароматических аминов1. Легкое
- 23. 2. Реакция с азотистой кислотой (нитрозирование)NaNO2 +
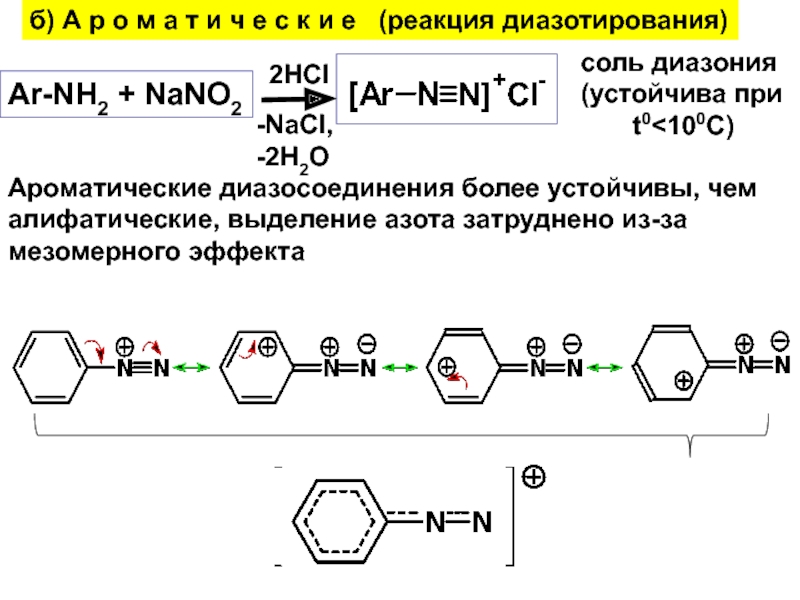
- 24. б) А р о м а т
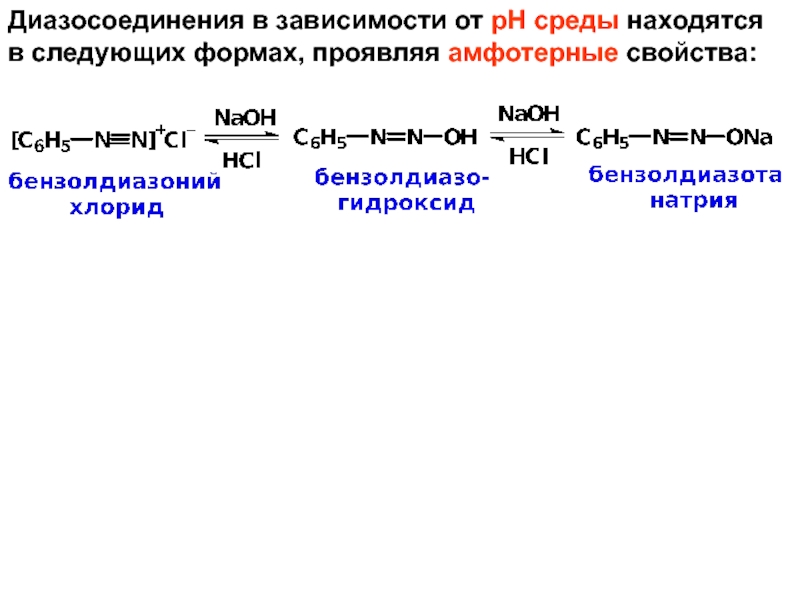
- 25. Диазосоединения в зависимости от рН среды находятся в следующих формах, проявляя амфотерные свойства:
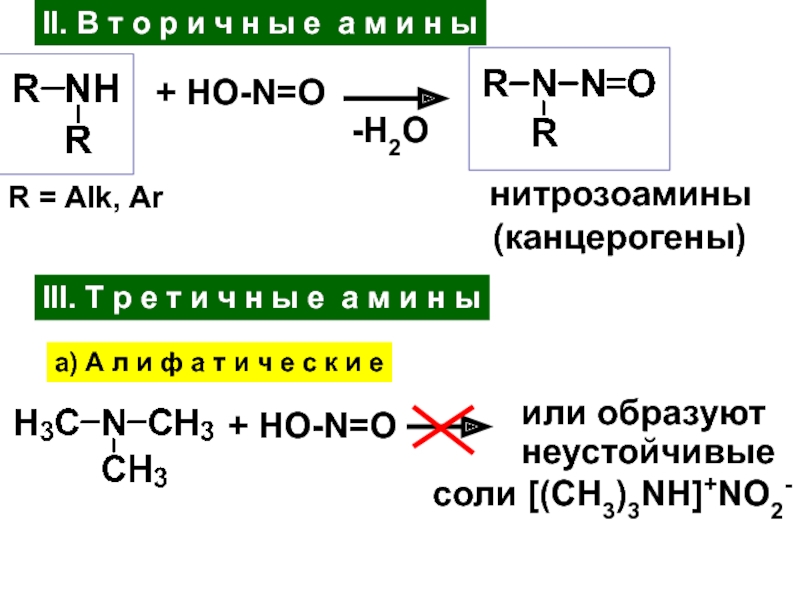
- 26. III. Т р е т и ч
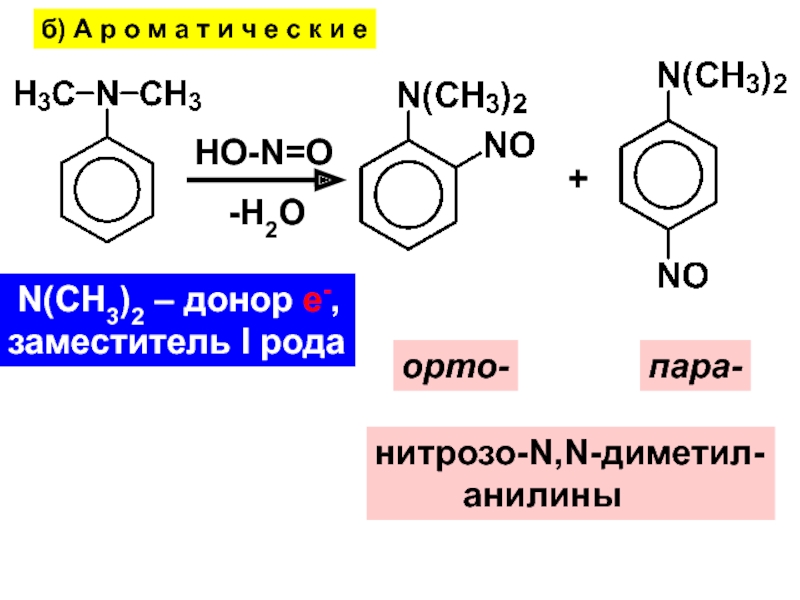
- 27. б) А р о м а т
- 28. СВОЙСТВА СОЛЕЙ ДИАЗОНИЯH2ON2↑ + Ar-OHKSHN2↑ + Ar-SHCuCNN2↑
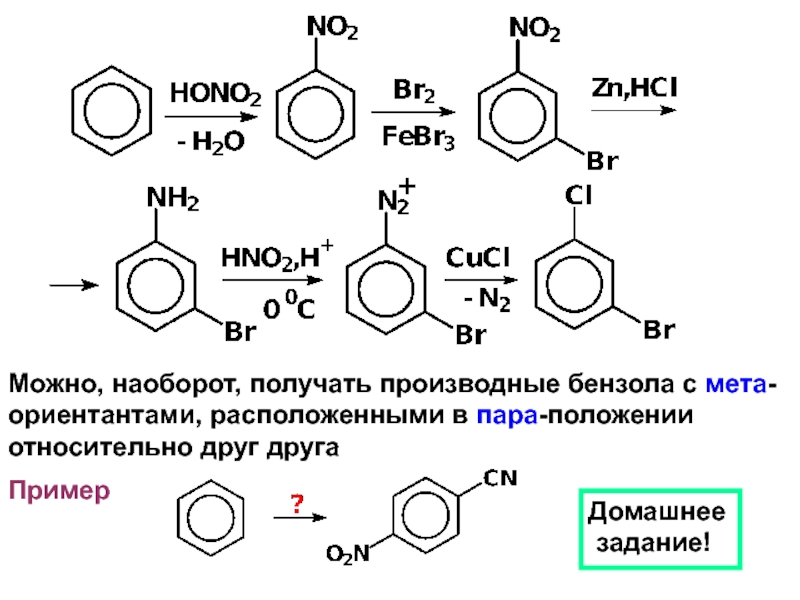
- 29. Можно, наоборот, получать производные бензола с мета-ориентантами, расположенными в пара-положенииотносительно друг друга ПримерДомашнее задание!
- 30. АЗОСОЧЕТАНИЕРеакции образования азосоединений, в которых азо-группа (-N=N-)
- 31. Механизм – электрофильное замещение SE
- 32. диазосоставляющаяNaNO2диазосоединениеHClПример+азосоединение-HClметилоранж (индикатор)пара-сульфани- ловая кислота
- 33. 3. Реакция Гофмана – алкилирование амми-
- 34. II. Основные и кислотные свойства аминов,
- 35. Амины R2NHАмидыНитрилы R-C≡N sp-гибридиз.,> ОЭО
- 36. КомплексообразованиеАмины, как и аммиак являются лигандами, НО!
- 37. Способы получения аминова) нитросоединенийН.Н.Зинин, 1842 г.В
- 38. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Тиоспирты. Тиоэфиры
R-S-H
R1-S-R2
Тиоспирты, тиолы,
меркаптаны
Тиоэфиры,
сульфиды
-SH – сульфгидрильная группа
Слайд 3Номенклатура тиоспиртов
C3H7-SH - пропантиол-1 (сок лука),
пропилмеркаптан
C4H9-SH - бутантиол-1 (выделения
скунса),бутилмеркаптан
цистеин,
3-меркапто-2-аминопропановая кислота
Физическое свойство меркаптанов –
отвратительный запах!
Слайд 4Номенклатура тиоэфиров
R1-S-R2
CH3-S-CH3 - диметилсульфид
CH3-S-C2H5 - метилэтилсульфид
CH3-S-CH2-CH2-CH-COOH
NH2
метионин
2-амино-4-метилтиобутановая кислота
(CH2=СН-СН2)2S - диаллилсульфид
(сок чеснока)
Слайд 5Кислотно-основные свойства
тиолов и тиоэфиров
R-SH RS−
+ H+
H2O Ka≈ 10-16
R-OH Ka≈ 10-18
H2S
Ka≈ 10-8R-SH Ka≈ 10-10
а) R-SH + NaOH → R-SNa + H2O
тиоляты,
меркаптиды
Тиоспирты – слабые SH-кислоты по Бренстеду и
мягкие основания по Пирсону
Ar-OH Ka≈ 10-10
Ar-SH Ka≈ 10-7
Слайд 6б) 2 R-SH + HgO → R-S-Hg-S-R ↓ + H2O
Тиоляты
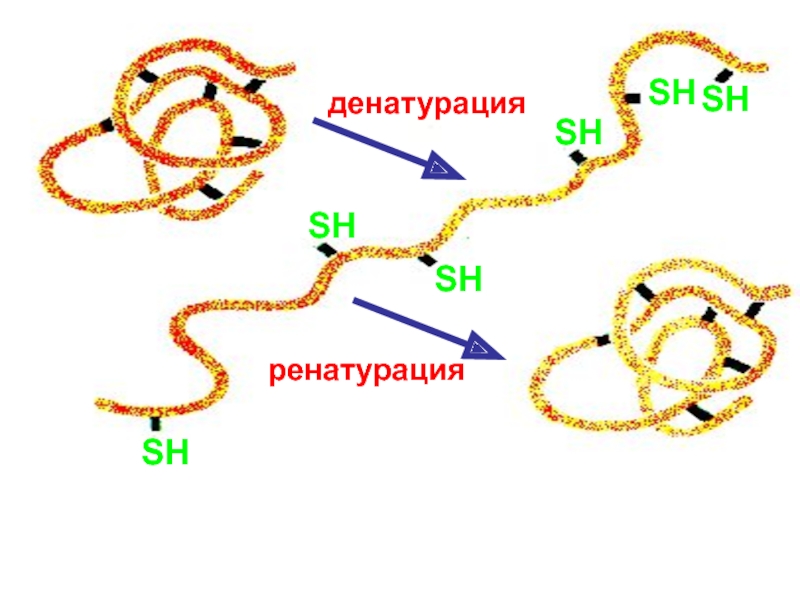
тяжелых металлов нерастворимы – дезактивация ферментов с группой
-SHТиоловые яды:
1) Катионы тяжелых металлов:
Ag+, Cu+2, Hg+2, Zn+2, Sb+3, Pb+2, Bi+3, As+3
м.о. м.к. (по принципу ЖМКО)
«меркаптан»
от лат. mercurius captans – захватывающий ртуть
Слайд 8 Дитиоловые антидоты
1) Y = OH (БАЛ – британский антилюизит)
2)
Y = SO3Na (Унитиол – 2,3-димеркапто-
пропансульфонат натрия)
люизит
Слайд 9Тиоэфиры – слабые основания по Бренстеду и
мягкие основания
по ПирсонуR-S-R1 + H+ T (слабое взаимодействие)
м.о. ж.к.
м.о. м.к. (по принципу ЖМКО)
R-S-R1 + Hg2+ (Ag+) T прочные комплексы
II. Нуклеофильные свойства тиолов и тиоэфиров
Хорошие нуклеофилы!
Причины: 1) мягкие основания по Пирсону, проявляют
сродство к мягкой кислоте – атому углерода;
2) не образуют водородных связей с рас-
творителями и электронные пары доступны
для органических реагентов.
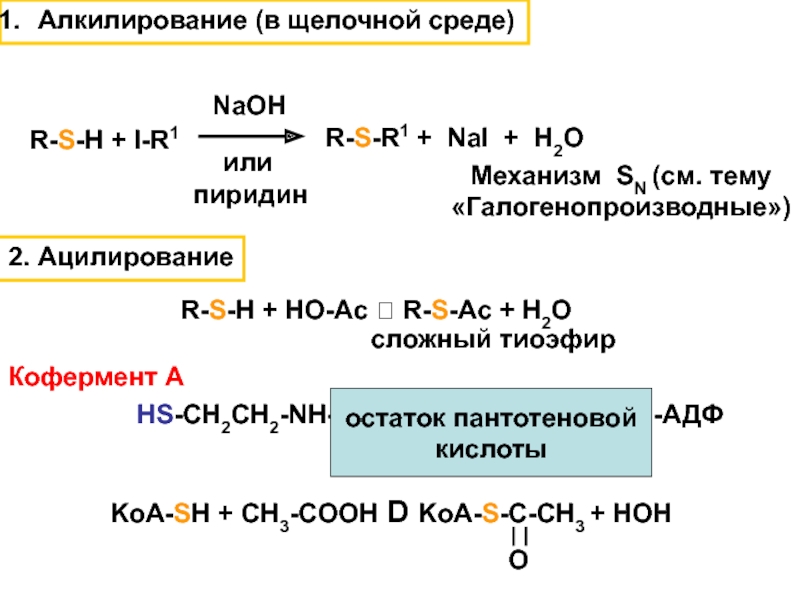
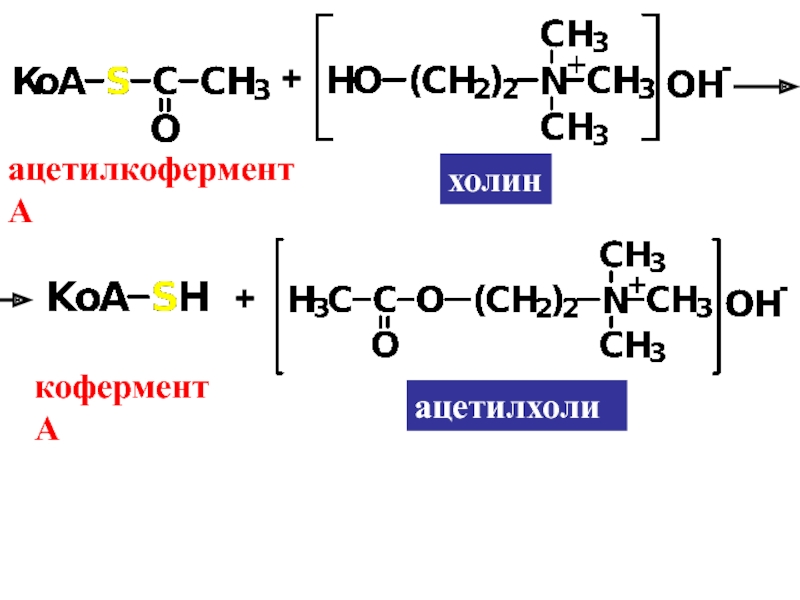
Слайд 102. Ацилирование
R-S-H + HO-Ac R-S-Ac + H2O
сложный тиоэфир
Кофермент
А
KoA-SH + CH3-COOH D KoA-S-C-CH3 + HOH
O
HS-CH2CH2-NH-
остаток пантотеновой
кислоты
-АДФ
Алкилирование (в щелочной
среде)Механизм SN (см. тему
«Галогенопроизводные»)
R-S-H + I-R1
R-S-R1 + NaI + H2O
NaOH
или
пиридин
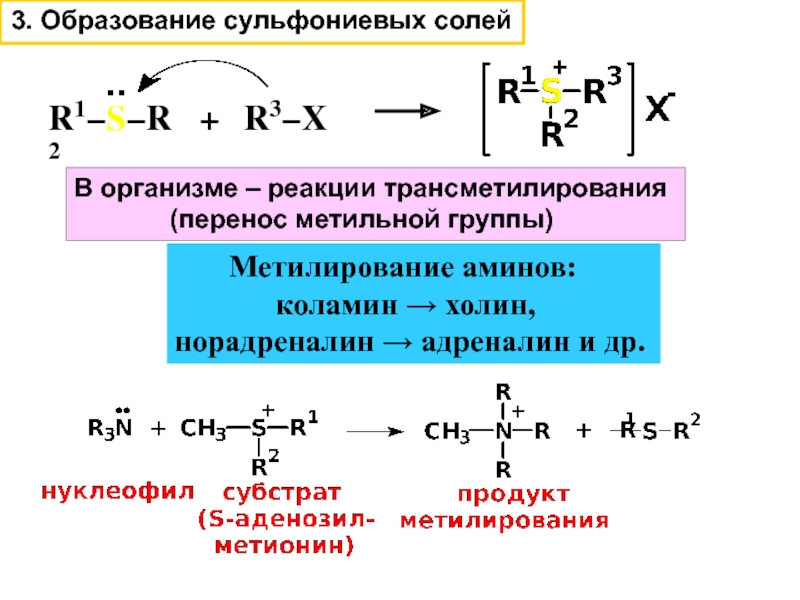
Слайд 12R1−S−R2
..
+
R3−X
В организме – реакции трансметилирования
(перенос метильной группы)
Метилирование аминов:
коламин → холин, норадреналин → адреналин и др.
3. Образование сульфониевых солей
+
Слайд 13а) Слабым окислителем (О2 воздуха)
2 R-S-H
[O]
[H]
R-S-S-R
дисульфид
б) Сильным окислителем
R-S-H
[O]
R-SO3H
сульфокислота
1.
Окисление тиоспиртов
Слайд 172. Окисление тиоэфиров
диметил-
сульфон
диметилсульфоксид
(ДМСО)
димексид
O
O
O
CH3
S
CH3
CH3
S
CH3
CH3
S
CH3
[O]
[O]
(проникает через биологические мембраны,
анальгетическое и противовоспалительное
средство,
применяется в дерматологии)Слайд 18
Амины –
органические производные аммиака
I. В зависимости от природы
радикала:Классификация и номенклатура аминов
Алифатические (R =Alk),
2. Ароматические (R = Ar),
3. Гетероциклические (R = гетерил).
Слайд 191. Первичные (R-NH2)
II. В зависимости от числа замещенных
на радикалы атомов
водорода аммиака
2. Вторичные (R1-NH-R2)
3. Третичные (R1-N-R2)
R3
Четвертичные
аммониевые соли
Например, холин и
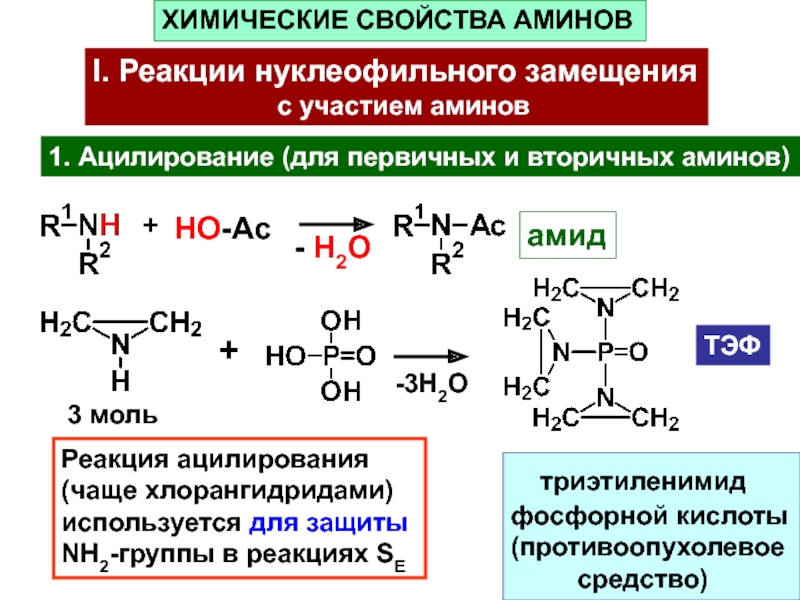
ацетилхолинСлайд 211. Ацилирование (для первичных и вторичных аминов)
+
HO-Ac
- H2O
амид
3 моль
+
-3H2O
ТЭФ
триэтиленимид
фосфорной кислоты
(противоопухолевое
средство)
Реакция ацилирования
(чаще хлорангидридами)
используется
для защитыNH2-группы в реакциях SE
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ
I. Реакции нуклеофильного замещения
с участием аминов
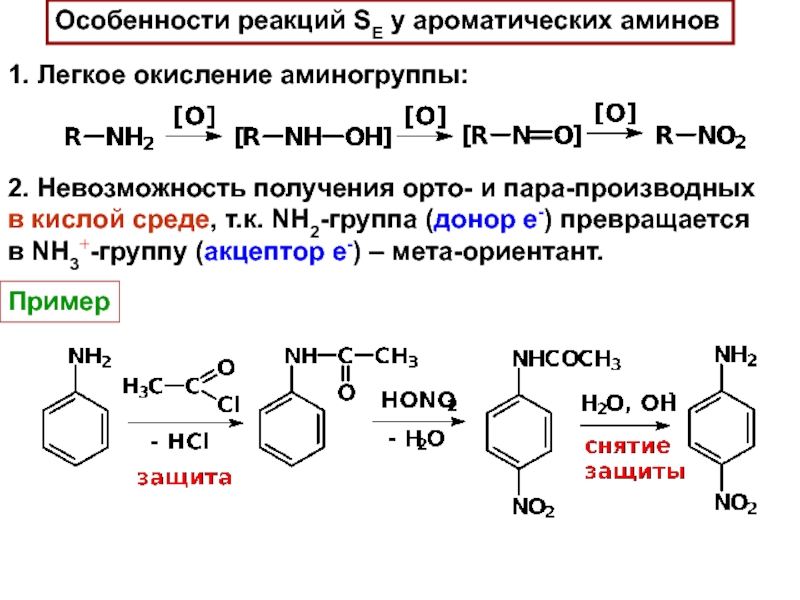
Слайд 22Особенности реакций SE у ароматических аминов
1. Легкое окисление аминогруппы:
2. Невозможность
получения орто- и пара-производных
в кислой среде, т.к. NH2-группа (донор е-)
превращаетсяв NH3+-группу (акцептор е-) – мета-ориентант.
Пример
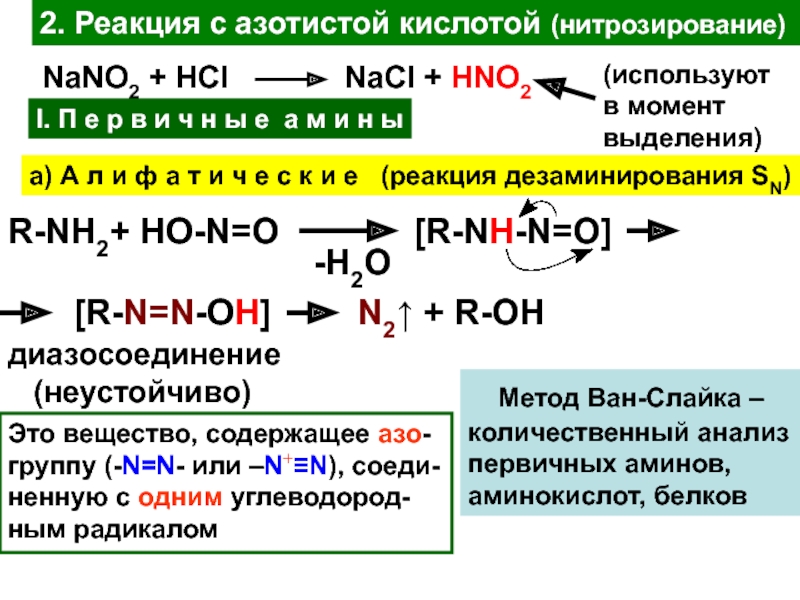
Слайд 232. Реакция с азотистой кислотой (нитрозирование)
NaNO2 + HCl
NaCl + HNO2
I.
П е р в и ч н ы е а
м и н ыа) А л и ф а т и ч е с к и е (реакция дезаминирования SN)
(используют
в момент
выделения)
R-NH2+ HO-N=O
-H2O
[R-NH-N=O]
[R-N=N-OH]
N2↑ + R-OH
диазосоединение
(неустойчиво)
Метод Ван-Слайка –
количественный анализ
первичных аминов,
аминокислот, белков
Это вещество, содержащее азо-
группу (-N=N- или –N+≡N), соеди-
ненную с одним углеводород-
ным радикалом
Слайд 24б) А р о м а т и ч е
с к и е (реакция диазотирования)
Ar-NH2 + NaNO2
2HCl
-NaCl,
-2H2O
cоль
диазония(устойчива при
t0<100C)
Ароматические диазосоединения более устойчивы, чем
алифатические, выделение азота затруднено из-за
мезомерного эффекта
Слайд 25Диазосоединения в зависимости от рН среды находятся в следующих формах, проявляя
амфотерные свойства:
Слайд 26III. Т р е т и ч н ы е
а м и н ы
а) А л и ф а
т и ч е с к и е+ HO-N=O
неустойчивые
cоли [(CH3)3NH]+NO2-
или образуют
II. В т о р и ч н ы е а м и н ы
+ HO-N=O
-H2O
нитрозоамины
(канцерогены)
R = Alk, Ar
Слайд 27б) А р о м а т и ч е
с к и е
HO-N=O
-Н2О
+
орто-
пара-
нитрозо-N,N-диметил-
анилины
N(CH3)2
– донор е-,заместитель I рода
Слайд 28СВОЙСТВА СОЛЕЙ ДИАЗОНИЯ
H2O
N2↑ + Ar-OH
KSH
N2↑ + Ar-SH
CuCN
N2↑ + Ar-CN
Cu2Br2
N2↑ +
Ar-Br
[Н]
Ar-NH-NH2
азосочетание
*
*
*-реакция Зандмей-
ера (1884 г.) – заме-
на азо-группы на
Br, Cl,
CN и др. вприсутствии солей
Cu(I)
t0
Можно получать производные бензола с орто- и пара-
ориентантами, расположенными в мета-положении
относительно друг друга
Пример
Слайд 29Можно, наоборот, получать производные бензола с мета-
ориентантами, расположенными в пара-положении
относительно
друг друга
Пример
Домашнее
задание!
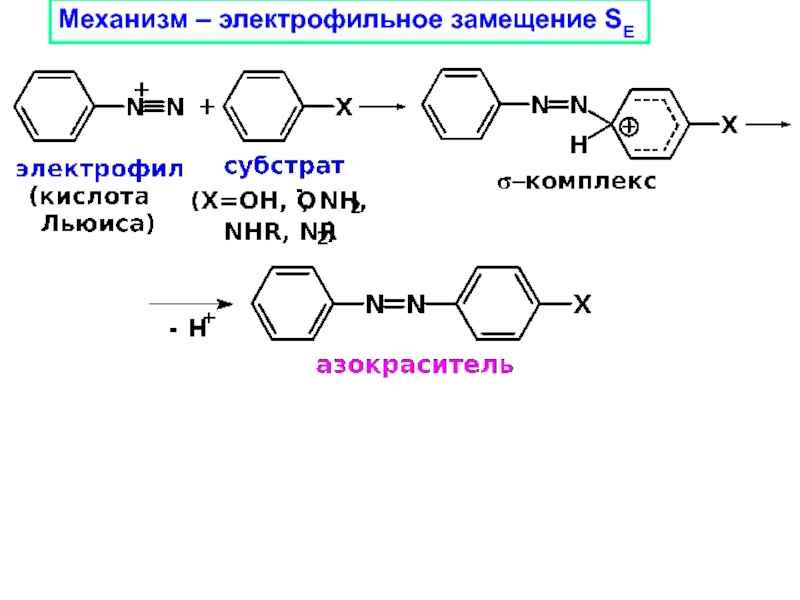
Слайд 30АЗОСОЧЕТАНИЕ
Реакции образования азосоединений, в которых
азо-группа (-N=N-) соединена с двумя
радикалами
Диазосоставляющая – первичный ароматический амин
(содержащий желательно заместитель II рода)
Азосоставляющая –
ароматическое соединение,содержащее заместитель I рода (фенолы и амины)
Ar1N2+Cl− + H-Ar2-X
- HCl
Ar1-N=N-Ar2-X
«диазо»
«азо»
Азосоединение
(азокраситель)
(индикаторы, лекарства,
красители)
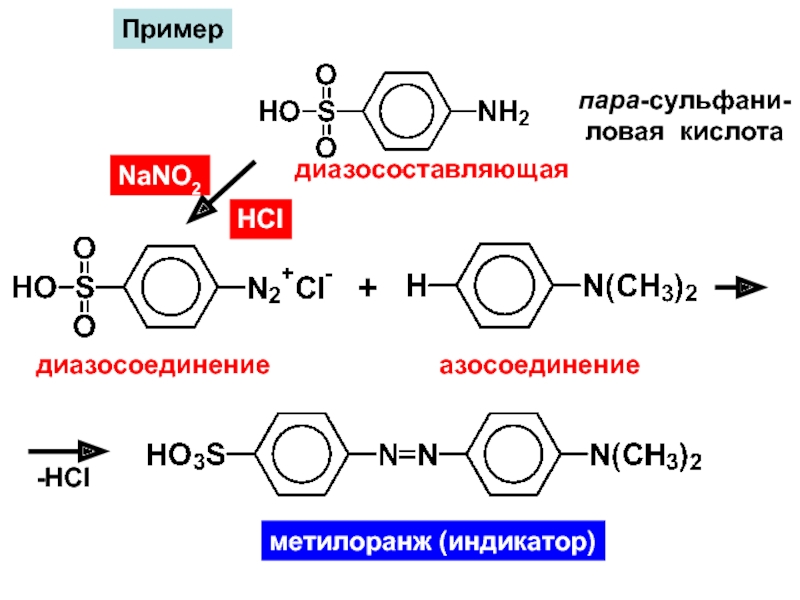
Слайд 32диазосоставляющая
NaNO2
диазосоединение
HCl
Пример
+
азосоединение
-HCl
метилоранж (индикатор)
пара-сульфани-
ловая кислота
Слайд 333. Реакция Гофмана – алкилирование амми-
ака и аминов
NH3 + Rδ+-Xδ−
..
[RNH3]+X-
- NH4X
NH3
R-NH2
R-NH2 + R-X
[R2NH2]+X-
NH3
- NH4X
R2NH
..
Далее – аналогично можно
получить третичныеамины и четвертичные аммониевые соли.
Слайд 34II. Основные и кислотные свойства аминов,
амидов и
нитрилов
>
R-NH2 + HX
..
[R-NH3]+X− ,
где Х – кислотный остаток
>
>
>
>
рKa(ВН+)
≈10,8
≈10,6
≈9,8
≈4,7
≈1
-
Увеличение основных свойств
Амины – слабые основания
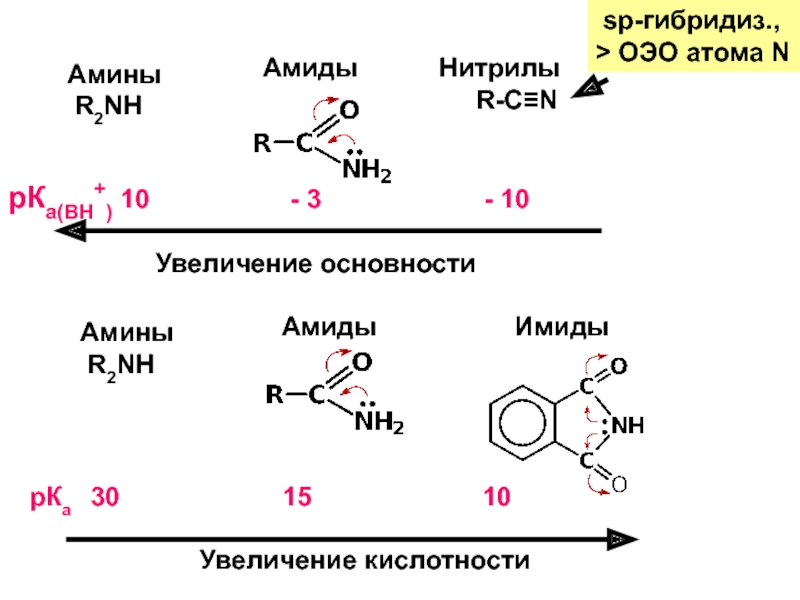
Слайд 35Амины
R2NH
Амиды
Нитрилы
R-C≡N
sp-гибридиз.,
> ОЭО атома N
рКа(ВН+) 10
-
3 - 10Увеличение основности
Амины
R2NH
Амиды
Имиды
рКа 30 15 10
Увеличение кислотности
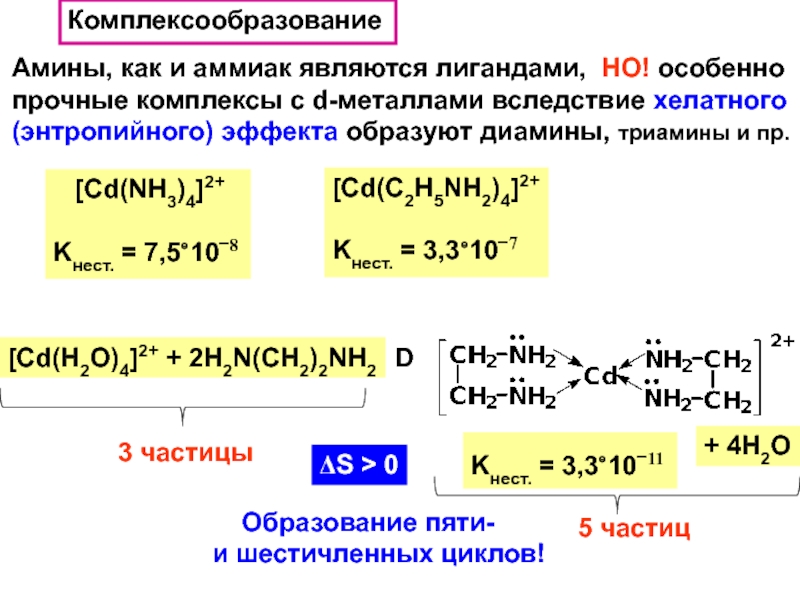
Слайд 36Комплексообразование
Амины, как и аммиак являются лигандами, НО! особенно
прочные комплексы
с d-металлами вследствие хелатного
(энтропийного) эффекта образуют диамины, триамины и пр.
[Cd(NH3)4]2+
Kнест. = 7,5⋅10−8
[Cd(C2H5NH2)4]2+
Kнест. = 3,3⋅10−7
[Cd(H2O)4]2+ + 2H2N(CH2)2NH2
D
+ 4H2O
Kнест. = 3,3⋅10−11
3 частицы
5 частиц
ΔS > 0
Образование пяти-
и шестичленных циклов!
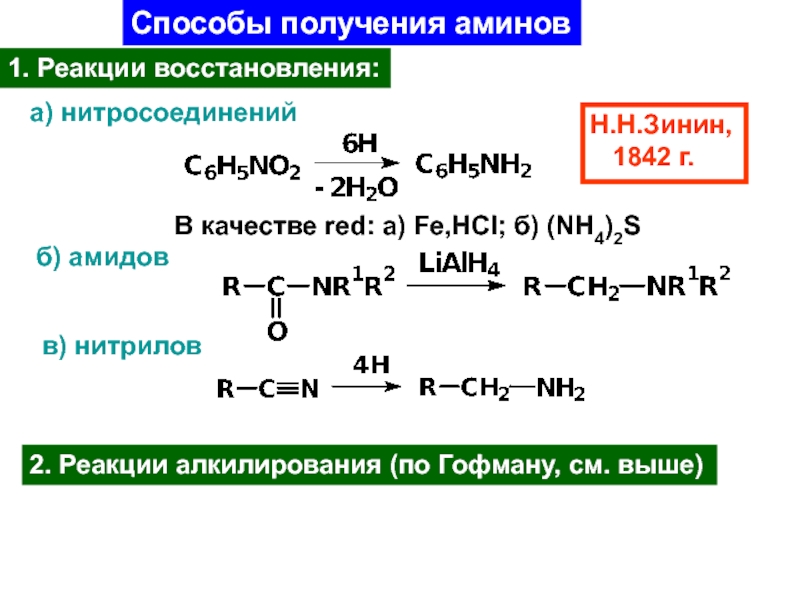
Слайд 37Способы получения аминов
а) нитросоединений
Н.Н.Зинин,
1842 г.
В качестве red: a)
Fe,HCl; б) (NH4)2S
б) амидов
в) нитрилов
2. Реакции алкилирования (по Гофману, см.
выше)1. Реакции восстановления:





![Тиолы, тиоэфиры, амины а) Слабым окислителем (О2 воздуха)2 R-S-H [O][H]R-S-S-Rдисульфидб) Сильным окислителемR-S-H [O]R-SO3Hсульфокислота1. Окисление тиоспиртов а) Слабым окислителем (О2 воздуха)2 R-S-H [O][H]R-S-S-Rдисульфидб) Сильным окислителемR-S-H [O]R-SO3Hсульфокислота1. Окисление тиоспиртов](/img/thumbs/0edf8348f80239dc829631e7311bbca9-800x.jpg)
![Тиолы, тиоэфиры, амины 2[O][H]цистинцистеин 2[O][H]цистинцистеин](/img/thumbs/b56af005b8862feb18b7ae34527e4ebd-800x.jpg)
![Тиолы, тиоэфиры, амины 2. Окисление тиоэфиров диметил- сульфондиметилсульфоксид (ДМСО) 2. Окисление тиоэфиров диметил- сульфондиметилсульфоксид (ДМСО) димексидOOOCH3SCH3CH3SCH3CH3SCH3[O][O](проникает](/img/thumbs/1882611967d75c5f1d172a2e8a6474e4-800x.jpg)



![Тиолы, тиоэфиры, амины СВОЙСТВА СОЛЕЙ ДИАЗОНИЯH2ON2↑ + Ar-OHKSHN2↑ + Ar-SHCuCNN2↑ + Ar-CNCu2Br2N2↑ + Ar-Br[Н]Ar-NH-NH2азосочетание***-реакция СВОЙСТВА СОЛЕЙ ДИАЗОНИЯH2ON2↑ + Ar-OHKSHN2↑ + Ar-SHCuCNN2↑ + Ar-CNCu2Br2N2↑ + Ar-Br[Н]Ar-NH-NH2азосочетание***-реакция Зандмей-ера (1884 г.) – заме-на азо-группы](/img/thumbs/794c2f1e69536fc390b54560e5c6cd4c-800x.jpg)

![Тиолы, тиоэфиры, амины 3. Реакция Гофмана – алкилирование амми- ака и аминов NH3 + 3. Реакция Гофмана – алкилирование амми- ака и аминов NH3 + Rδ+-Xδ−..[RNH3]+X-- NH4XNH3R-NH2R-NH2 + R-X[R2NH2]+X-NH3- NH4XR2NH..Далее](/img/thumbs/ae56f9a5c64128a3152f4fa201f7649a-800x.jpg)
![Тиолы, тиоэфиры, амины II. Основные и кислотные свойства аминов, амидов и нитрилов>R-NH2 + II. Основные и кислотные свойства аминов, амидов и нитрилов>R-NH2 + HX..[R-NH3]+X− ,где Х – кислотный](/img/thumbs/37b5934fa8ba845a95a915ba32374118-800x.jpg)