Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углекислый газ
Содержание
- 1. Углекислый газ
- 2. Углекислый газ- бесцветный, без запаха. Он почти
- 3. СтроениеМолекула углекислого газа состоит из трех атомов
- 4. Химические свойстваПри нагревании углекислый газ распадается на
- 5. Углекислый газ не поддерживает горения, в нем
- 6. Физические свойстваГаз тяжелее воздуха (Mr=44), бесцветный, без
- 7. ПолучениеВ промышленности:Углекислый газ получают из печных газов,
- 8. В лаборатории:В лабораторных условиях углекислый газ получают при взаимодействии карбонатов (CaCO3) с соляной кислотой. CaCo3+2HCl=CaCl2+CO2+H2O
- 9. Применение Пищевая промышленность не может обойтись без
- 10. Также оксид четырехвалентного углерода, который выделяется в
- 11. Спасибо за внимание!
- 12. Скачать презентанцию
Слайды и текст этой презентации
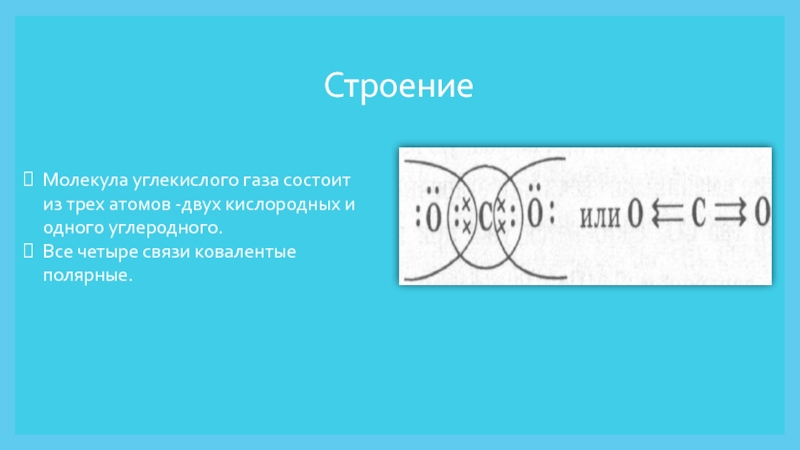
Слайд 3Строение
Молекула углекислого газа состоит из трех атомов -двух кислородных и
одного углеродного.
Все четыре связи ковалентые полярные.
Слайд 4Химические свойства
При нагревании углекислый газ распадается на угарный газ и
кислород:
2CO2 = 2CO + O2
Как и для всех кислотных оксидов, для
углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:CaO + CO2 = CaCO3
Al2O3 + 3CO2 = Al2(CO3)3
Слайд 5Углекислый газ не поддерживает горения, в нем горят только активные
металлы:
CO2 + 2Mg = C + 2MgO (t)
CO2 + 2Ca = C
+ 2CaO (t)Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
CO2 + 4H2 = CH4 + 2H2O
CO2 + C = 2CO (t )
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
2CO2 + 2Na2O2 = 2Na2CO3 + O2↑
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
Слайд 6Физические свойства
Газ тяжелее воздуха (Mr=44), бесцветный, без запаха, хорошо растворяется
в воде с образованием слабой кислоты:
СО2+Н2О=Н2СО3Слайд 7Получение
В промышленности:
Углекислый газ получают из печных газов, из продуктов разложения
природных карбонатов (известняк, доломит).
При получении углекислого газа в промышленных масштабах
используют три основные группы сырья:Группа 1 - источники сырья, из которых можно производить чистый СО 2 без специального оборудования для повышения его концентрации.
Группа 2 - источники сырья, использование которых обеспечивает получение чистого СО 2
Группа 3 - источники сырья, использование которых дает возможность производить чистый СО 2только с помощью специального оборудования
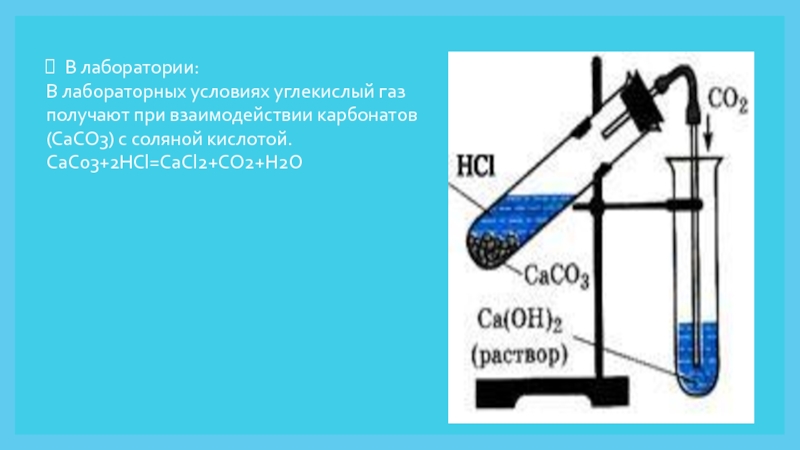
Слайд 8В лаборатории:
В лабораторных условиях углекислый газ получают при взаимодействии карбонатов
(CaCO3) с соляной кислотой.
CaCo3+2HCl=CaCl2+CO2+H2O
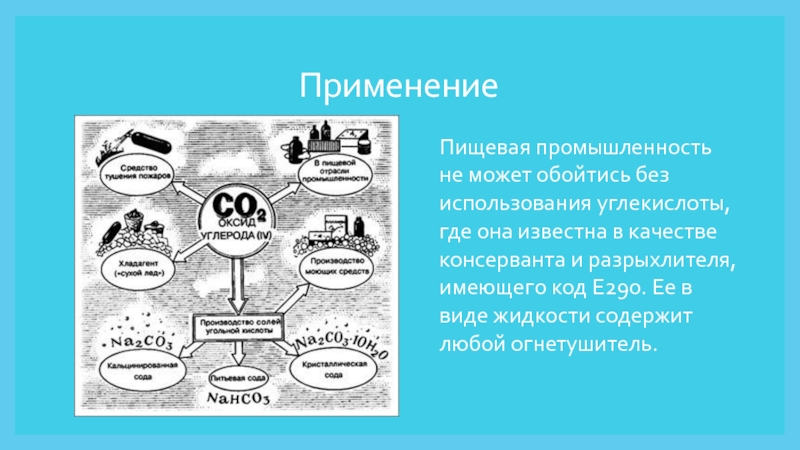
Слайд 9Применение
Пищевая промышленность не может обойтись без использования углекислоты, где
она известна в качестве консерванта и разрыхлителя, имеющего код E290.
Ее в виде жидкости содержит любой огнетушитель. s://www.syl.ru/article/98447/uglekislyiy-gaz-svoystva-poluchenie-primenenieСлайд 10Также оксид четырехвалентного углерода, который выделяется в процессе брожения, служит
хорошей подкормкой аквариумным растениям.
Он содержится и во всем известной
газировке, которую многие довольно часто покупают в продуктовом магазине. Сварка проволокой происходит в углекислой среде, но если температура данного процесса очень высока, то он сопровождается диссоциацией углекислоты, при которой выделяется кислород, окисляющий металл.
Углекислым газом накачивают велосипедные колеса, он присутствует и в баллончиках пневматического оружия .