Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
vi топ элементтері. оттегі, күкірт қасиеттері және қосылыстары
Содержание
- 1. vi топ элементтері. оттегі, күкірт қасиеттері және қосылыстары
- 2. ЖоспарVI топ элементтіОттегі, шығу тарихыАлынуы, физико-химиялық қасиеттеріКүкіртФизико-химиялық қасиеттеріТабиғатта таралуы, қолданылуыҚорытындыПайдаланған әдебиеттер
- 3. Халькогендер – периодтық жүйенің VI A-тобы элементтерінің
- 4. Оттегі ( латынша Oxygenium ) , O–
- 5. АлынуыОттегін өнеркәсіпте ауаны қысып сұйылтады да ,
- 6. Физикалық қасиеттеріОттектің кейбір физикалық қасиеттері бұрыннан белгілі
- 7. Химиядық қасиеттеріХимиялық қасиеттері Оттегі қыздырған кезде көптеген
- 8. Слайд 8
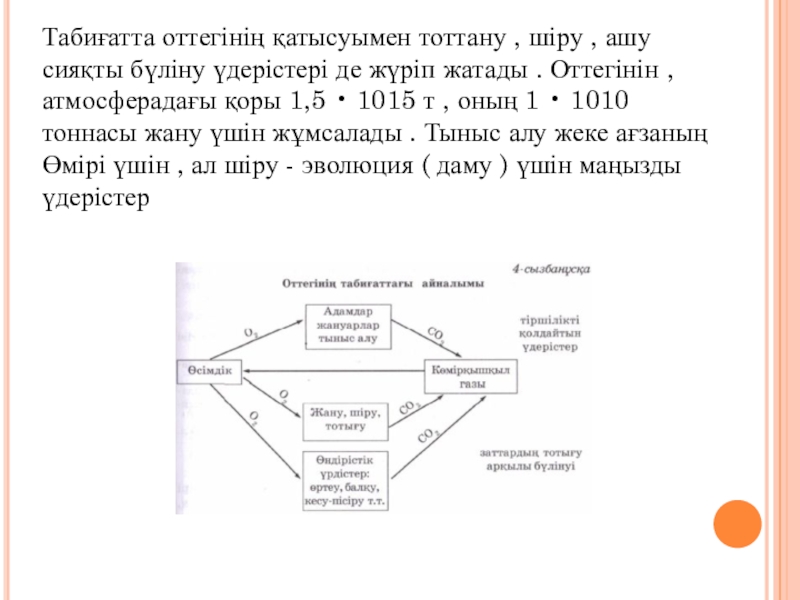
- 9. Табиғатта оттегінің қатысуымен тоттану , шіру ,
- 10. Оттегінің аллотропиялық түр өзгерістері Озон Оттегі табиғатта
- 11. Слайд 11
- 12. КүкіртКүкірт Күкірт ( ағылш . Sulfur )
- 13. Периодтық жүйедегі орны Күкірттің жануы Күкірт |||
- 14. Химиялық қасиеттеріКүкірт химиялық реакцияларда тотықтырғыш та,тотықсыздандырғыш та
- 15. Табиғатта таралуы Күкірттің табиғи қосылыстары Балқаш ,
- 16. ҚолданылуыКүкірт каучукты резинаға айналдыру ( вулканизация )
- 17. Пайдаланған әдебиеттер•1. Б.А.Бірімжанов , Н.Н.Нұрахметов . Жалпы
- 18. Слайд 18
- 19. Скачать презентанцию
ЖоспарVI топ элементтіОттегі, шығу тарихыАлынуы, физико-химиялық қасиеттеріКүкіртФизико-химиялық қасиеттеріТабиғатта таралуы, қолданылуыҚорытындыПайдаланған әдебиеттер
Слайды и текст этой презентации
Слайд 1vi топ элементтері. оттегі, күкірт қасиеттері және қосылыстары
Орындаған: Байбатыр. Г
Тексерген:
Тулегенова. Г
Слайд 2Жоспар
VI топ элементті
Оттегі, шығу тарихы
Алынуы, физико-химиялық қасиеттері
Күкірт
Физико-химиялық қасиеттері
Табиғатта таралуы, қолданылуы
Қорытынды
Пайдаланған
әдебиеттер
Слайд 3Халькогендер – периодтық жүйенің VI A-тобы элементтерінің топтық атауы. Топқа
оттегі О, күкірт S, селен Se,теллур Te,полоний Po элементтері жатады.
Бұл элементтер атомдарының валенттік деңгейлерінің электрондық формуласы ns2np4. Оттегі қосылыстарда көбінесе теріс жирек - II, сирек - I тотығу дәрежелерін көрсетеді. Басқа халькогендерге +IV және +VI, сонымен бірге -II тотығу дәрежелері тән. Электртерістіктері бойынша О және S -бейметалдар, ал Se, Te және Po - амфотерлі элементтер; Se мен Te бейметалдық, ал Po металдық қасиеттерді басымырақ көрсетеді.Бос күйінде оттегі O2 - газ, ал күкірт және оның аналогтары- қатты заттар. Оттегіден полонийға қарай жай заттардың тотықтыру мүмкіндіктері азаяды.Слайд 4Оттегі ( латынша Oxygenium ) , O– элементтердің периодты жүйесінің
VІ - тобындағы химиялық элемент . Реттік нөмірі 8 ,
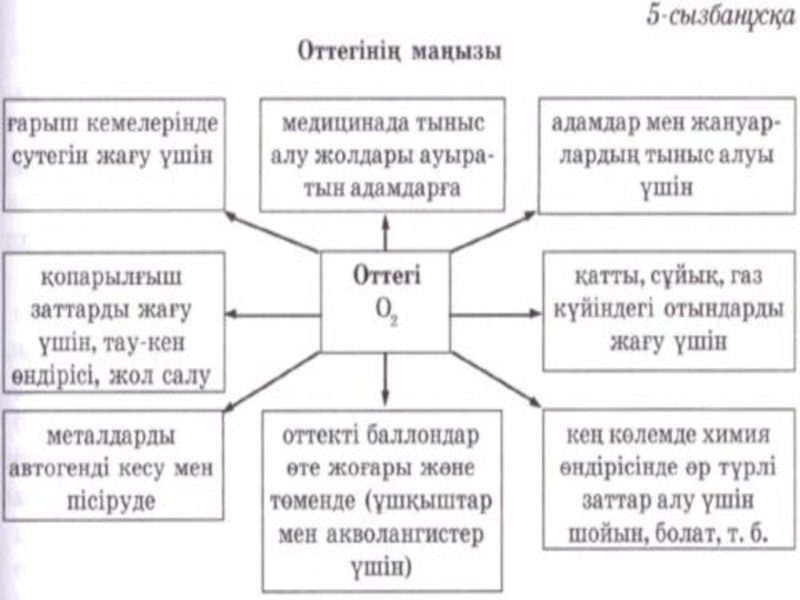
атом массасы 15,999 . Оттегі — Химияның ең маңызды элементі және Жер бетіндегі Көптеген тірі ағзалардың тыныс алуын қамтамасыз етеді . Оттегісіз біз бірнеше минут қана өмір сүре аламыз . Жасушалар мен талшықтар өмір тіршілігіне қажетті Өздеріндегі энергияны босата отырып , органикалық заттарды тотықтыру үшін оттегіні пайдаланадыСлайд 5Алынуы
Оттегін өнеркәсіпте ауаны қысып сұйылтады да , азот пен оттегінің
қайнау температураларының айырмашылығына қарай буландырып бөліп алады . Осылайша алынған
оттегі көгілдір түсті баллондарда сақталады , себебі сұйық оттегі ашық - көгілдір түсті болады . Ал зертханалық алу әдістері кейбір оттегіге бай күрделі қосылыстарды айыруға негізделген Тұрмыста жиі қолданылатын « марганцовканы » айыру . Ол үшін құрғақ сынауыққа аздаған түйірлерін салып , Оның аузын газ шығатын түтігі бар тығынмен жауып қыздырамызСлайд 6Физикалық қасиеттері
Оттектің кейбір физикалық қасиеттері бұрыннан белгілі . Ол иіссіз
, Дәмсіз , түссіз газ . Сондықтан оны ауадан ажырату
қиын . Тек он сегізінші ғасырда тәжірибе жүзінде ағылшын химигі Дж . Пристли ( 1774 ж . ) мен швед ғалымы К. Шееле ( 1772 ж . ) оттекті бос күйінде алып , оның ауаның құрамдас бөлігі екенін дәлелдеді . Оттек ауадан сәл ауыр . 0 ° С - та және бір атм қысымда ( 101,325 кПа ) оның бір литрінің массасы 1,43 грамм , ал ауаныкі - 1,29 грамм тартады . Оттектің физикалық қасиеті Оттек суда аз ериді . Қалыпты жағдайда 20 ° С - та және 1 атм қысымда судың 100 көлемінде небәрі З көлем оттек газы ериді . Осы қасиетіне орай , арнайы газ өлшегіш деп аталатын шыны аспаптағы суды ығыстыру арқылы оттек газын жинап сақтауға болады . Оттек - 183 ° С - та сұйылады , - 218 ° С - та қатады .Слайд 7Химиядық қасиеттері
Химиялық қасиеттері Оттегі қыздырған кезде көптеген заттармен әрекеттеседі ,
бұл үдеріс жану деп аталады , ол жылу мен жарықты
бөле жүреді . Жай заттармен әрекеттесуі Бейметалдармен әрекеттесуін көру үшін оттегі толтырылған сынауыққа көмірдің түйірін салсақ , ол жарқырап жана бастайды : C + 02 = CO2 Түзілген көмір қышқыл газын әк суына жіберсек Оның лайланатыны сендерге белгілі . Бұдан басқа күкірт , фосфор , т.б. бейметалдар да оттегінде жанады : S + 02 = SO24P + 502 = 2P205 Кейбір металдар да оттегінде жанып оксидтер түзеді . Мысалы , оттегімен Толтырылған сынауыққа магний ұнтақтарын сепсек , оның жарқырап жанғанын көруге болады . 2Mg + O2 = 2Mgo Болат сымның ұшына кішкентай көмір түйірін шаншып алып , оны тұтатып оттегімен толтырылған ыдысқа салсақ жанған КӨмірден бөлінген жылудың әсерінен темiр жана бастайды .Слайд 9Табиғатта оттегінің қатысуымен тоттану , шіру , ашу сияқты бүліну
үдерістері де жүріп жатады . Оттегінін , атмосферадағы қоры 1,5
• 1015 т , оның 1 • 1010 тоннасы жану үшін жұмсалады . Тыныс алу жеке ағзаның Өмірі үшін , ал шіру - эволюция ( даму ) үшін маңызды үдерістерСлайд 10Оттегінің аллотропиялық түр өзгерістері
Озон Оттегі табиғатта екі түрлі жай
зат күйінде кездеседі , оның бірі 02 , екіншісі ОЗ
, ол озон деп аталады . Енді озонмен жете таныссақ , озон найзағай ойнағанда ауада пайда болады . Сонда электр заря- дының Әсерінен мына реакция жүреді : 302 - 20ЗБір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады . Озонның формуласы ОЗ , салыстырмалы молекулалық массасы 48 , оттегінен 1,5 есе ауыр ( 48 : 32 = 1,5 ) , суда аз еритін , -112 ° С - да қайнайтын , -193 ° C - да балқитын газ күйінде қою - көк түсті , ал қатты күйінде көктен қара - күлгін түске дейін бояладыСлайд 12Күкірт
Күкірт Күкірт ( ағылш . Sulfur ) , S- элементтердің
периодтық жүйесінің VI тобындағы химиялық элемент ; ат . Н.
16 , ат . М. 32,06 . Тұрақты 4 изотопы бар . Сондай - ақ жасанды жолмен алынған 6 ИЗОТОПы белгілі . Күкірттің жер қыртысындағы салмақ мөлшері 0,05 % , теңіз суында 0,08 - 0,09 % . Күкірт біздің заманымыздан 2000 жыл бұрын белгілі болған . Қалыпты жағдайда күкірт сары түсті , бейметалл . Табиғатта бос күйінде ( саф К. ) және сульфидті ( мысалы , пирит , галенит , анТИМОНИТ , т.б. ) , сульфатты ( гипс , ангидрит , барит , Мирабилит , т.б. ) , т.б. Минералдар түрінде кездеседіСлайд 13Периодтық жүйедегі орны Күкірттің жануы Күкірт ||| периодтың , VI
топтың негізгі Топшасының элементі , реттік НӨмірі 16. Олай болса
ядро заряды +16 , протон саны 16 , нейтроны да 16 ; электрондарының жалпы саны 16 . Электрондық құрылысы . Осы электрондар үш электрондық қабаттарда бөлініп орналасады , күкірттің электрондық формуласы : 1s22s22p63s23p4 Күкірт II , IV , VI - валентті бола алады , ал тотығу дәрежелері -2,0 , +4 , +6 болып келеді .Физикалық қасиеттері Күкірт - сары түсті , суда нашар еритін , су жұқтырмайтын , жылу мен тоқ өткізбейтін , морт СЫҢҒЫШ келетін қатты зат . Балку температурасы 119 ° С . Күкірт атомының сыртқы валенттілік кабатында екі дара электроны болғандықтан , олар өзара байланыса алады .
Слайд 14Химиялық қасиеттері
Күкірт химиялық реакцияларда тотықтырғыш та,тотықсыздандырғыш та бола алады.Ол металдармен
де, бейметалдармен де жақсы әрекеттеседі. Металдармен жоғары температурда әрекеттесіп, сульфидтер
түзеді.Күкірт жай заттармен әрекеттеседі
Күкірт жоғары температурада сутекпен әрекеттеседі
Жоғары температурада күкірт фтормен және оттекпен әрекеттеседі(жанады)
2Al+3S=Al2S3; Zn+S=ZnS; S+H2=H2S
Слайд 15Табиғатта таралуы
Күкірттің табиғи қосылыстары Балқаш , Шығыс Қазақстан облысында
сульфидтер ( ZnS , PbS , FeS2 , т.б. )
күйінде болса , сульфаттары ( CaSO4 + 2H20 - ғаныш ( гипс ) , Na2SO4 • 10H20 - мирабилит , FeSO4 • 7H20 - темір купоросы ) т . б . болады . Күкірт қосылыстары мұнайда және тас көмірде де кездеседі . Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады . Вулкан атқылағанда газбен ілесе ұшқан күкірт сыртқа шығып кристалл түрінде қатаяды . Ондай күкіртті вулканмен байланысты арасан көздерден ( фумаролдардан ) , тау жыныстарының жарықтарынан , қуыстарынан кездестіруге болады . Сульфид минералдардың тотығуынан пайда болатын күкірт кендері көбінесе сульфид кендерінің үстіңгі қабатында болады . Бұл жағдайда пайда болатын күкірттің реакциясын мынадай түрде көрсетейік . RS + Fe2 ( SO4 ) 3 = 2FeSO4 + RSO4 + SСлайд 16Қолданылуы
Күкірт каучукты резинаға айналдыру ( вулканизация ) үшін , медицинада
, тұрмыста жертөлені және қоймаларды аластау үшін , оқ Дәрі
ЖӨНе сіріңке өндірістерінде қолданылады . Кен орны КСРО - да шөгінді күкірт кенінің ең көп жері Орта Азияда ( Қарақұм , Гаурдақ , Шорсу ) , Поволжьеде ( Куйбышев қаласы маңында ) . Вулкандық күкірт кендері Кавказда , Камчаткада және Курил аралдарында кездеседі . Шет мемлекеттердегі күкірт кені Италияда , Сицилияда бар . Техас және Луизиана штаттарындағы ( АҚШ ) күкірт кендері тау ЖЫНЫСтарының жарығында кездеседі . Вулкандық күкірт кендері Италияда , Жанонияда , Чилиде » т . б . жерлерде бар . Нәруыздардың , Витаминдердің гормондардың құрамында боладыСлайд 17Пайдаланған әдебиеттер
•1. Б.А.Бірімжанов , Н.Н.Нұрахметов . Жалпы ХИМИЯ . Алматы
. Ана тілі , 1992 .
•2. К.А.Аханбаев . Химия негіздері
. Алматы . Мектеп , 1987 .•3. К.А.Аханбаев . Жалпы және анорганикалық Химия . Алматы . Санат , 1999 .
•4. Г.П.Хомченко . Химия ( Жоғары оқу орындарына түсушілерге арналған) Алматы.Рауан 1990