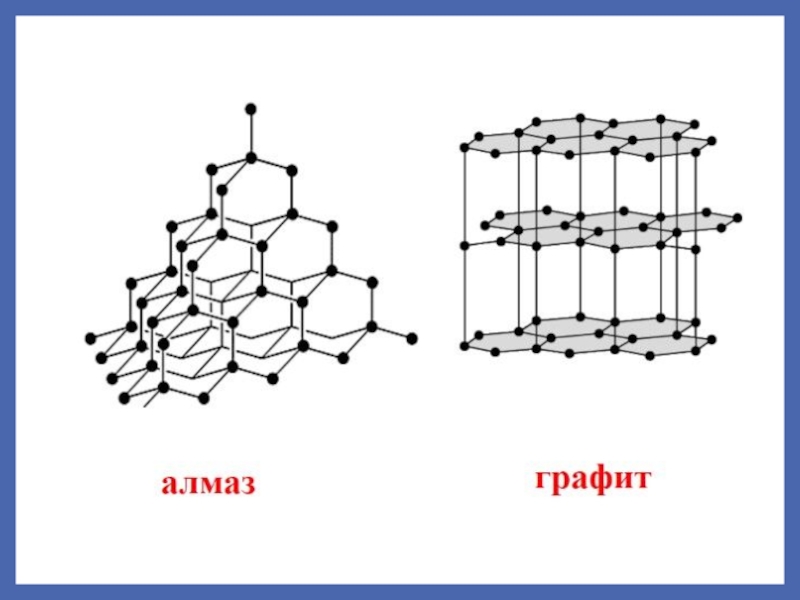
связывания – образование более сложных структур.
Виды химической связи:
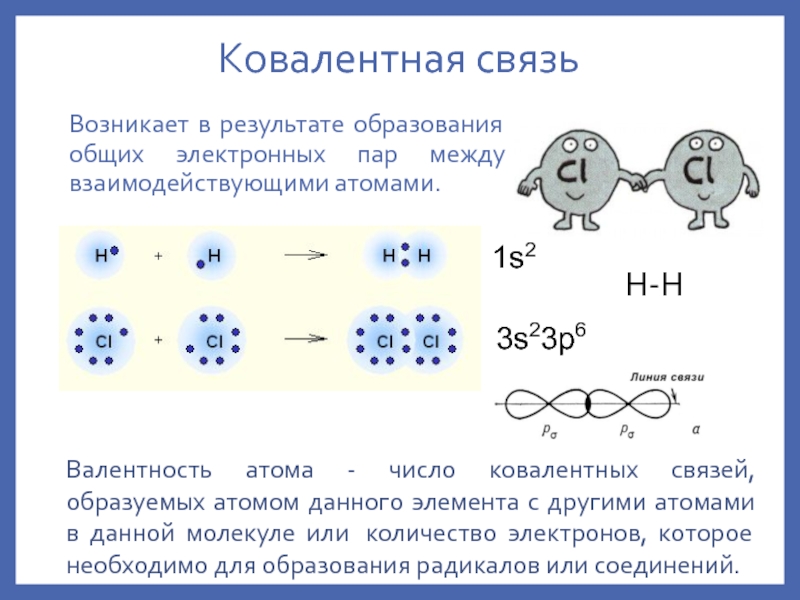
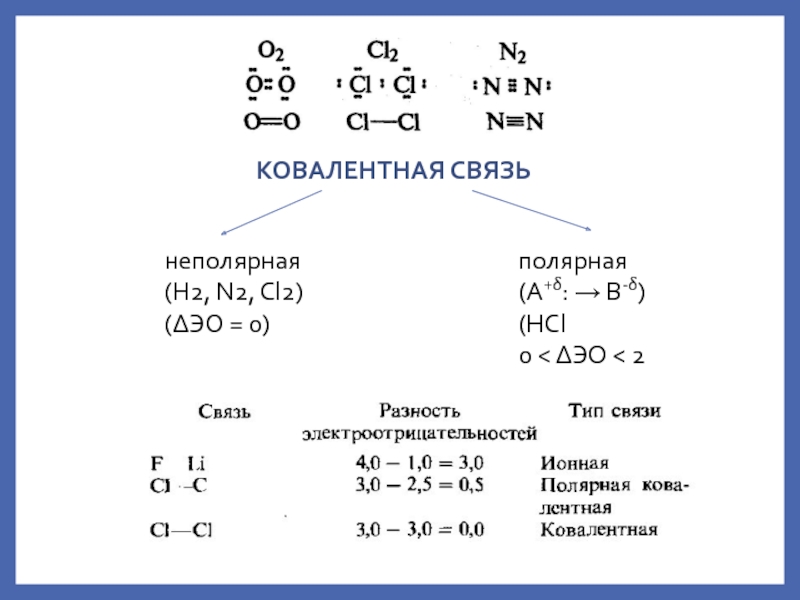
ковалентная – причина
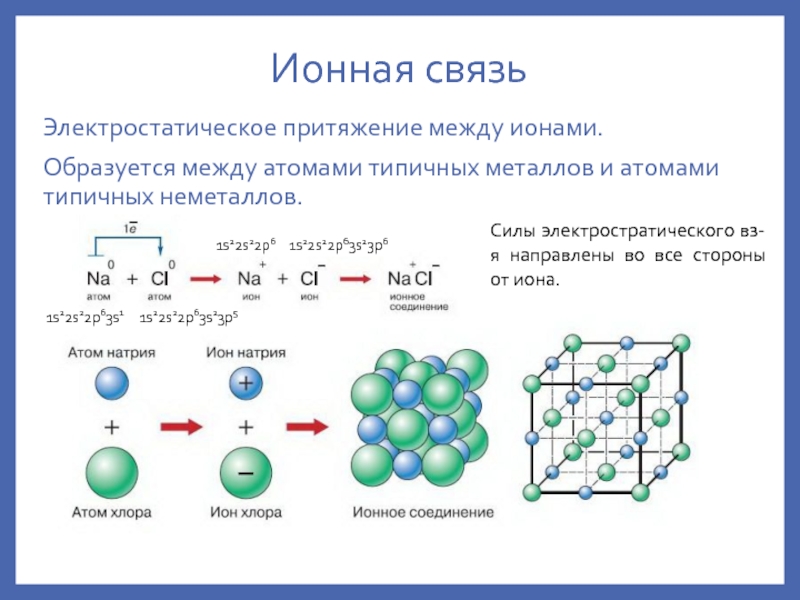
обр-я мол-л, мол. ионов свободных Rad и атомных крист-х решеток;ионная – обр-е мол-л ионных соед-й и ионных крист-х решеток;
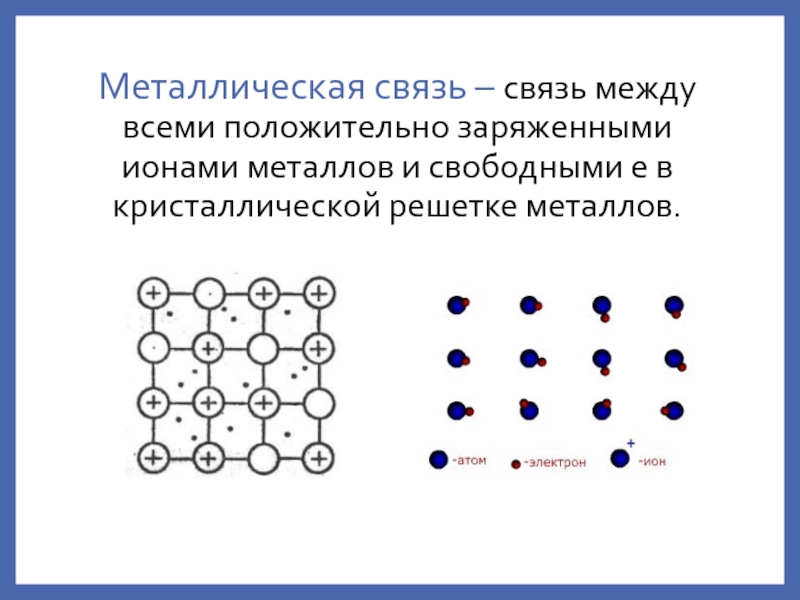
металлическая – вз-е между атомами в металлах;
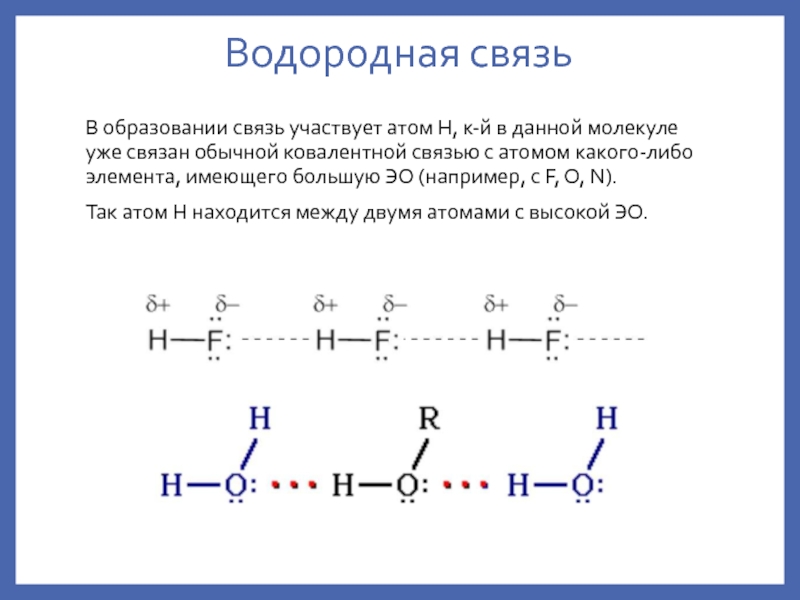
водородная – внутри и между мол-ми.
ВЕЩЕСТВА
свободные атомы
(благородные газы)
связанные атомы