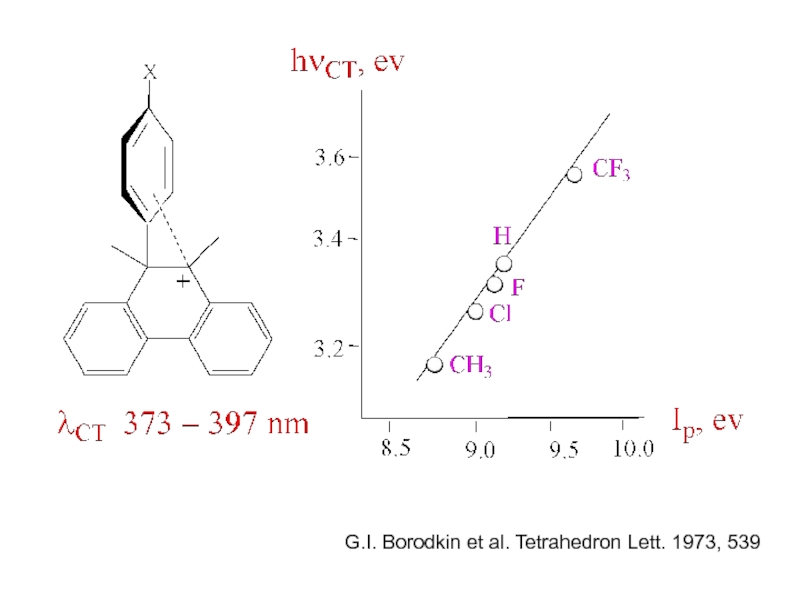
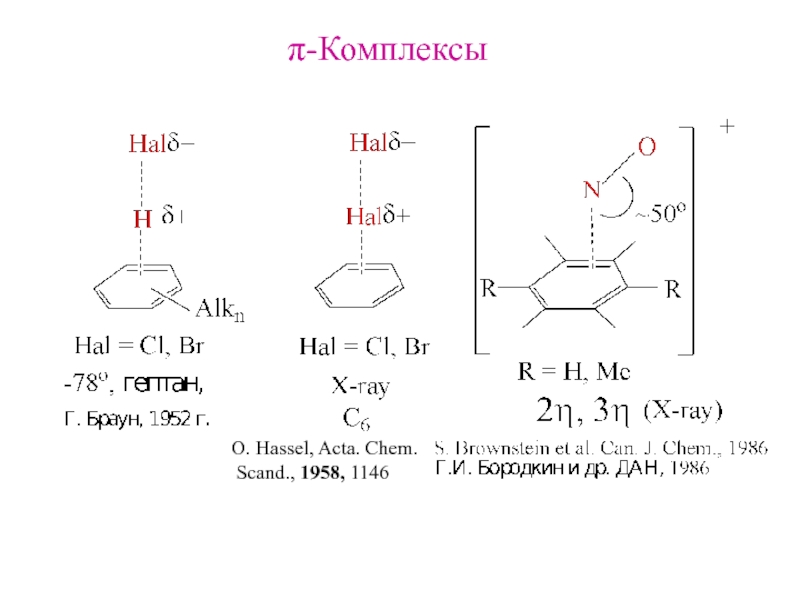
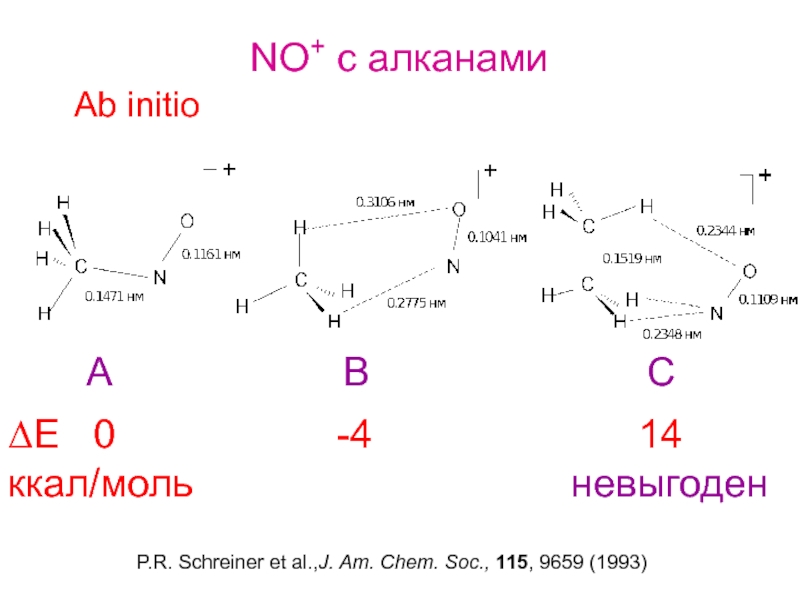
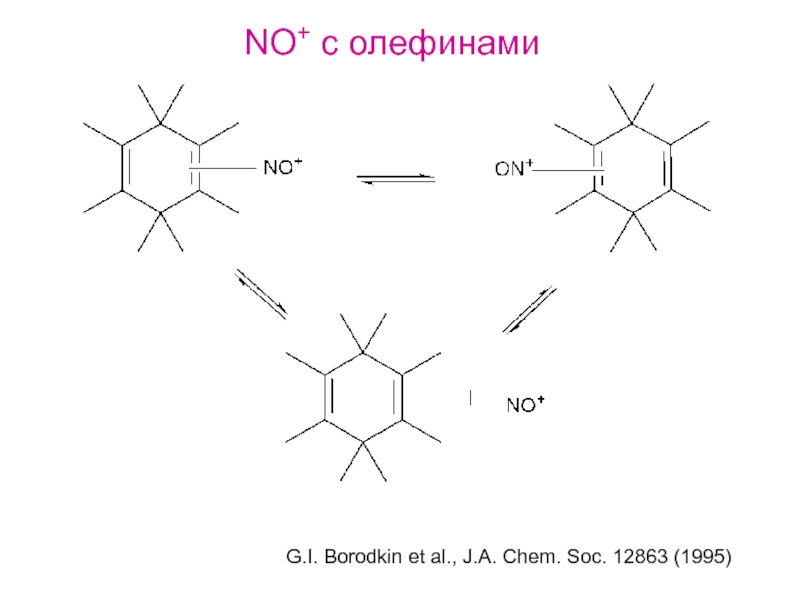
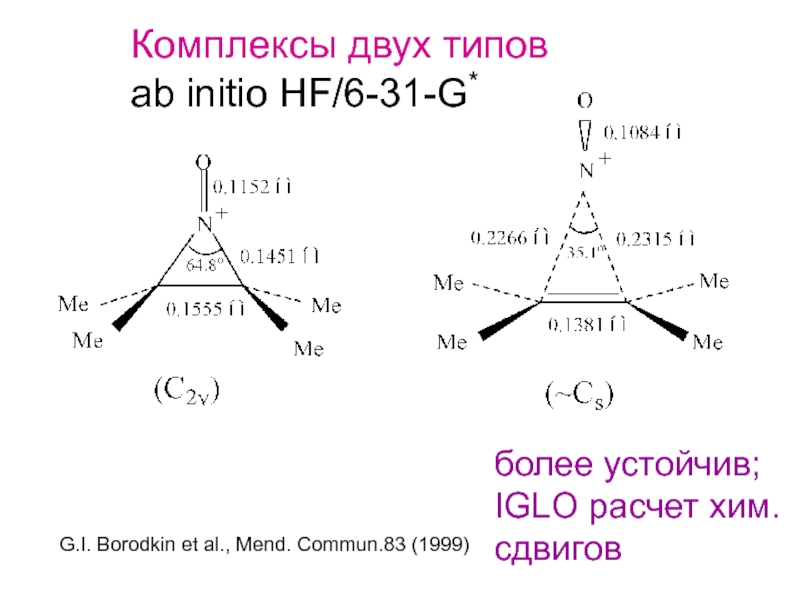
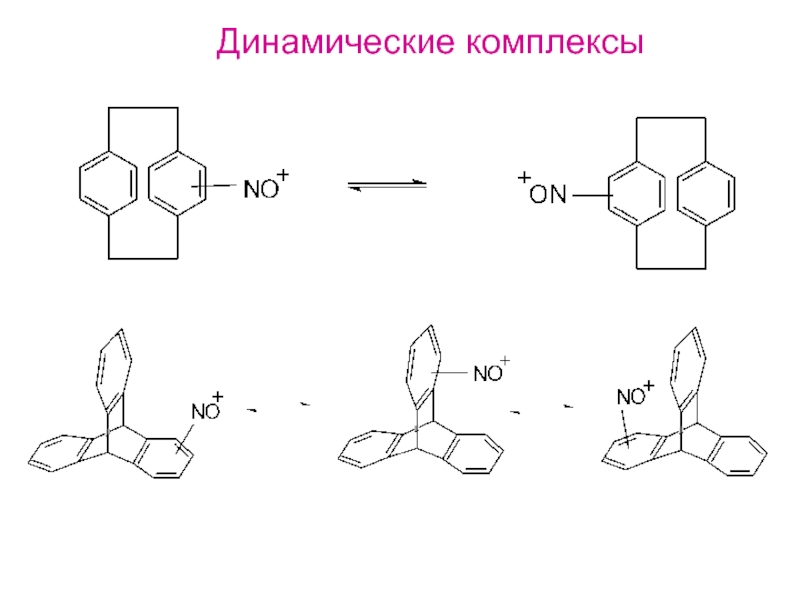
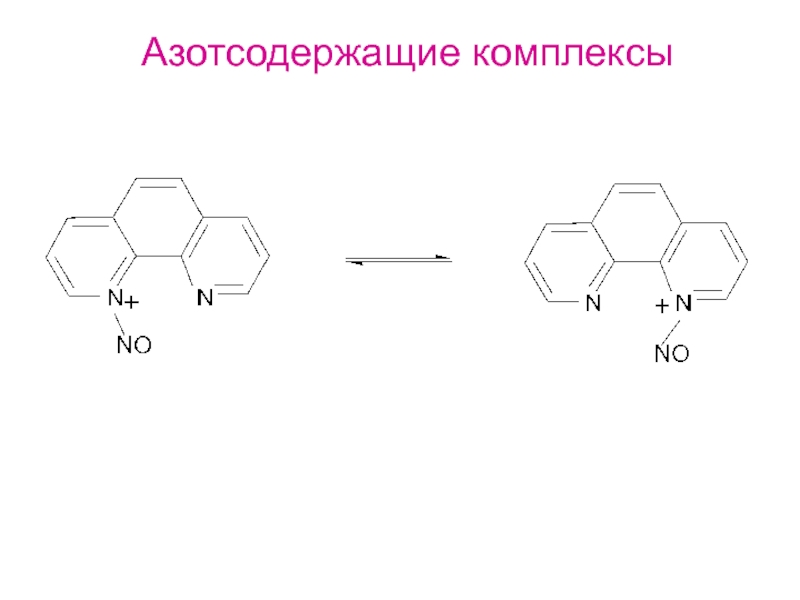
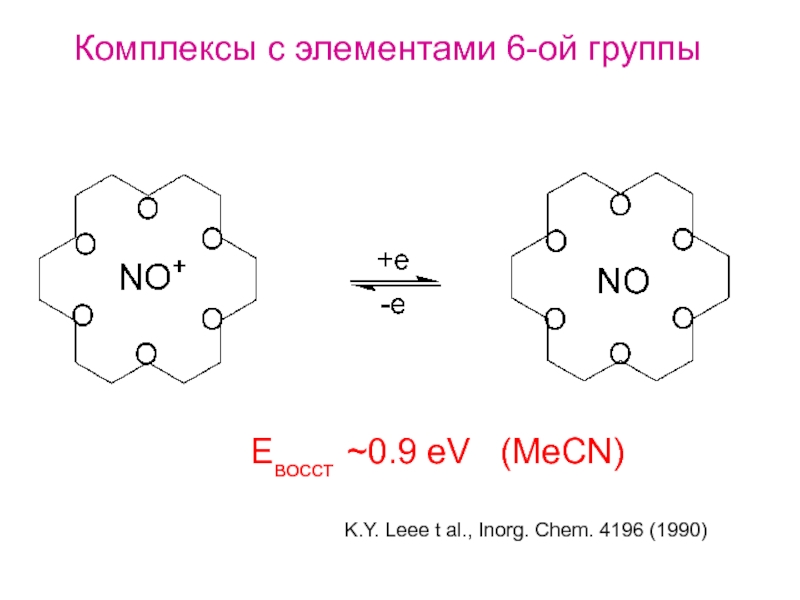
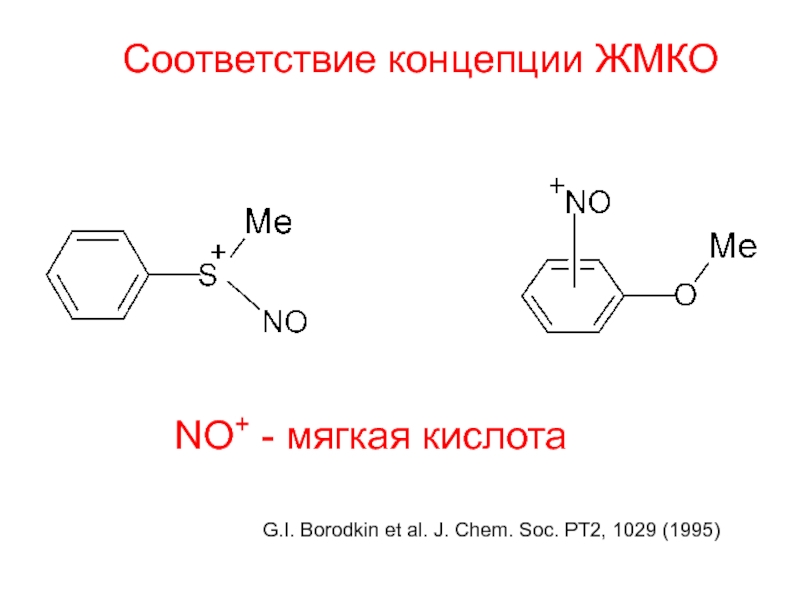
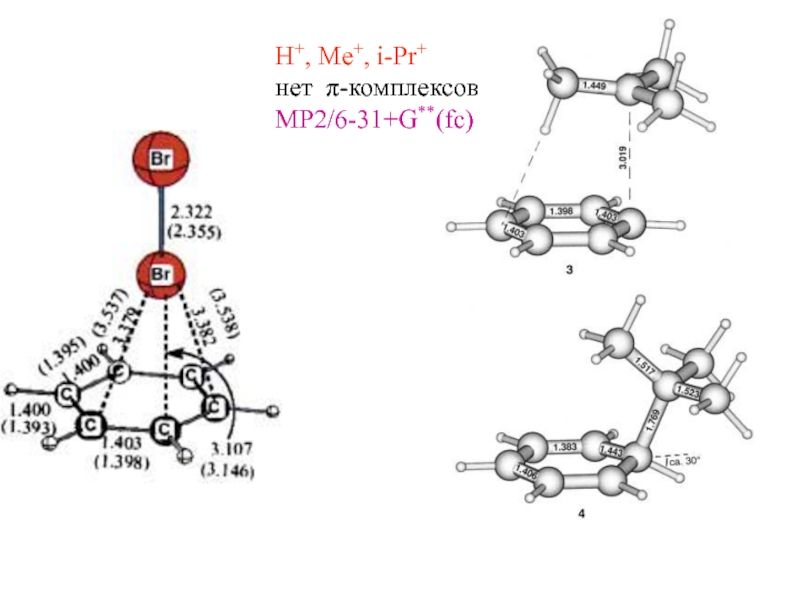
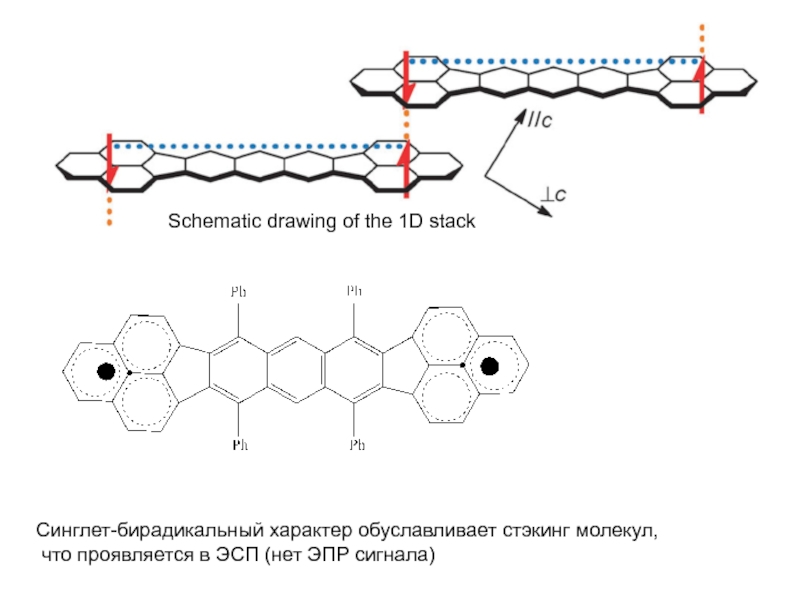
и
биохимических процессах
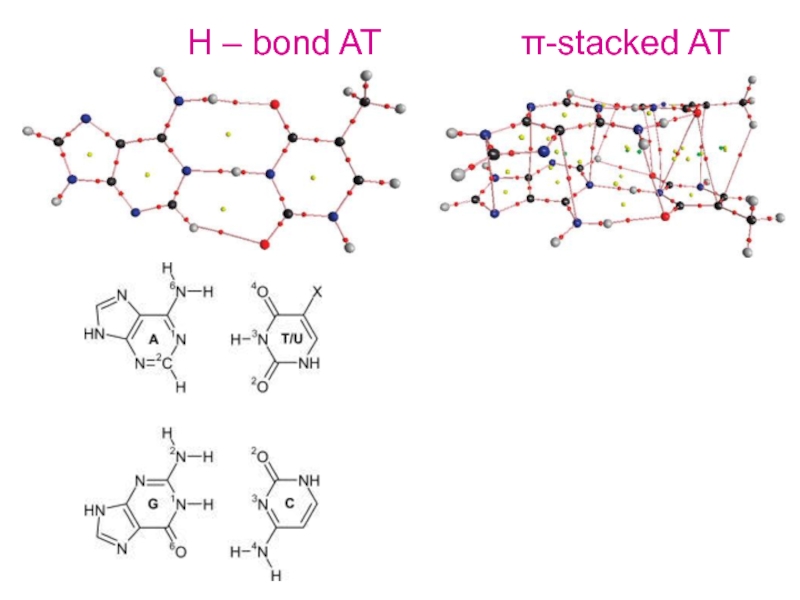
Молекулы
жизни
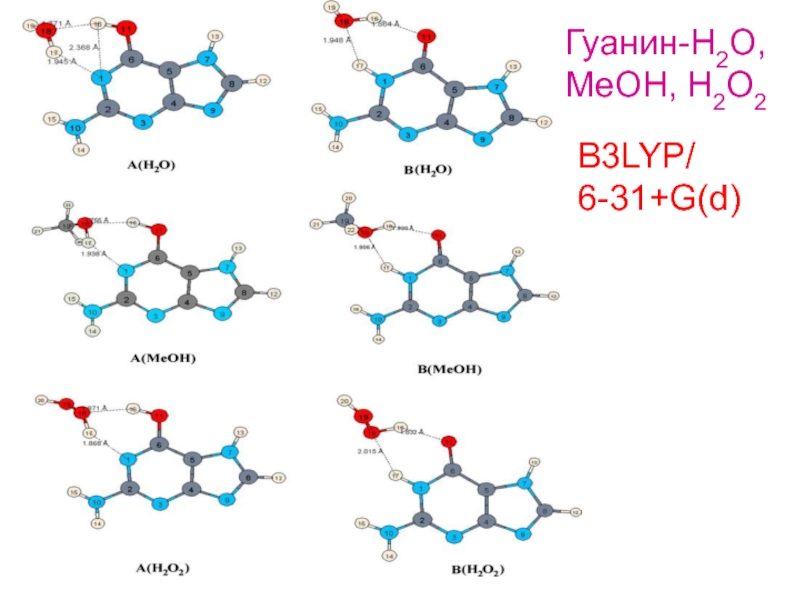
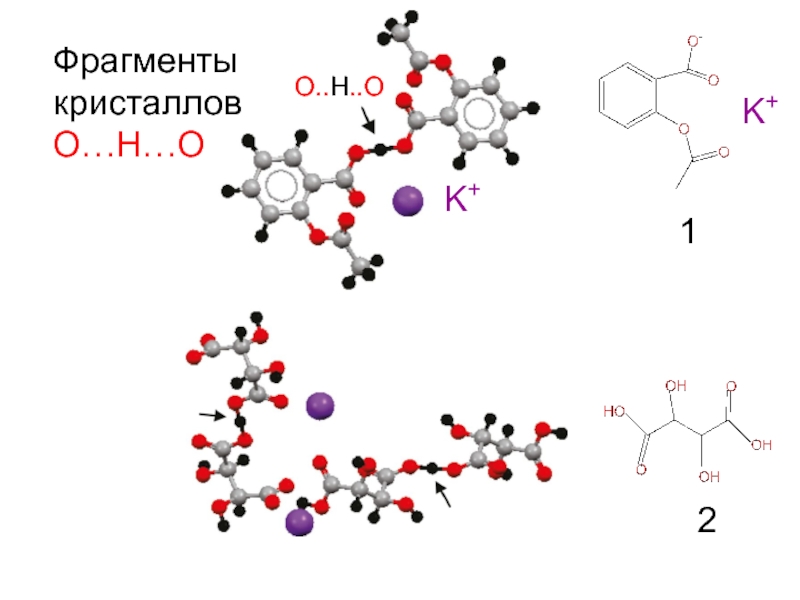
Молекулы в
кристаллах
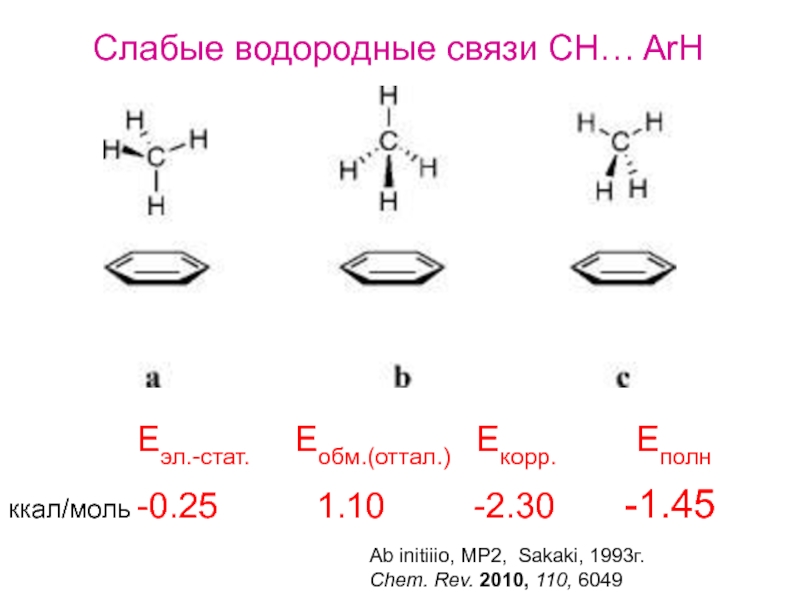
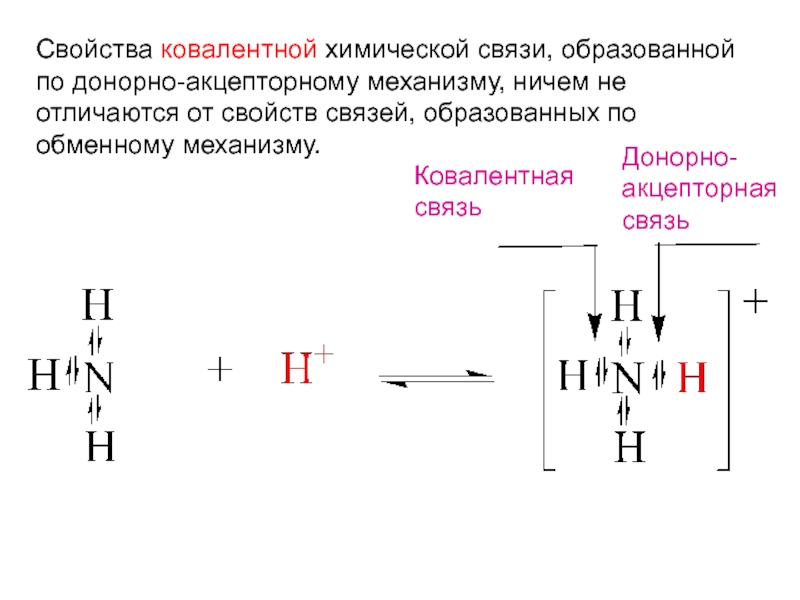
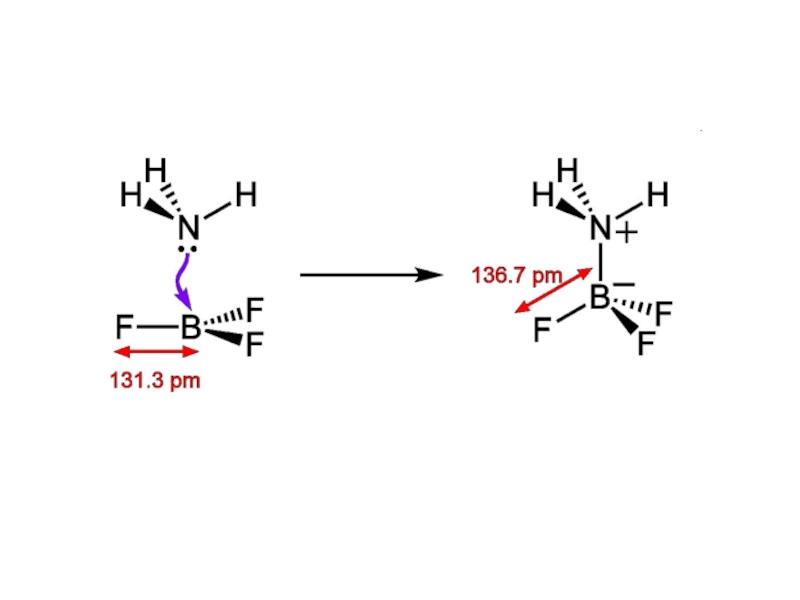
Перенос
протона
Ферментатив-
ный катализ
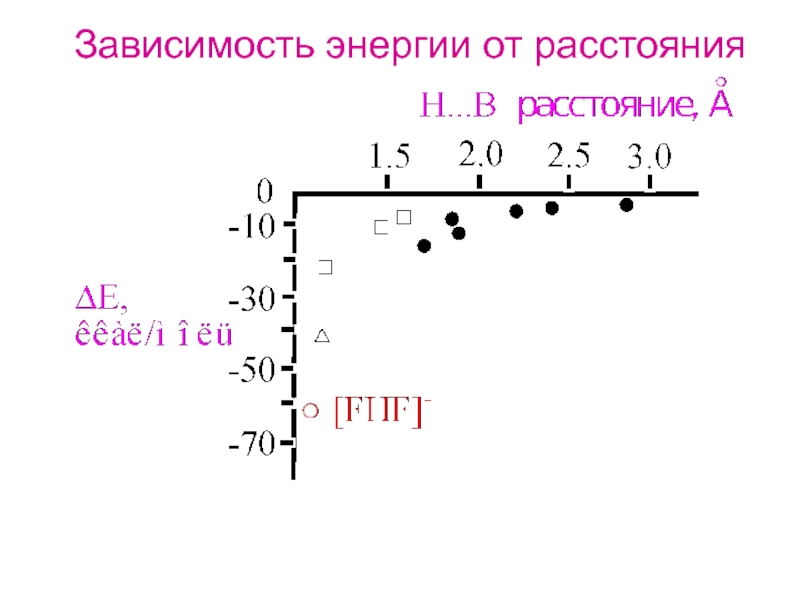
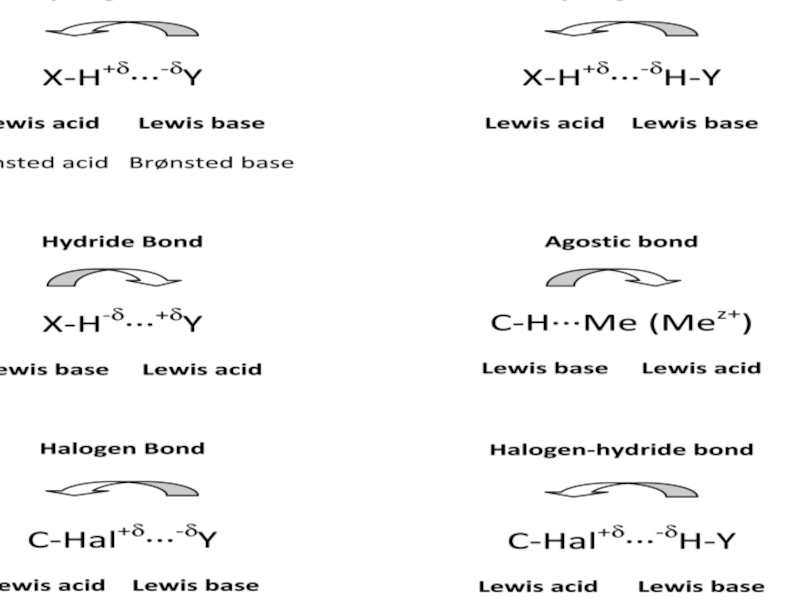
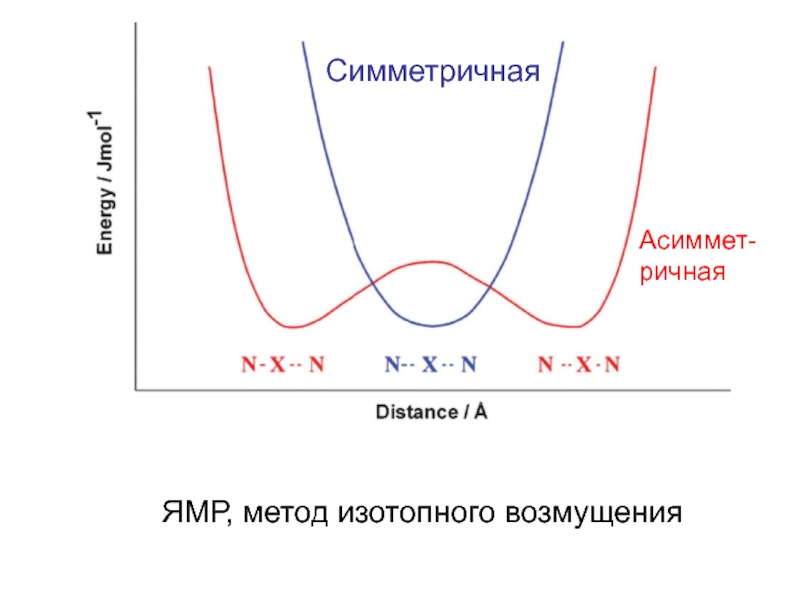
При определенных условиях атом водорода может
быть
связан сильной связью с двумя соседнимиатомами, а не с одним.
Л. Полинг:



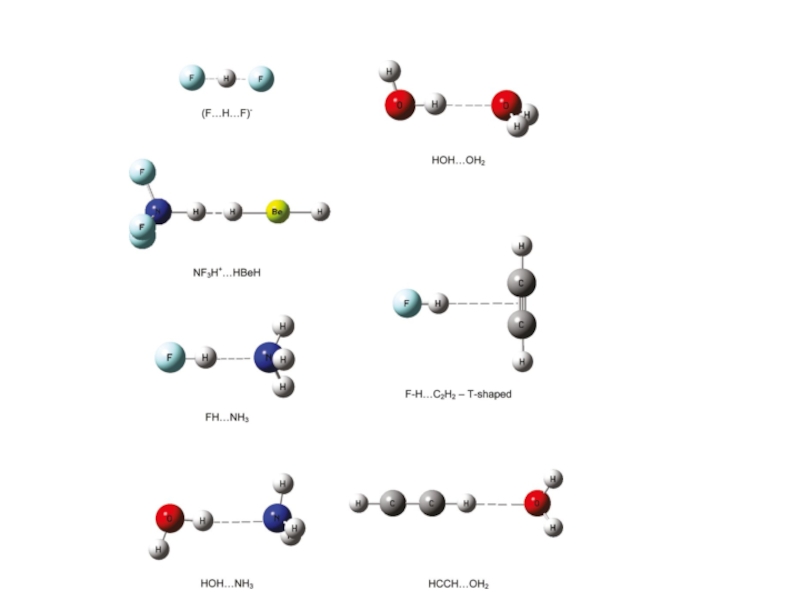

![Водородная и донорно-акцепторная связи CCSD(T)/6-311(3df,3pd)//CCSD/6-311(3df,3pd)Симметричные Н-связи[H….F….H]-H….O….HНейтронная дифракция (кристалл)Атом водорода посредине или близкок центру связиGrabowski, S. CCSD(T)/6-311(3df,3pd)//CCSD/6-311(3df,3pd)Симметричные Н-связи[H….F….H]-H….O….HНейтронная дифракция (кристалл)Атом водорода посредине или близкок центру связиGrabowski, S. J.; Ugalde, J. M. Chem. Phys.](/img/thumbs/af7f5fbed496283c02165683625cd69e-800x.jpg)