Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второе начало термодинамики. Энтропия
Содержание
- 1. Второе начало термодинамики. Энтропия
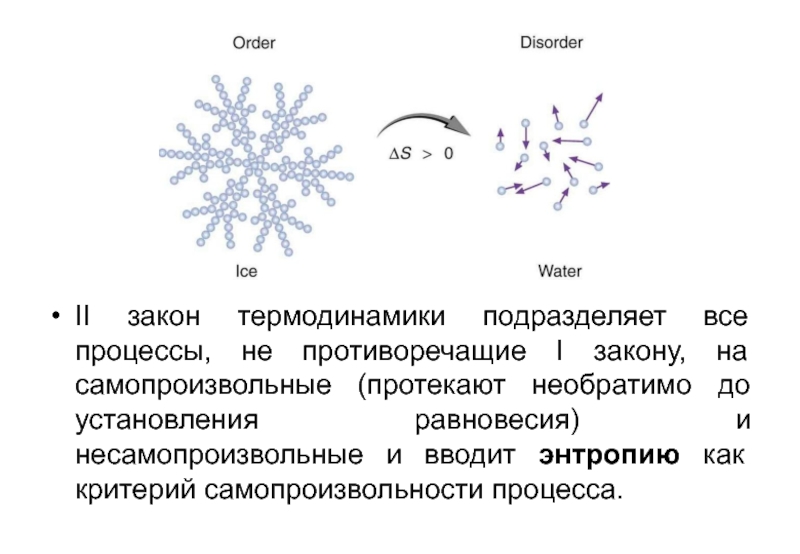
- 2. II закон термодинамики подразделяет все процессы, не
- 3. Вечный двигатель 2-го рода не существует.Энергия Вселенной
- 4. Существует экстенсивная функция состояния системы – энтропия
- 5. Слайд 5
- 6. Слайд 6
- 7. Статистический характер II закона термодинамикиНе абсолютный закон
- 8. Вероятностный характер II закона термодинамики.В необратимом самопроизвольном
- 9. S = KlnW W – термодинамическая вероятность
- 10. Слайд 10
- 11. Расчет изменения энтропии в различных процессах
- 12. Слайд 12
- 13. Слайд 13
- 14. Постулат Планка (третий закон термодинамики)Абсолютная энтропия
- 15. Слайд 15
- 16. б) при наличии фазовых превращений вещества на интервале от 0 до Т, К
- 17. Следствия из постулата Планка
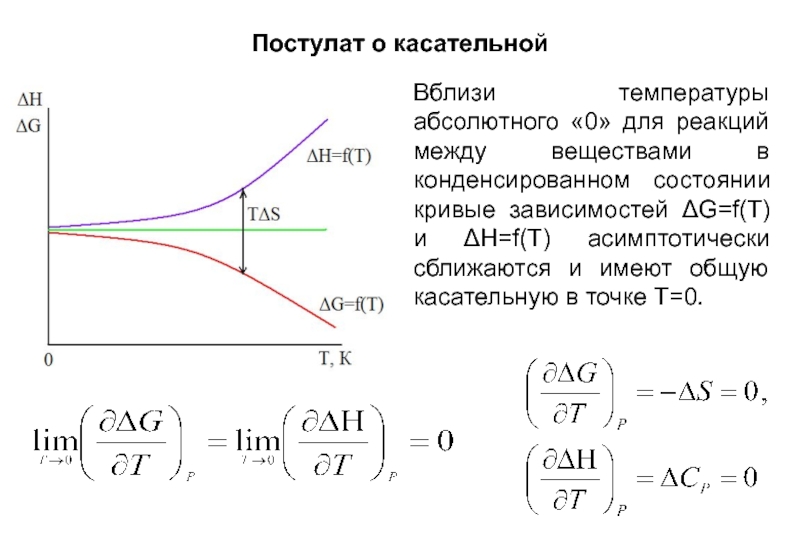
- 18. Постулат о касательной
- 19. Скачать презентанцию
II закон термодинамики подразделяет все процессы, не противоречащие I закону, на самопроизвольные (протекают необратимо до установления равновесия) и несамопроизвольные и вводит энтропию как критерий самопроизвольности процесса.
Слайды и текст этой презентации
Слайд 3Вечный двигатель 2-го рода не существует.
Энергия Вселенной постоянна, а её
энтропия возрастает.
Теплота наиболее холодного из участвующих в процессе тел не
может служить источником работы (постулат Томсона).Теплота сама собой не может переходить от холодного тела к горячему (постулат Клаузиуса).
Энтропия изолированной системы не может уменьшаться (Больцман)
Слайд 4Существует экстенсивная функция состояния системы – энтропия S, которая возрастает
в необратимых процессах и остается неизменной в обратимых.
Знак равенства имеет
место в обратимых, а неравенства – в необратимых процессах. Слайд 7Статистический характер II закона термодинамики
Не абсолютный закон природы, применим только
к макроскопическим системам.
Энтропия – мера беспорядка. Для ТДС с малым
числом частиц понятие «беспорядок» не имеет смысла.Для ТДС с малым числом частиц теряют смысл Р и Т, исчезает различие между теплотой и работой.
Слайд 8Вероятностный характер II закона термодинамики.
В необратимом самопроизвольном процессе система переходит
от порядка к беспорядку, из менее вероятного состояния в более
вероятное, что сопровождается ростом энтропии ТДС.Рост энтропии = рост беспорядка!
Энтропия характеризует вероятность реализации данного состояния системы.
S = KlnW - формула Больцмана
Слайд 9S = KlnW
W – термодинамическая вероятность (число способов, которыми
можно осуществить данное состояние системы) ;
K = R/NA –
постоянная Больцмана.W = W1• W2 • W3 • … • Wi - мультипликативная и безразмерная (W ≥ 1)
S = Σ KlnWi = Σ Si - величина аддитивная,
Дж/(моль • К)