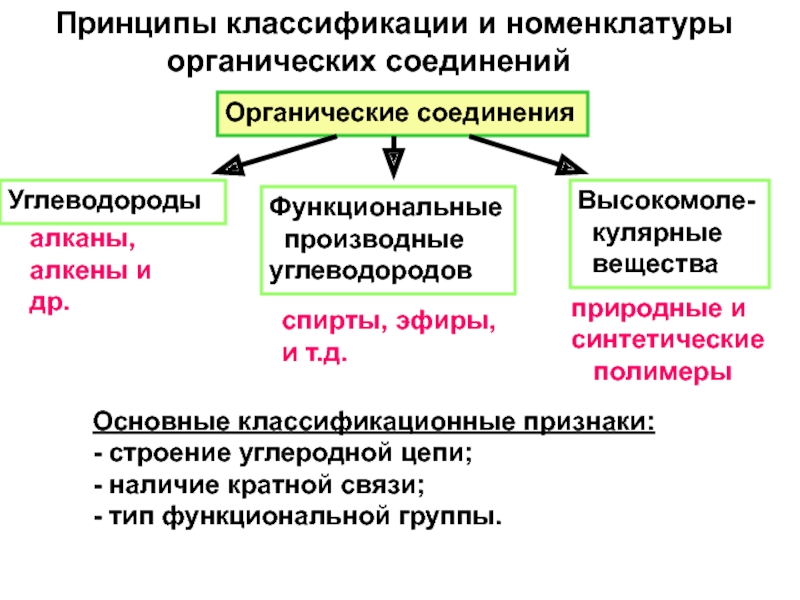
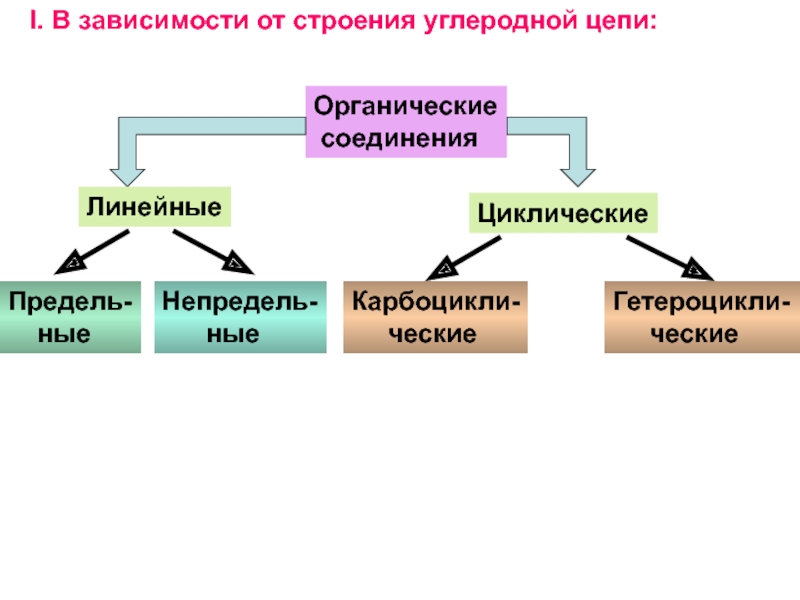
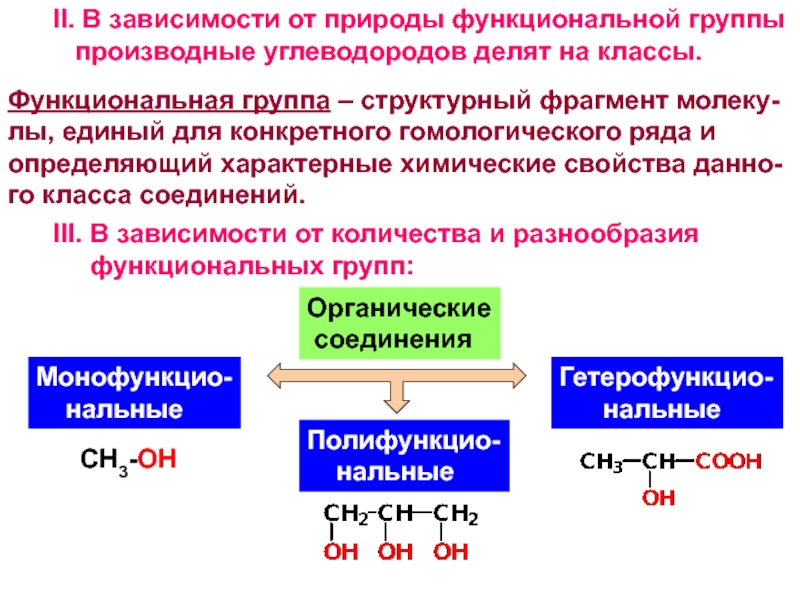
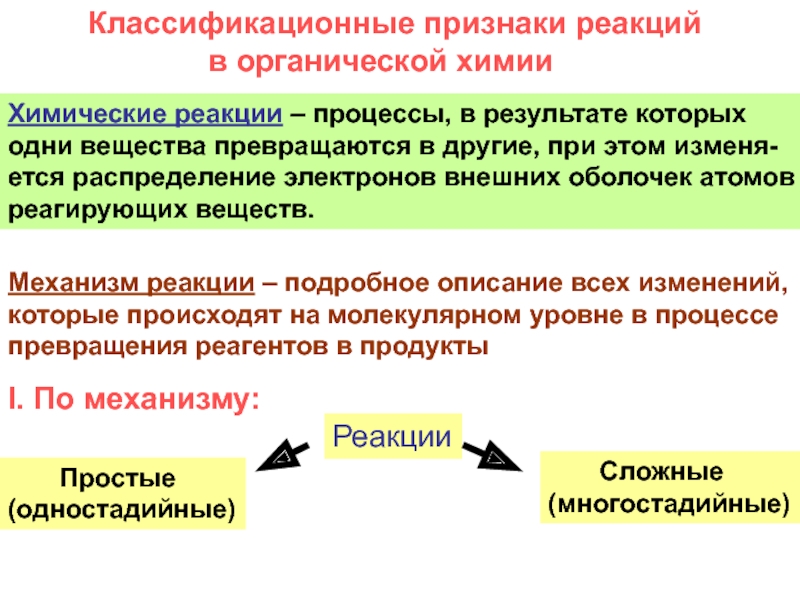
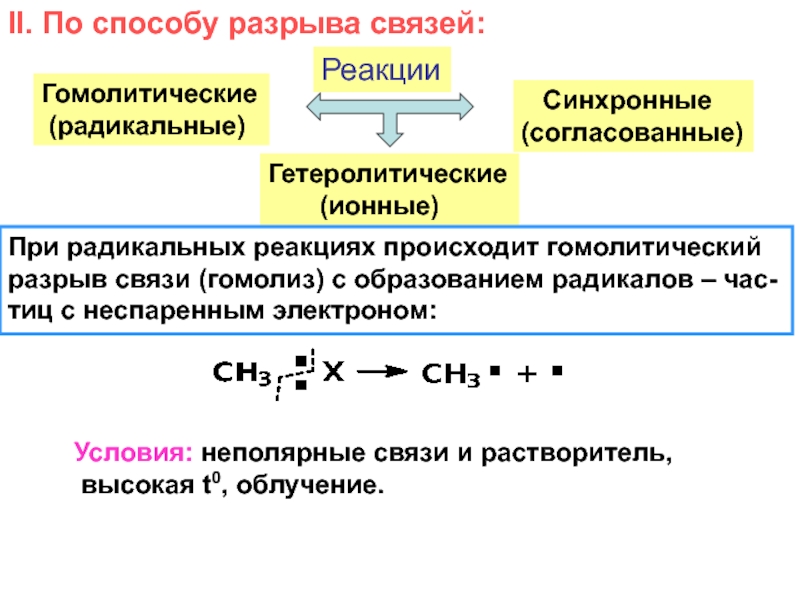
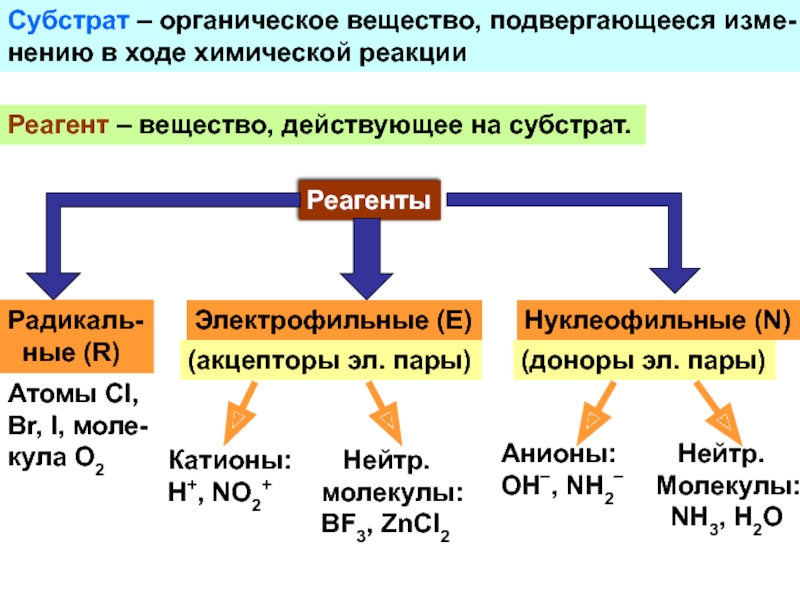
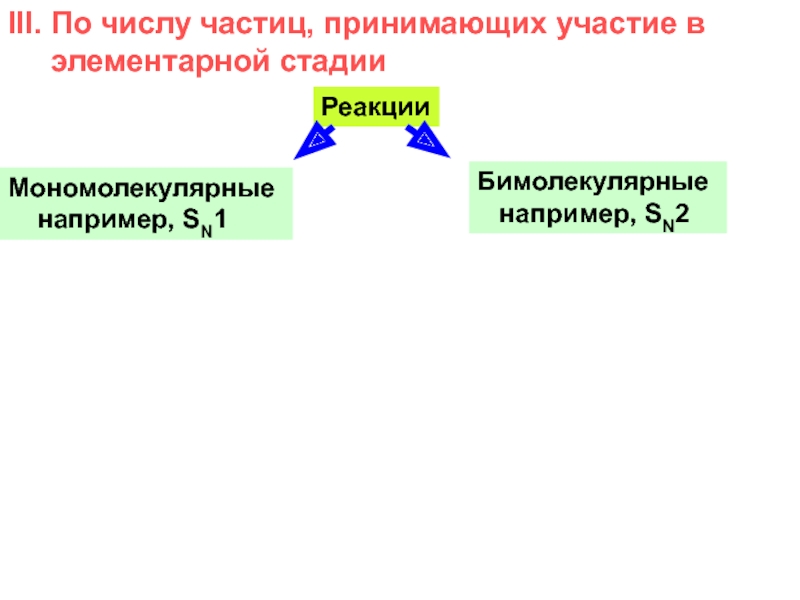
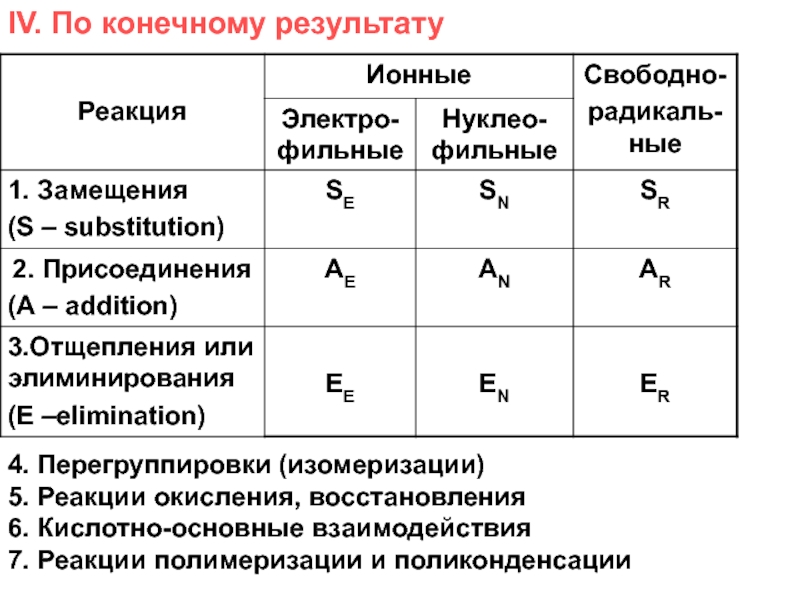
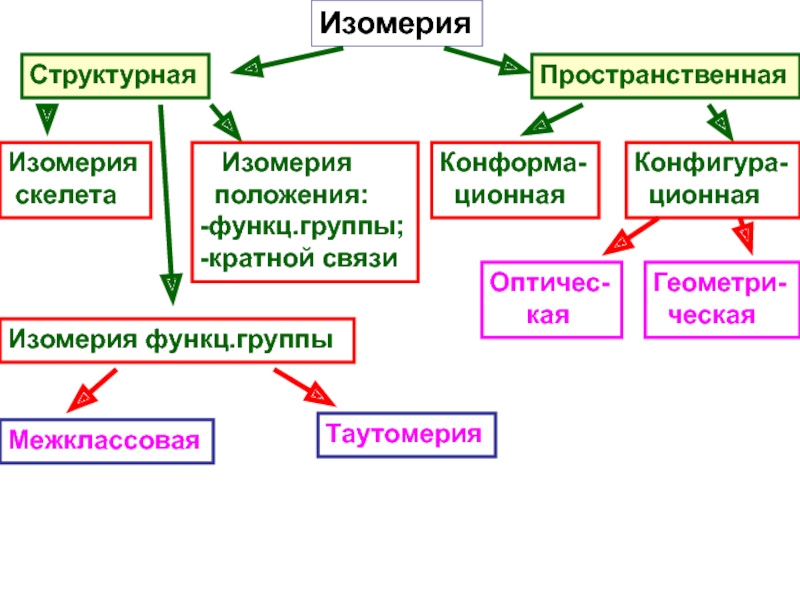
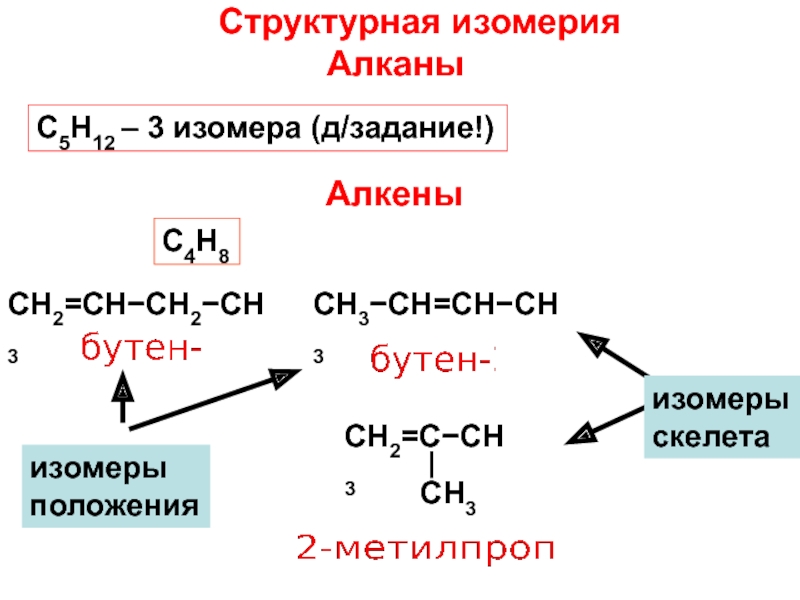
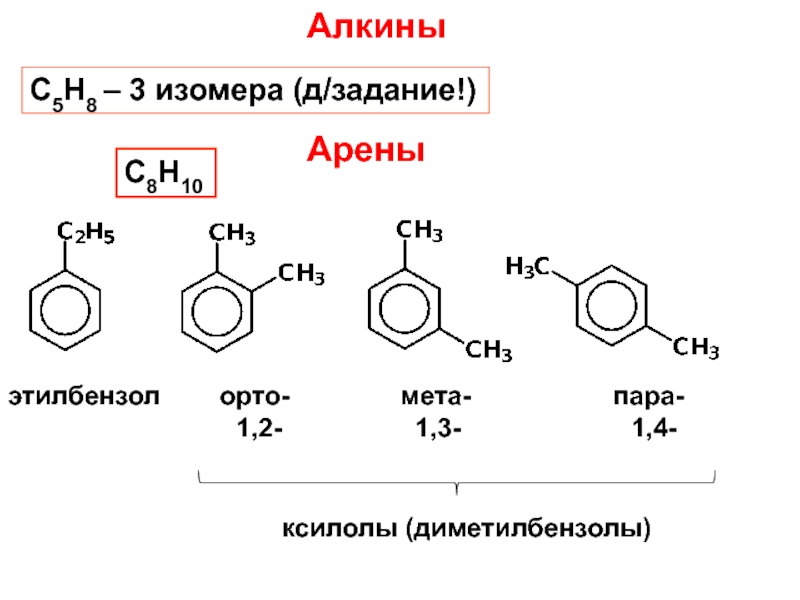
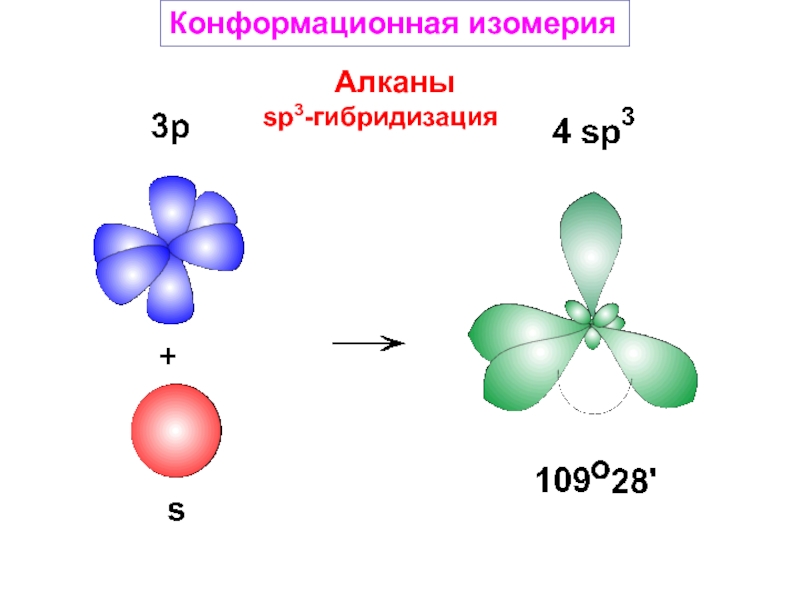
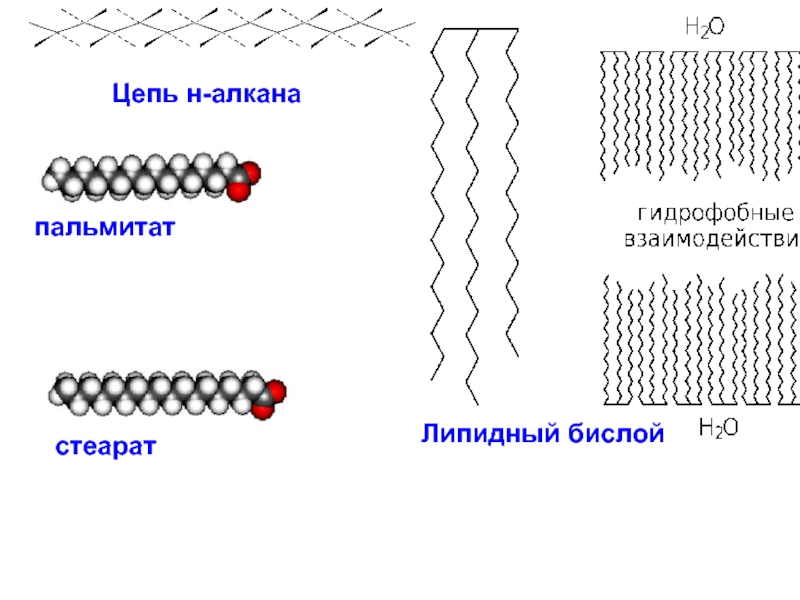
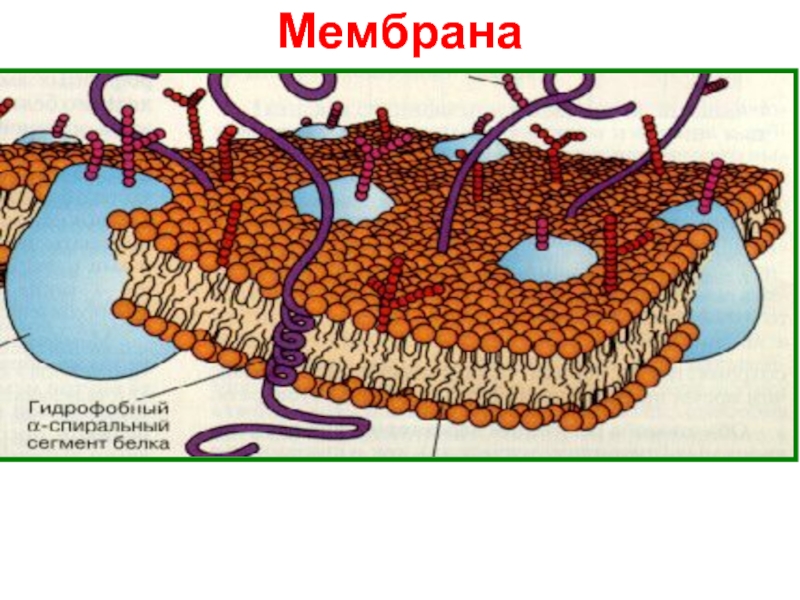
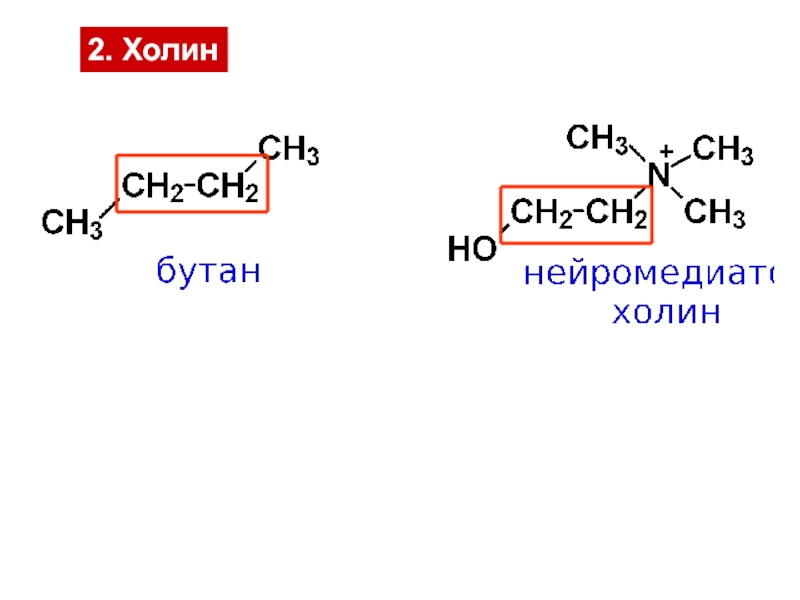
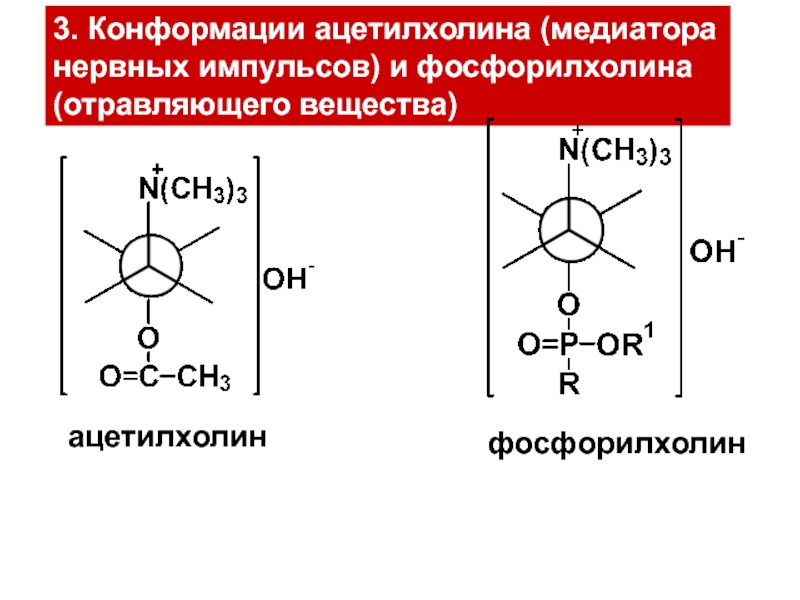
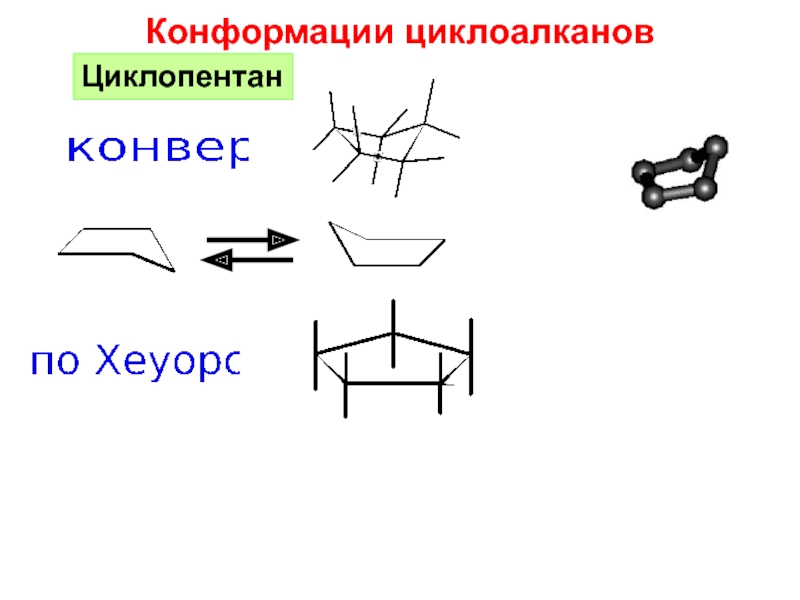
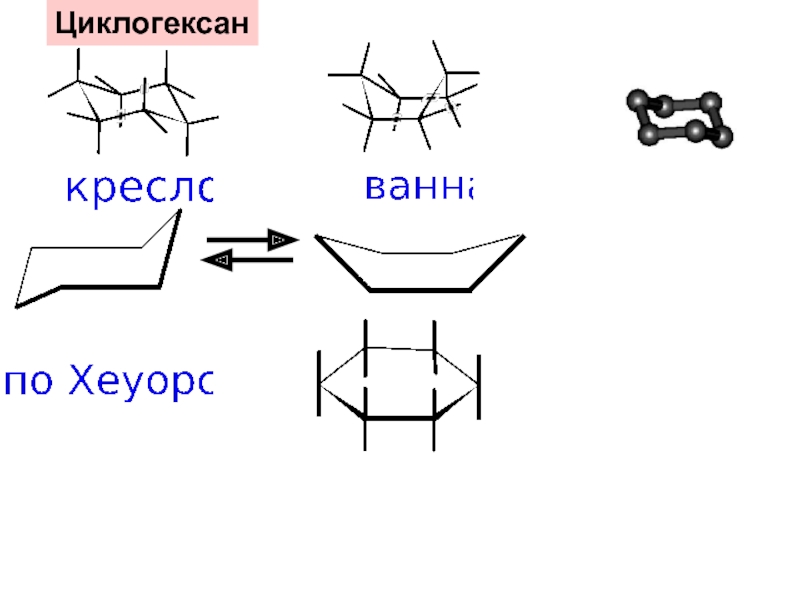
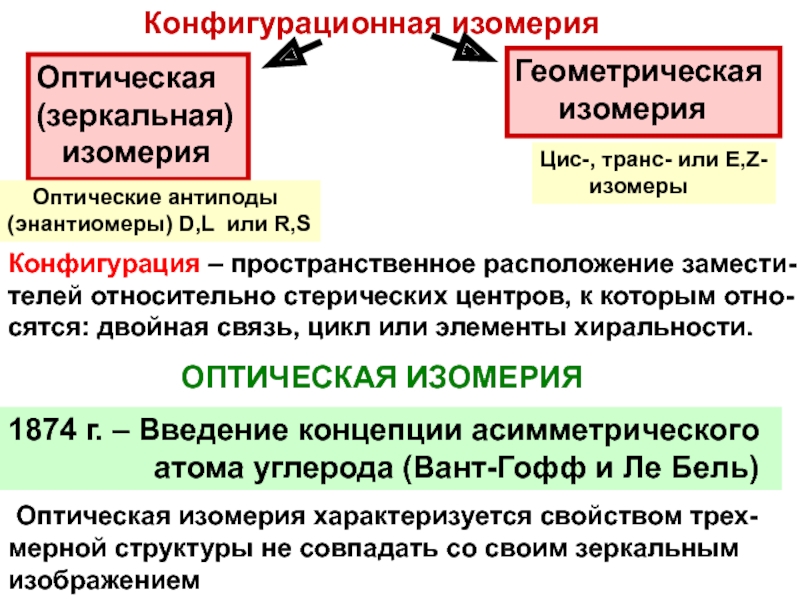
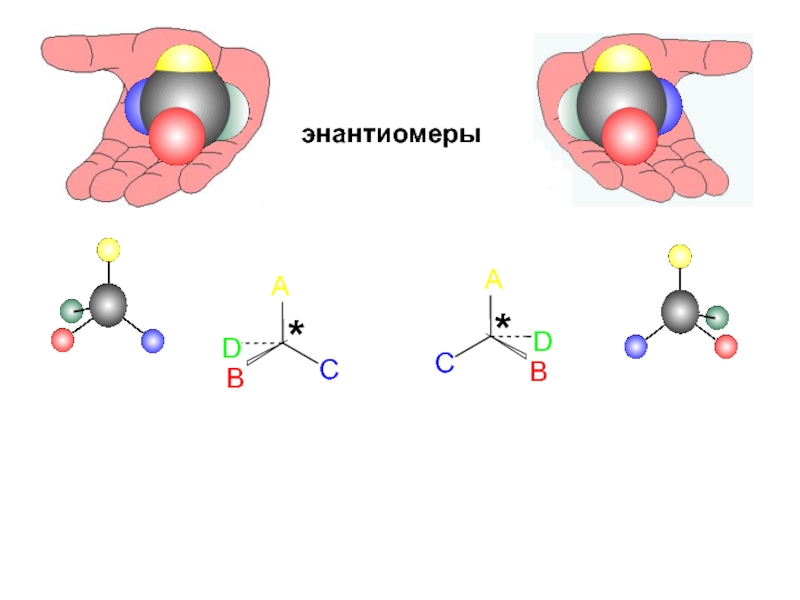
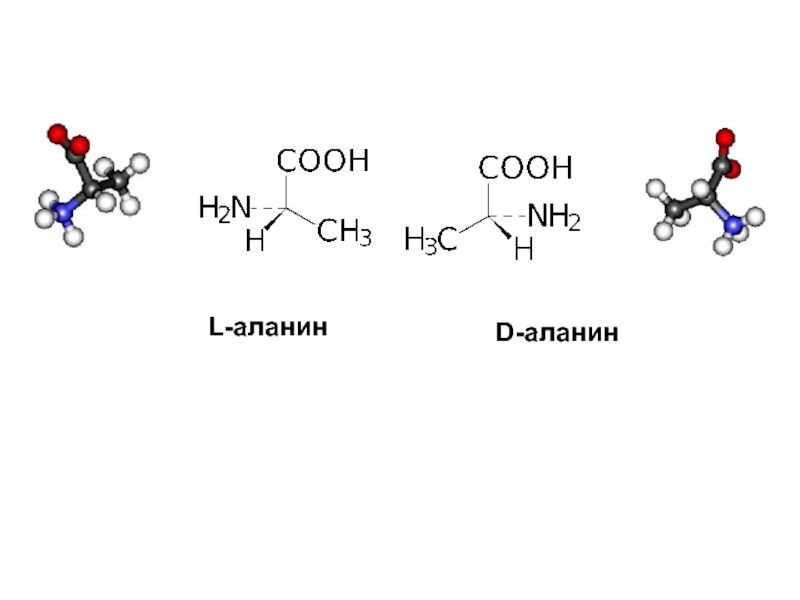
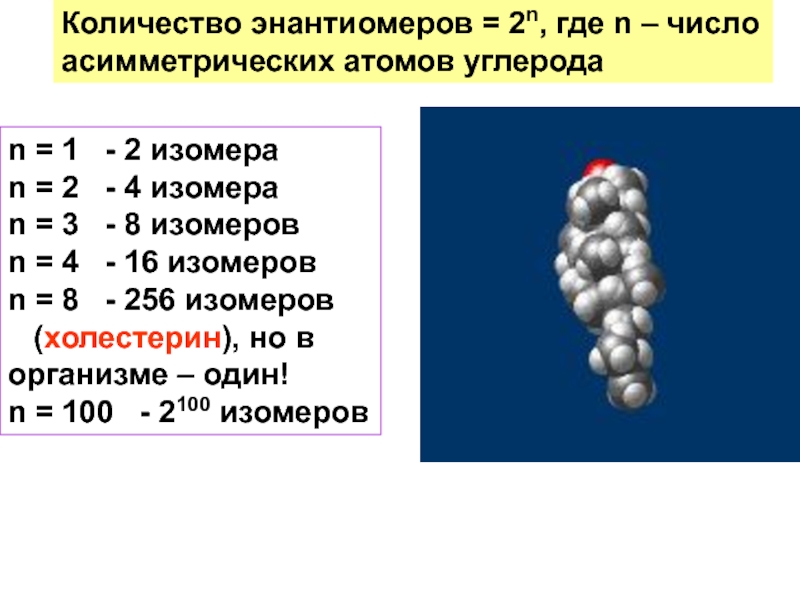
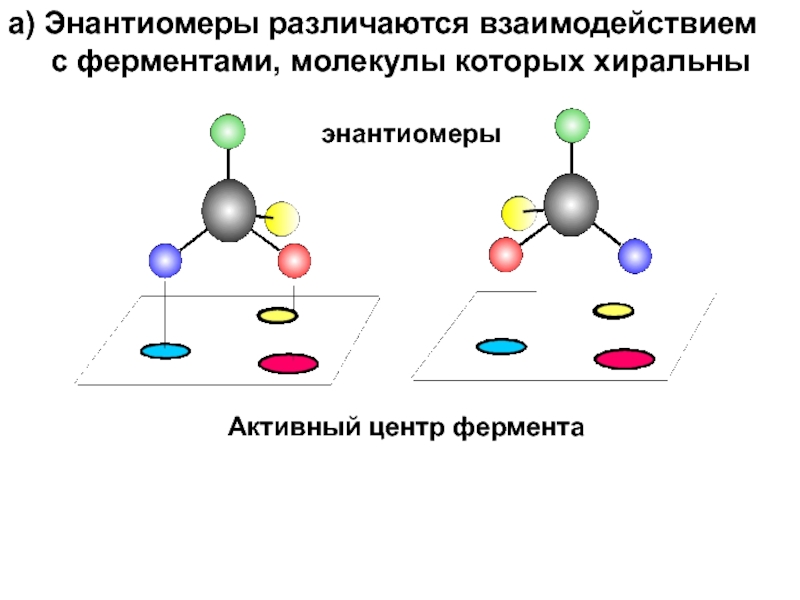
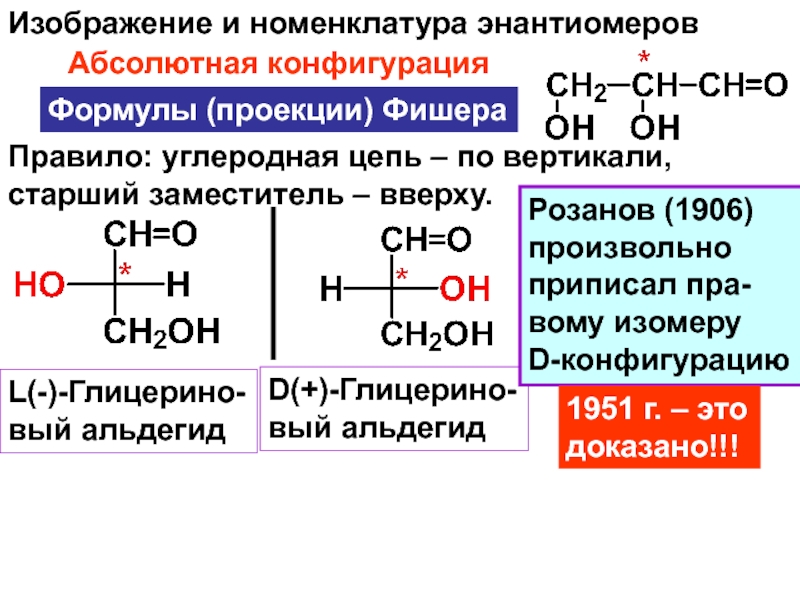
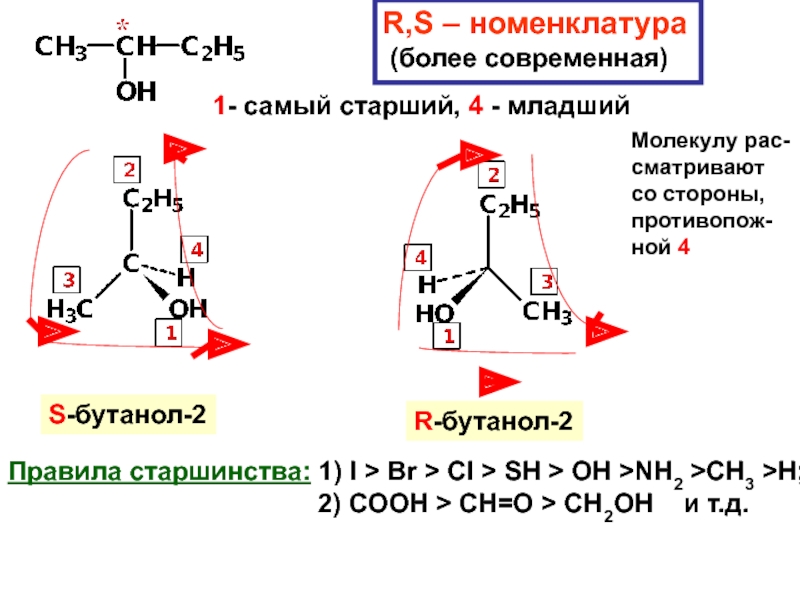
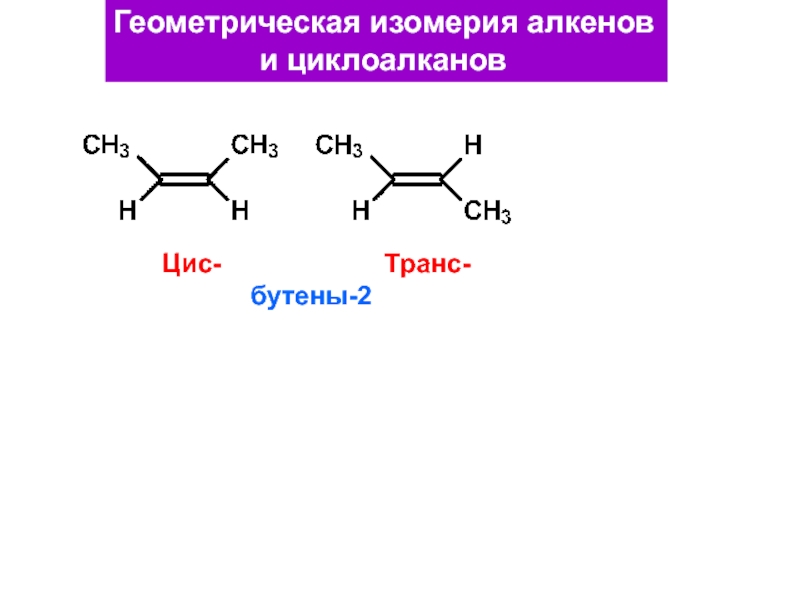
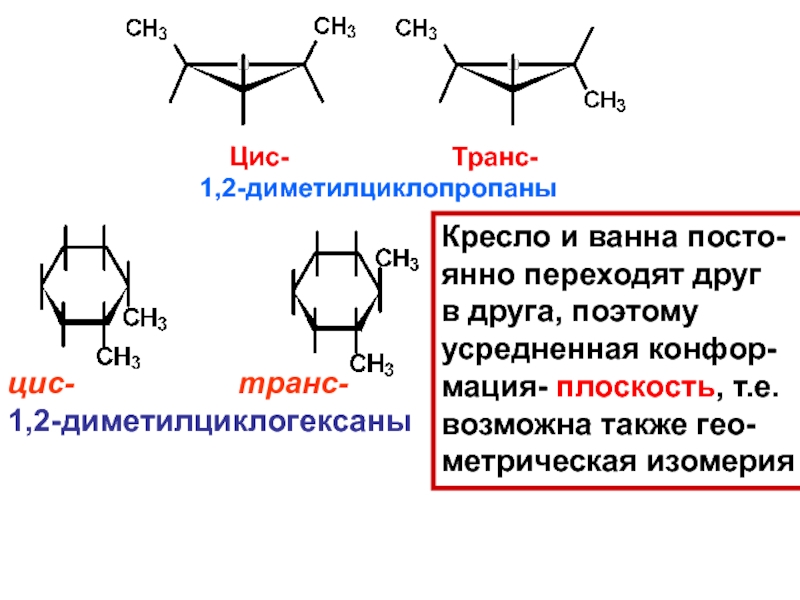
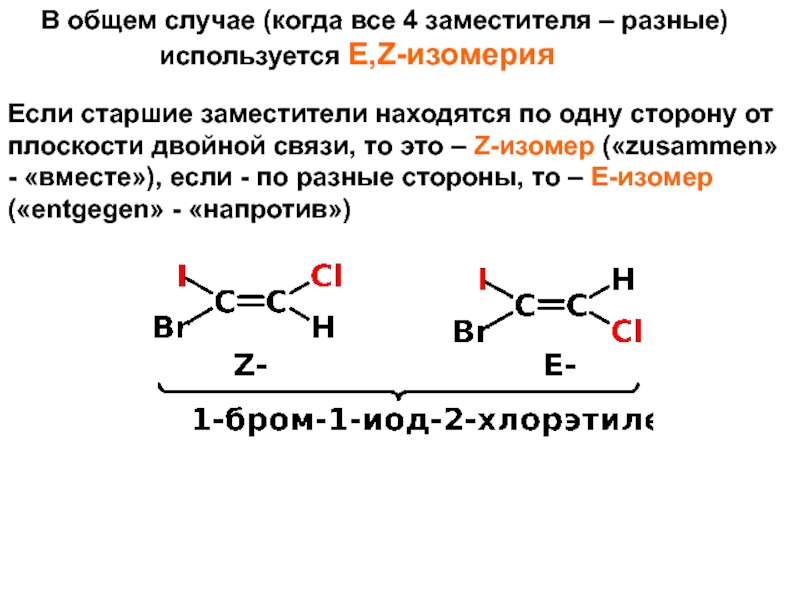
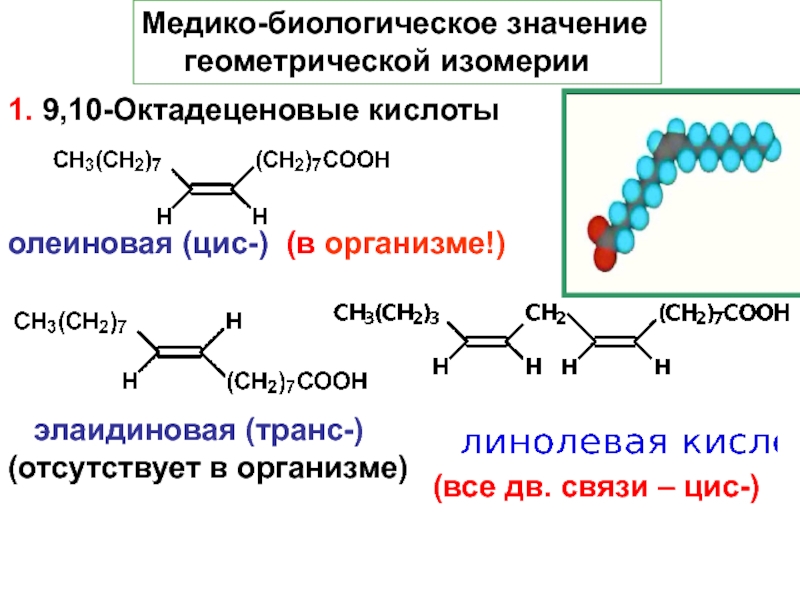
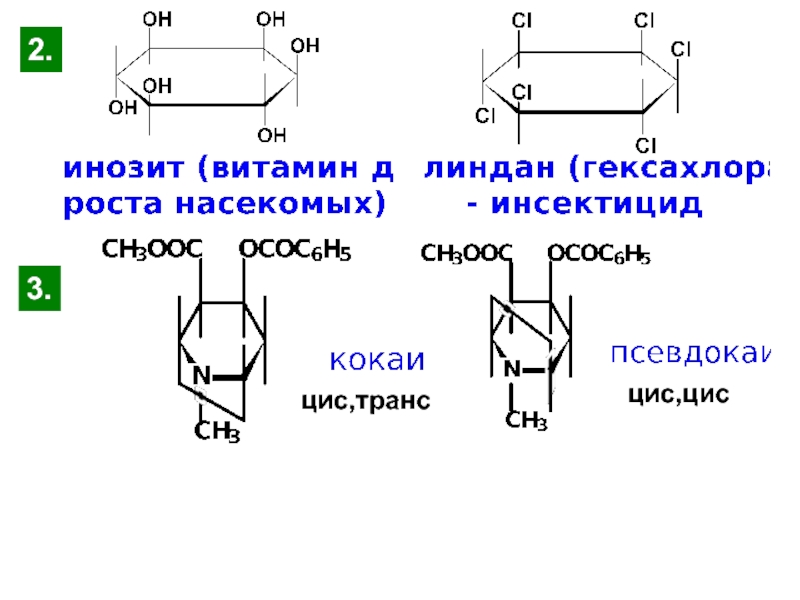
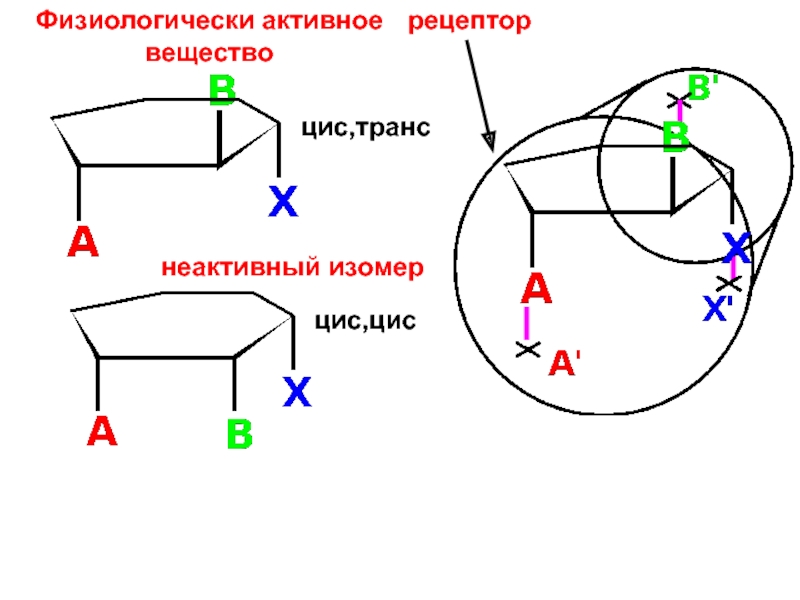
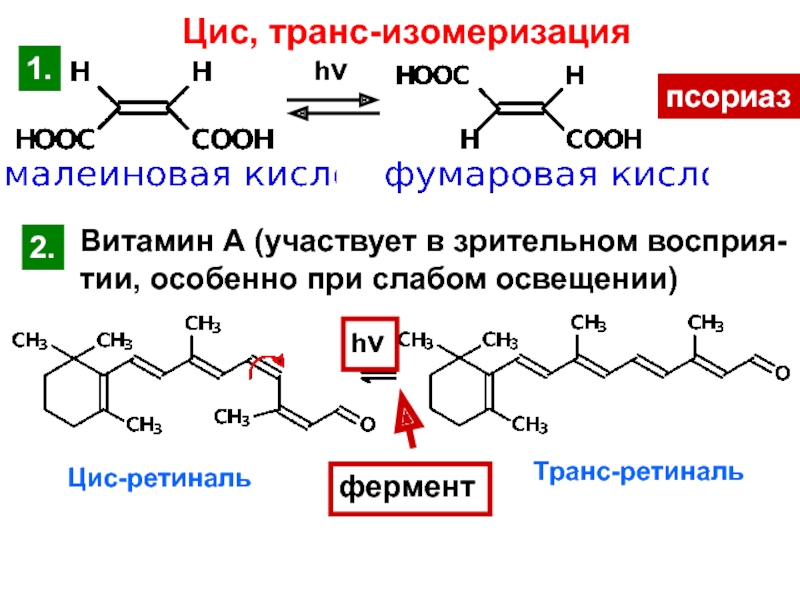
и свойства
веществ, участвующих в процессах жизнедеятельности,
в непосредственной связи с познанием
их биологичес-ких функций.
«Органическая химия – химия соединений углерода»
А. Кекуле
«Органическая химия – химия углеводородов и их функ-
циональных производных»
К. Шорлеммер