Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
выделение и очистка биопрепарата
Содержание
- 1. выделение и очистка биопрепарата
- 2. 5. ВЫДЕЛЕНИЕ И ОЧИСТКА БИОПРЕПАРАТА
- 3. КОНЦЕНТРИРОВАНИЕОБЕЗВОЖИВАНИЕСТАБИЛИЗАЦИЯКУЛЬТУРА КЛЕТОКВЫДЕЛЕНИЕ ПРОДУКТОВ БИОСИНТЕЗАСепарация,
- 4. Методы разрушения клетокХимические;Физические;Биохимические; В процессе разрушения клеток необходимо сохранить конечный продукт - исключить денатурацию белка.
- 5. Разрушение клетокХимические методы Физические методы
- 6. Разрушение клетокБиохимические методы - лизис с помощью
- 7. Сепарация продуктов разрушения клеточных стенок и лизата:низкоскоростное
- 8. КОНЦЕНТРИРОВАНИЕОБЕЗВОЖИВАНИЕСТАБИЛИЗАЦИЯКУЛЬТУРА КЛЕТОКВЫДЕЛЕНИЕ ПРОДУКТОВ БИОСИНТЕЗАСепарация,
- 9. Основные стадии биотехнологического процесса1. приготовление и стерилизация
- 10. 6. ПОЛУЧЕНИЕ ГОТОВОЙ ПРОДУКЦИИОчистка биопрепарата от орг.
- 11. Частная биотехнология лекарственных средств
- 12. Биотехнология антибиотиковАНТИБИОТИКИ – специфические продукты жизнедеятельности различных
- 13. Характер взаимоотношения организмов в природеСимбиотический: аэробы
- 14. Преимущества антибиотиков перед цитотоксическими ядами:Избирательность действия: конкретный
- 15. КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО ТИПУ ДЕЙСТВИЯ (медицинская)бактерицидные (b-лактамные,
- 16. Точки приложения действия антибиотиковКлеточная мембрана микроорганизмовУ Gr+
- 17. Классификация по механизму действия:1. Ингибиторы биосинтеза клеточной
- 18. Производство антибиотиков
- 19. 1 стадия. Создание штаммов микроорганизмов Современные штаммы все
- 20. Схема роста мицелия актиномицетов рода StreptomycesВ отличие
- 21. Создание штаммов микроорганизмов-продуцентовРазрушение клеточной стенки и высвобождение
- 22. 2 стадия. Биосинтез антибиотика Культуры актиномицетов вариабельны в
- 23. Двухфазный характер биосинтеза антибиотиков1 фаза – трофофаза.
- 24. ФАЗЫ РОСТА КУЛЬТУРЫ:1 – лаг-фаза. 2
- 25. ИДИОФАЗА Ферментативные процессы на этой стадии более интенсивны
- 26. 3 стадия. Выделение антибиотика Антибиотики в определенной концентрации
- 27. 4 стадия. Очистка антибиотикаСтепень очистки
- 28. 5 стадия. Стандартизация антибиотикаОценивают: - биологическую активность; - антимикробный
- 29. Биологическая активность антибиотиковИзмеряется в условных единицах –
- 30. Изготовление лекарственных форм антибиотикаОсуществляется в строго асептических
- 31. СтрептомицинПродуцент – актиномицеты Streptomyces griseusВыделен в 1943
- 32. Стрептомицин - Аминогликозидный антибиотик (ШСД)А – агликон
- 33. Мальтольная пробаL-стрептоза в щелочной среде подвергается дегидратации
- 34. Особенности биосинтезаКультура генетически нестабильна. Перестройки ДНК происходят
- 35. ЛЕВОРИНПротивогрибковый антибиотик (фунгицидное). Оказывает действие на дерматофиты,
- 36. Структура основного компонента леворина. Продуцент - Streptomyces
- 37. Особенности технологии β – лактамных антибиотиковВыделены
- 38. Пенициллины В основе бициклическая структура, состоящая из
- 39. Целостность 6_АПК важна для проявления антибиотических свойств.
- 40. Пенициллины. Липосомирование пенициллинов позволяет: 1. Защитить антибиотик от
- 41. Пенициллины. Продуцент – Penicillium chrysogenium. Несовершенный (митоспоровый)
- 42. Пенициллины. Особенности культивированияPenicillium chrysogeniumВырабатывает сильные протеолитические
- 43. Предшественники биосинтеза пенициллинаP. chrysogenium синтезирует различные антибиотики,
- 44. Слайд 44
- 45. Влияние предшественников на образование пенициллинов культурой Р.
- 46. Гипотеза Большинство предшественников токсичны для гриба.С биологической
- 47. Особенности биосинтеза пенициллинаПосторонние микроорганизмы снижают выход пенициллина,
- 48. Полусинтетический способ получения пенициллинов1. В результате биосинтеза
- 49. 1 стадия производства полусинтетических пенициллиновПенициллин-ацилаза Природный
- 50. 2 стадия На основе 6-АПК синтезировано более
- 51. Наиболее ценные полусинтетические пенициллины название пенициллина
- 52. ЦЕФАЛОСПОРИНЫ. ШСД Продуцент – гриб рода
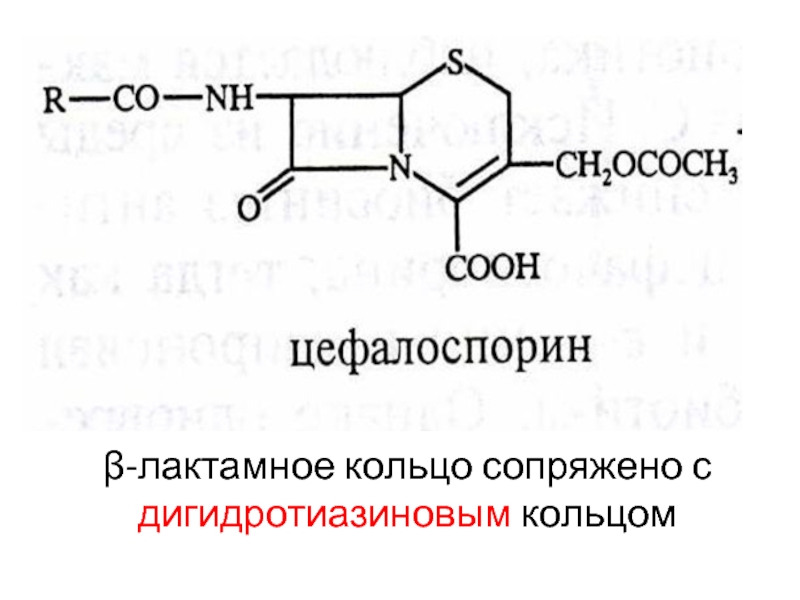
- 53. β-лактамное кольцо сопряжено с дигидротиазиновым кольцом
- 54. Устойчив к β-лактамазе, но расщепляется ферментом – цефалоспориназой (вырабатывается лишь немногими м/о рода Enterobacter)
- 55. Механизм действия пенициллинов и цефалоспоринов Ингибируют синтез
- 56. ИНГИБИТОРЫ ЛАКТАМАЗ
- 57. Клавамы - (3-лактамные антибиотики, отличающиеся от пенициллинов
- 58. Карбапенемы - это новое семейство лактамных антибиотиков,
- 59. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Основные стадии биотехнологического процесса
1. приготовление и стерилизация питательных сред
2. приготовление
посевного материала
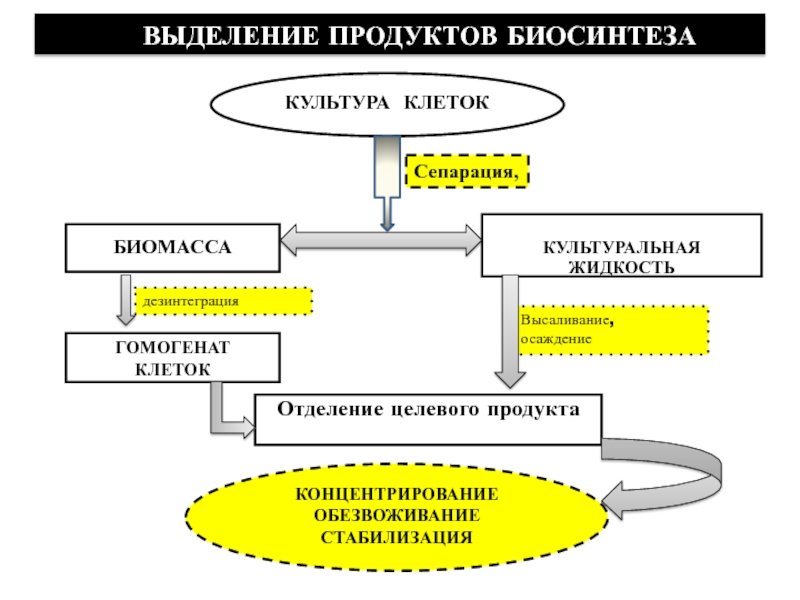
получение готовой продукцииСлайд 3КОНЦЕНТРИРОВАНИЕ
ОБЕЗВОЖИВАНИЕ
СТАБИЛИЗАЦИЯ
КУЛЬТУРА КЛЕТОК
ВЫДЕЛЕНИЕ ПРОДУКТОВ БИОСИНТЕЗА
Сепарация,
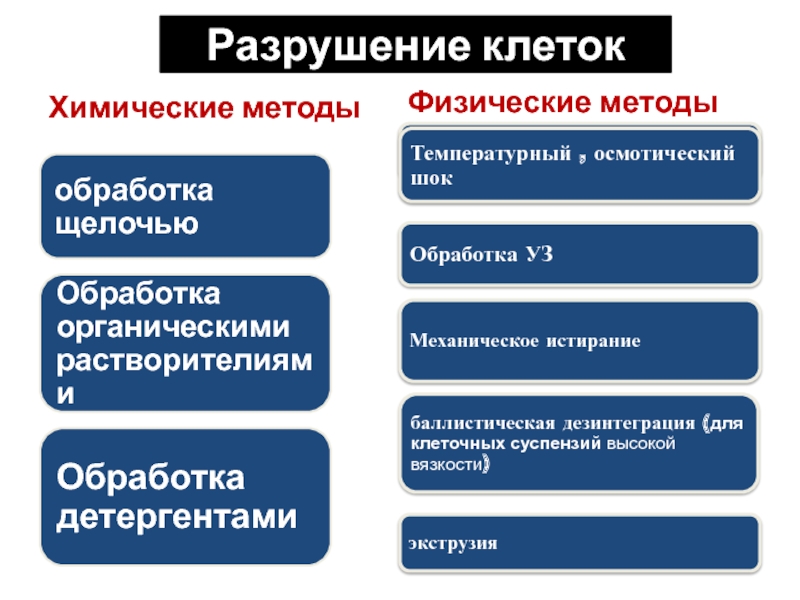
Слайд 4Методы разрушения клеток
Химические;
Физические;
Биохимические;
В процессе разрушения клеток необходимо сохранить конечный
продукт - исключить денатурацию белка.
Слайд 6Разрушение клеток
Биохимические методы - лизис с помощью ферментов
Gr+ бактерии
разрушают с помощью мурамидазы – лизоцима яичного белка. Фермент разрушает
пептидные связи между N-ацетилглюкозамином и остатками N-ацетилмурамовой кислоты – осн. элементы клет. оболочки.Gr- бактерии клеточная стенка тоньше, но покрыта фосфо-липопротеидным комплексом. Лизоцим не справляется со слоем липидов, поэтому его используют в сочетании с ЭДТА.
Дрожжи. Клет. стенки образованы частично фосфорили-рованными маннатами и β-глюканами
Плесневые (низшие) грибы. Клет. стенки из α- и β-глюканов, гликопротеидов и хитина.
используют комплексы ферментов, разрушающих эти конструкции: фосфоманназу, β-глюканазу-1,3 или -1,6, хитиназу (комплексный дрожжелитический препарат).
Слайд 7Сепарация продуктов разрушения клеточных стенок и лизата:
низкоскоростное центрифугирование
микрофильтрация
высаливание нейтральными солями
высокой концентрации: Li2SO4, Na2SO4, (NH4)2SO4
Выделение белкового продукта из лизата:
седиментация
под воздействием органических дегидратантов: этанола, ДМСО, глицерина и т.д. Возможно осаждение в результате замены растворителя (ацетоном, хлороформом или другими органическими растворителями).Выделение веществ (ВМС) небелковой
природы из лизата:
Обработка среды после разрушения клеток
Слайд 8КОНЦЕНТРИРОВАНИЕ
ОБЕЗВОЖИВАНИЕ
СТАБИЛИЗАЦИЯ
КУЛЬТУРА КЛЕТОК
ВЫДЕЛЕНИЕ ПРОДУКТОВ БИОСИНТЕЗА
Сепарация,
Слайд 9Основные стадии биотехнологического процесса
1. приготовление и стерилизация питательных сред
2. приготовление
посевного материала
3. культивирование
4. обработка культуральной жидкости
5. ВЫДЕЛЕНИЕ И ОЧИСТКА БИОПРЕПАРАТА
6.
ПОЛУЧЕНИЕ ГОТОВОЙ ПРОДУКЦИИСлайд 106. ПОЛУЧЕНИЕ ГОТОВОЙ ПРОДУКЦИИ
Очистка биопрепарата от орг. примесей (хроматография, электрофорез,
диализ и т.д.)
Высушивание. Используют щадящие методы сушки: сублимационная сушка
на установках типа «Иней» (РФ), «Юзефруа» (Фр.), «Heto – Helton» (Дания). Используют криопротекторы (среды высушивания). Розлив (рассыпка) и укупорка продукта - в асептических условиях или в помещениях класса А (В) по GMP.
Этикетирование, упаковка по общепринятой схеме.
Слайд 12Биотехнология антибиотиков
АНТИБИОТИКИ – специфические продукты жизнедеятельности различных групп микроорганизмов, растений,
животных, избирательно задерживающие рост и развитие иных организмов или злокачественных
опухолейЕгоров Н.С Основы учения об антибиотиках. Высшая школа, 1986. – 448с.
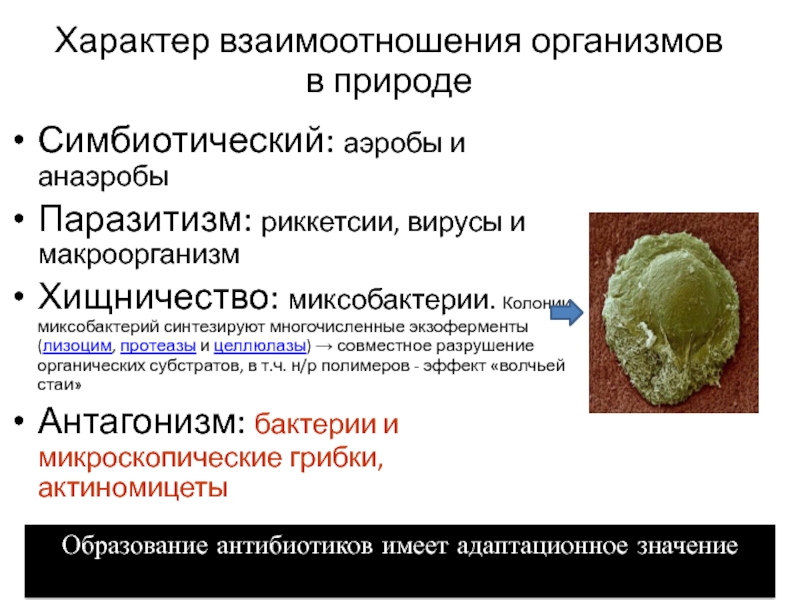
Слайд 13Характер взаимоотношения организмов
в природе
Симбиотический: аэробы и анаэробы
Паразитизм: риккетсии, вирусы
и макроорганизм
Хищничество: миксобактерии. Колонии миксобактерий синтезируют многочисленные экзоферменты (лизоцим, протеазы и целлюлазы)
→ совместное разрушение органических субстратов, в т.ч. н/р полимеров - эффект «волчьей стаи»Антагонизм: бактерии и микроскопические грибки, актиномицеты
Образование антибиотиков имеет адаптационное значение
Слайд 14Преимущества антибиотиков перед цитотоксическими ядами:
Избирательность действия: конкретный антибиотик проявляет свое
действие лишь в отношении определенных организмов, не оказывая влияния на
другие формы живых существ.В медицине могут быть использованы лишь те антибиотики, для которых мишени в микроорганизмах отличаются от подобных систем макроорганизма
Высокая биологическая активность в отношении только чувствительных к ним организмов (низкие концентрации и эфф. дозы).
Антисептики и дезинфектанты неспецифичны: активны в отношении всех м/о
Избирательность влияния антибиотиков на микробные клетки по сравнению с клетками макроорганизма определяется наличием структурных и метаболических различий между ними.
В отличие от животных клеток клетки бактерий
снабжены стенкой,
имеют единичную хромосому,
лишены митохондрий, а большинство митохондриальных ферментов расположены на плазматической мембране.
Различно строение рибосом.
Слайд 15КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО ТИПУ ДЕЙСТВИЯ (медицинская)
бактерицидные (b-лактамные, аминогликозиды, полимиксины и
др.): вызывают гибель микроорганизмов. Используются при лечении тяжелых инфекционных заболеваний
бактериостатические
(макролиды, тетрациклины, левомицетин): прекращают или приостанавливают размножение микроорганизмов. В этом случае организм окончательно избавляется от возбудителя с помощью факторов иммунитета.Бактерицидные антибиотики более выгодны, особенно в условиях неполноценного функционирования системы иммунитета.
Антибиотики широкого и узкого спектра действия. Действуют на м/о в зависимости от строения клеточной оболочки бактерий
Слайд 16Точки приложения действия антибиотиков
Клеточная мембрана микроорганизмов
У Gr+ бактерий (слой ацетилглюкозамина
и ацетилмурамовой кислоты, соединенные пептидными мостиками) - более уязвима;
У Gr-
бактерий клеточная стенка покрыта слоем липидов, поэтому менее проницаема для антибиотиков. Более защищены. Подвержены действию антибиотиков, способных проникать через этот слой (липофильных);Внутренние структуры клеток
Слайд 17Классификация по механизму действия:
1. Ингибиторы биосинтеза клеточной стенки: пенициллин, цефалоспорины,
гликопептиды, карбапены, карбапенемы, ванкомицин, ристомицин, циклосерин и т.д.
2. Разрушители клеточных
мембран: полиеновые антибиотики, полимиксины3. Ингибиторы синтеза белка в рибосомах: макролиды, линкомицины аминогликозиды, тетрациклины, левомицетин
4. Ингибиторы РНК-полимеразы: рифампицин – нарушает метаболизм фолиевой кислоты
5. Ингибиторы синтеза ДНК на уровне ДНК-матрицы: нитрофураны, налидиксовая кислота, фторхинолоны, митомицины, и др.
6. Ингибиторы синтеза РНК на уровне ДНК-матрицы (стрептомицины), и т.д.
Слайд 191 стадия. Создание штаммов микроорганизмов
Современные штаммы все чаще получают используя
технологию рекомбинации ДНК
Большая часть современных антибиотиков синтезируется рекомбинантными штаммами
актиномицетов рода Streptomyces – прокариот сложного строенияСлайд 20Схема роста мицелия актиномицетов рода Streptomyces
В отличие от E.Coli, Streptomyces
существуют не в виде изолированных клеток, а в виде нитей
– мицелл, образованных клетками.Клеточные стенки ригидны и прочны, как у большинства прокариот.
Клетки отделяют др.от др. и переводят в протопласты путем разрушения клеточной стенки с помощью ферментов или химических веществ
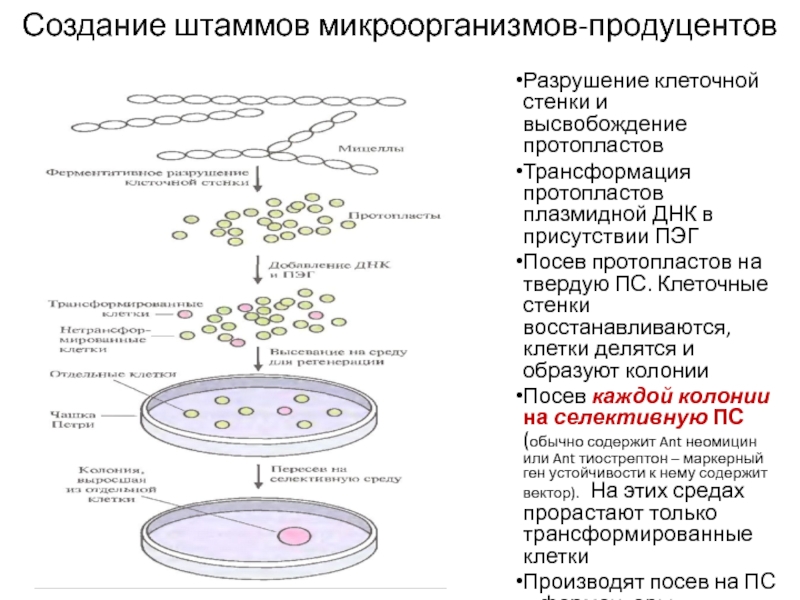
Слайд 21Создание штаммов микроорганизмов-продуцентов
Разрушение клеточной стенки и высвобождение протопластов
Трансформация протопластов плазмидной
ДНК в присутствии ПЭГ
Посев протопластов на твердую ПС. Клеточные
стенки восстанавливаются, клетки делятся и образуют колонииПосев каждой колонии на селективную ПС (обычно содержит Ant неомицин или Ant тиострептон – маркерный ген устойчивости к нему содержит вектор). На этих средах прорастают только трансформированные клетки
Производят посев на ПС в ферментеры
Слайд 222 стадия. Биосинтез антибиотика
Культуры актиномицетов вариабельны в связи с генетической
нестабильностью (высокая приспособляемость к изменениям среды обитания). Для стабилизации штаммов
–продуцентов в ПС вводят антимутагены – вещества регулирующие экспрессию генов и предотвращающие хромосомные перестройки:- пуриновые нуклеотиды;
- пуриновые основания (кофеин, теобромин, теофиллин, пентоксифиллин)
- ионы марганца;
- метионин
- гистидин;
Для каждого штамма актиномицетов состав ПС подбирается индивидуально для исключения мутаций в генах, кодирующих биосинтез антибиотиков
Требуется интенсивная аэрация среды
Слайд 23Двухфазный характер биосинтеза антибиотиков
1 фаза – трофофаза. Сбалансированный рост микроорганизмов
и накопление биомассы продуцента. Быстрое потребление компонентов ПС, кислорода и
биосинтез БАВ, необходимых для его собственного роста (белки, ферменты, нуклеиновые кислоты и др.). Снижение рН. Выработка ферментов, синтезирующих антибиотик отсутствует. Лаг-фаза, фазы ускорения и экспоненциальная.2 фаза – идиофаза. Накопление биомассы замедлено. Культуральная среда обеднена питательными веществами. Преобладают протеолитические процессы. Повышение рН. Борьба за выживание: активируются и транскрибируются гены, кодирующие синтез веществ, подавляющих рост других микроорганизмов – антибиотиков. Антибиотики экскретируются за пределы клетки. Фазы замедления роста, стационарная, отмирания
Слайд 24
ФАЗЫ РОСТА КУЛЬТУРЫ:
1 – лаг-фаза.
2 – фаза ускорения.
3 – экспоненциальная фаза.
4 – фаза замедления.
5 -
стационарная фаза. 6 – фаза отмирания.
Биосинтез антибиотика достигает максимальной скорости в стационарную фазу, когда биомасса культуры максимальна
Слайд 25ИДИОФАЗА
Ферментативные процессы на этой стадии более интенсивны в присутствии антагонистических
штаммов микроорганизмов (например иных бактерий). Наблюдается повышенный биосинтез антибиотика как
результат проявления анатагонистических отношений.РИСК: при совместном культивировании различных микроорганизмов могут возникнуть гибриды с иными свойствами → вырождение штамма-продуцента
Слайд 263 стадия. Выделение антибиотика
Антибиотики в определенной концентрации губительны и для
самого продуцента (Для Streptomyces gryseus - около 0,5% ).
По
достижении Скрит.рост м-о прекращается. Ферментацию прекращают.
Антибиотик выделяют из культуральной среды:
- экстракция органическими растворителями;
- осаждение;
- адсорбция
Слайд 274 стадия. Очистка антибиотика
Степень очистки определяет стабильность антибиотика
при хранении (антибиотики неустойчивы как в кислой, так и в
щелочной среде, при избыточной влажности подвержены гидролизу и окислению)Методы:
Повторная замена растворителя;
Адсорбционная хроматография;
ВЭЖХ и т.д.
Слайд 285 стадия. Стандартизация антибиотика
Оценивают:
- биологическую активность;
- антимикробный спектр;
- токсичность;
- пирогенность;
-
действие на лейкоциты крови;
- стерильность лекарственных форм;
- и т.д.
Слайд 29Биологическая активность антибиотиков
Измеряется в условных единицах – у.е.
У.Е. антибиотической активности
– это минимальное количество антибиотика, способное подавить рост определенного количества
клеток чувствительного тест-микроорганизма, в единице объема (массы) питательной среды.Пример: для стрептомицина 650 у.е./мг способны подавить рост 1000 клеток микобактерий туберкулеза
Слайд 30Изготовление лекарственных форм антибиотика
Осуществляется в строго асептических условиях: в помещениях
не ниже «В» класса чистоты;
Лекарственные формы создают в соответствии с
физико-химическими свойствами и устойчивостью антибиотика к воздействию различных фармацевтических факторов Слайд 31Стрептомицин
Продуцент – актиномицеты
Streptomyces griseus
Выделен в 1943 г. амер. З.А.Ваксманом
Активен
при туберкулезе, угнетает синтез белка
Стрептомицин повышает сродство рибосом м/о к
антикодону аминоацил-тРНК, что ведет к связыванию ошибочных, не соответствующих кодону матрицы мРНК аминоацил-тРНК и обусловливает ошибки при считывании генетической информации. В результате в пептидную цепь включаются необычные аминокислоты и синтезируются неактивные молекулы белка.Избирательность действия обеспечивается существенным различием рибосом у бактерий и млекопитающих. Частицы бактериальных рибосом отличаются большей активностью в образовании связей с антибиотиками, чем рибосомы млекопитающих.
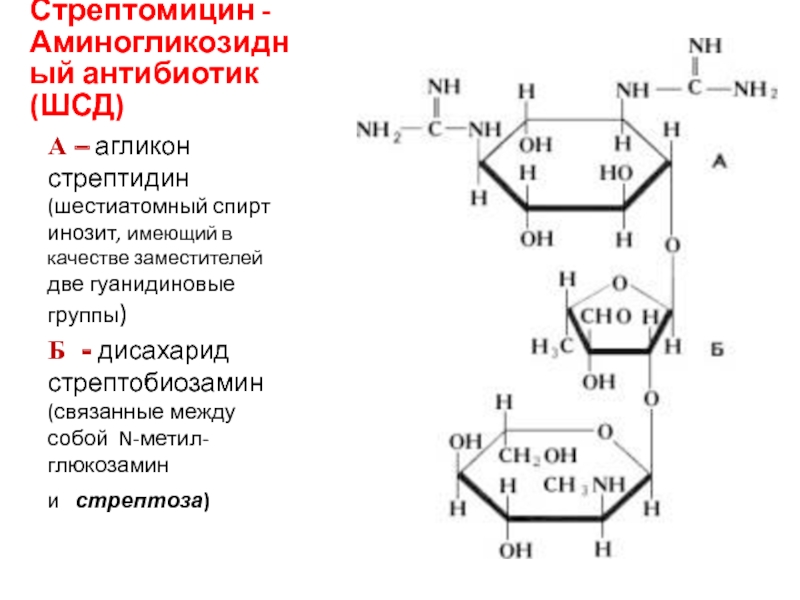
Слайд 32Стрептомицин - Аминогликозидный антибиотик (ШСД)
А – агликон стрептидин (шестиатомный спирт
инозит, имеющий в качестве заместителей две гуанидиновые группы)
Б - дисахарид
стрептобиозамин (связанные между собой N-метил-глюкозамин и стрептоза)
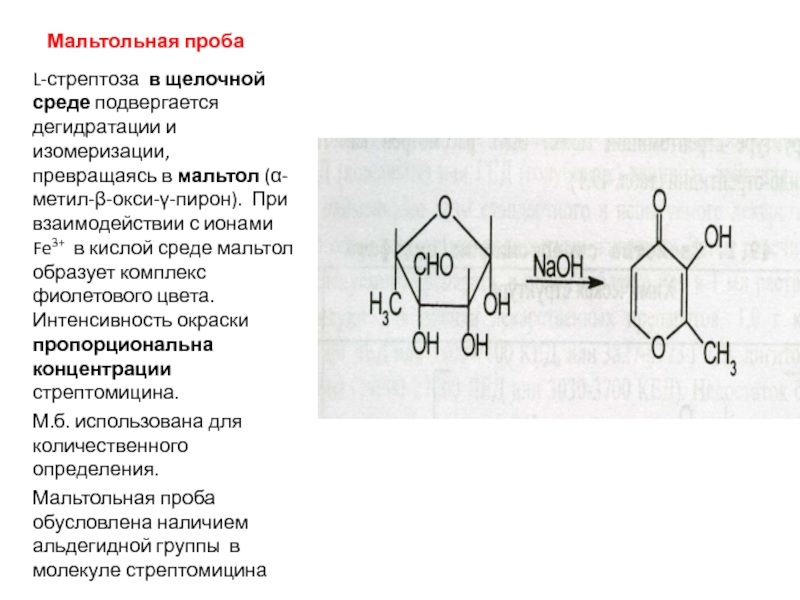
Слайд 33Мальтольная проба
L-стрептоза в щелочной среде подвергается дегидратации и изомеризации, превращаясь
в мальтол (α-метил-β-окси-γ-пирон). При взаимодействии с ионами Fe3+ в
кислой среде мальтол образует комплекс фиолетового цвета. Интенсивность окраски пропорциональна концентрации стрептомицина.М.б. использована для количественного определения.
Мальтольная проба обусловлена наличием альдегидной группы в молекуле стрептомицина
Слайд 34Особенности биосинтеза
Культура генетически нестабильна. Перестройки ДНК происходят легко, т.к. стрептомицин
кодирует плазмидная ДНК
Для стабилизации штаммов при культивировании в ПС добавляют
антимутагеныПС включает жирную соевую муку, белок ее не востребован
Культивирование требует непрерывной и сильной аэрации
Повышенное содержание в идиофазу хлоридов натрия, калия и цистеина тормозит биосинтез стрептомицина
Стрептомицин выделяется в культуральную среду, среду отделяют от мицеллия центрифугированием
Добавляют щавелевую кислоту для осаждения белков, ионов кальция, магния, железа
Стрептомицин сильно полярен, х/р в воде (и основание и соли) и н/р в органических растворителях. Для очистки многократно осаждают из воды ораническими растворителями
В чистом виде стрептомицин выделяют методом адсорбции при рН 2-4 на активированном угле и методом ионообменной хроматографии
Слайд 35ЛЕВОРИН
Противогрибковый антибиотик (фунгицидное). Оказывает действие на дерматофиты, дрожжи, дрожжеподобные и
плесневые грибы.
Поражает цитоплазматические мембраны грибковых клеток, взаимодействует с эргостеролом,
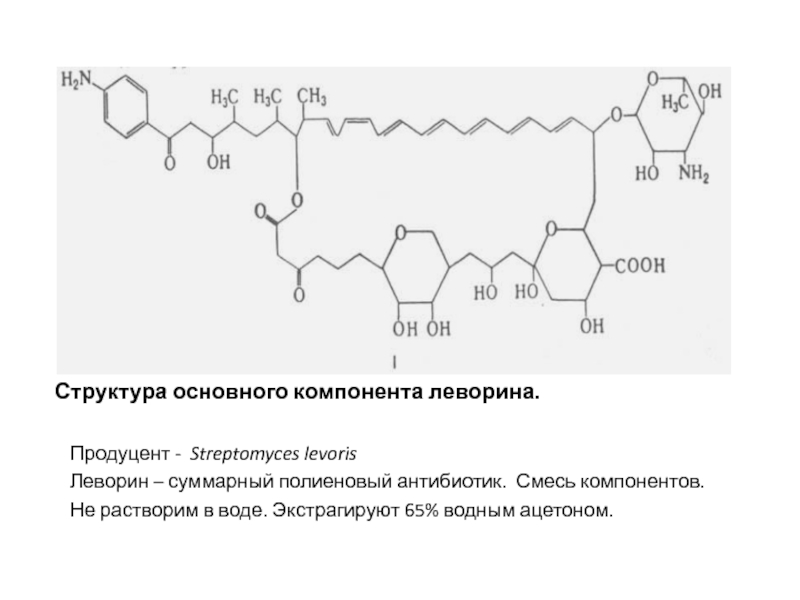
образуя в мембране поры, что приводит к утечке важных для жизнедеятельности гриба компонентов цитоплазмы – ионов К+ и ферментов. Активен в отношении практически всех грибков, патогенных для человекаСлайд 36Структура основного компонента леворина.
Продуцент - Streptomyces levoris
Леворин – суммарный
полиеновый антибиотик. Смесь компонентов.
Не растворим в воде. Экстрагируют 65% водным
ацетоном.Слайд 37Особенности технологии
β – лактамных антибиотиков
Выделены в чистом виде Флемингом,
X.Флори и Е.Чейном в 1940 г.
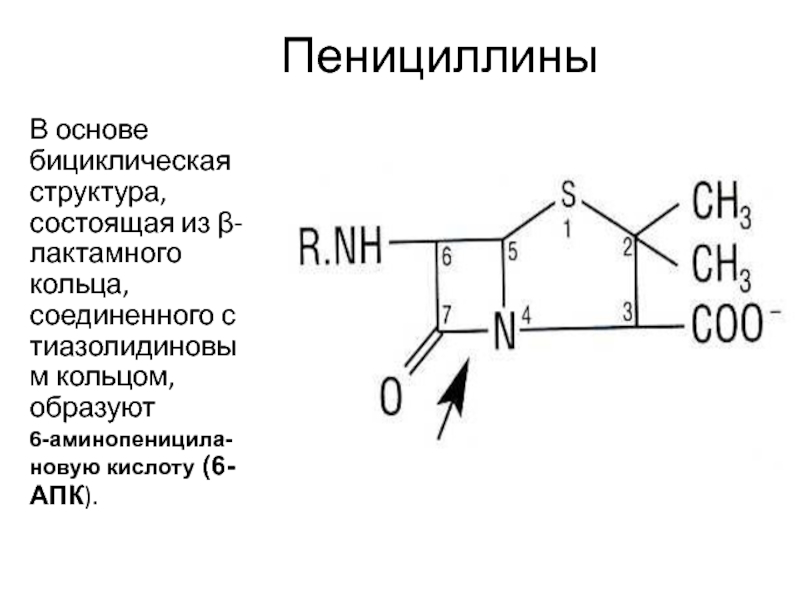
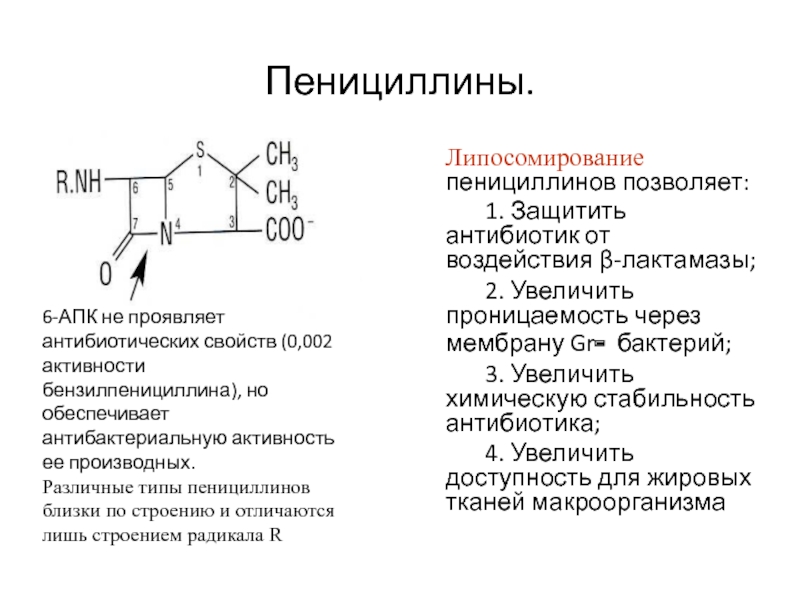
Слайд 38Пенициллины
В основе бициклическая структура, состоящая из β-лактамного кольца, соединенного
с тиазолидиновым кольцом, образуют
6-аминопеницила-новую кислоту (6-АПК).
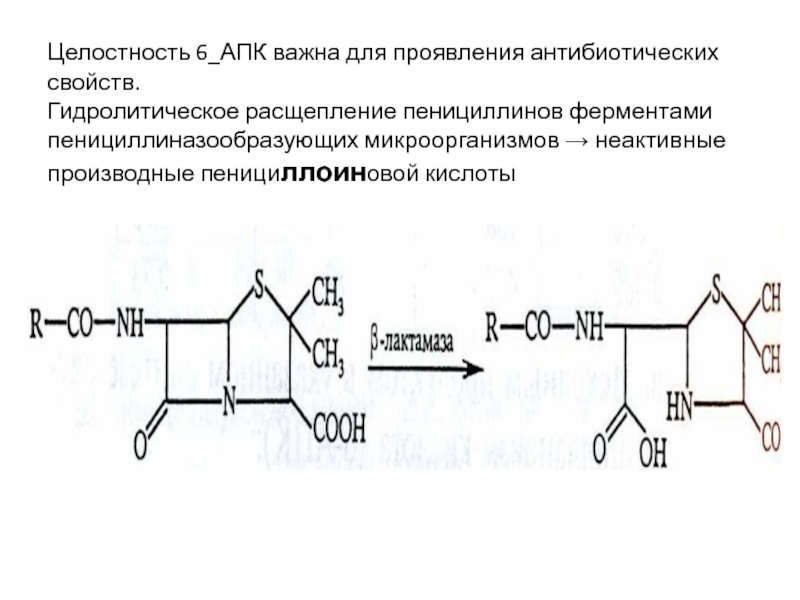
Слайд 39Целостность 6_АПК важна для проявления антибиотических свойств. Гидролитическое расщепление пенициллинов
ферментами пенициллиназообразующих микроорганизмов → неактивные производные пенициллоиновой кислоты
Слайд 40Пенициллины.
Липосомирование пенициллинов позволяет:
1. Защитить антибиотик от воздействия β-лактамазы;
2. Увеличить
проницаемость через мембрану Gr- бактерий;
3. Увеличить химическую стабильность антибиотика;
4. Увеличить
доступность для жировых тканей макроорганизма 6-АПК не проявляет антибиотических свойств (0,002 активности бензилпенициллина), но обеспечивает антибактериальную активность ее производных.
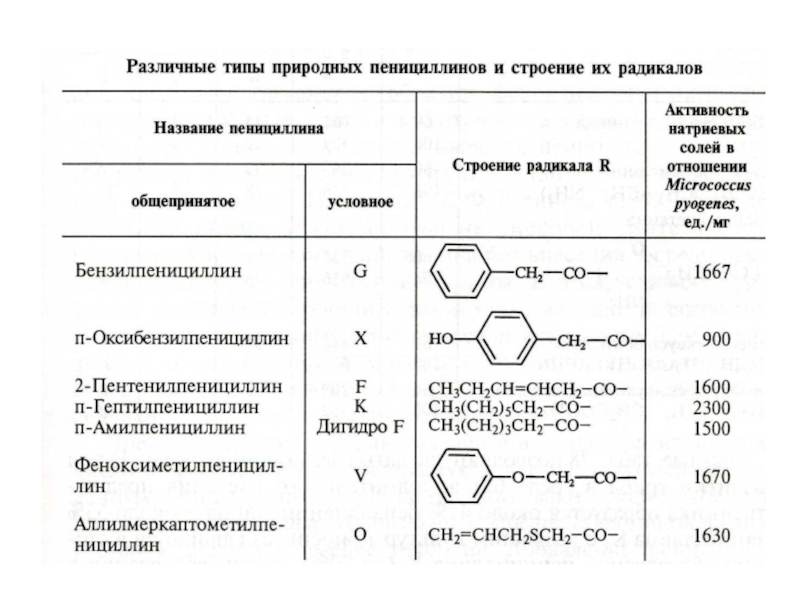
Различные типы пенициллинов близки по строению и отличаются лишь строением радикала R
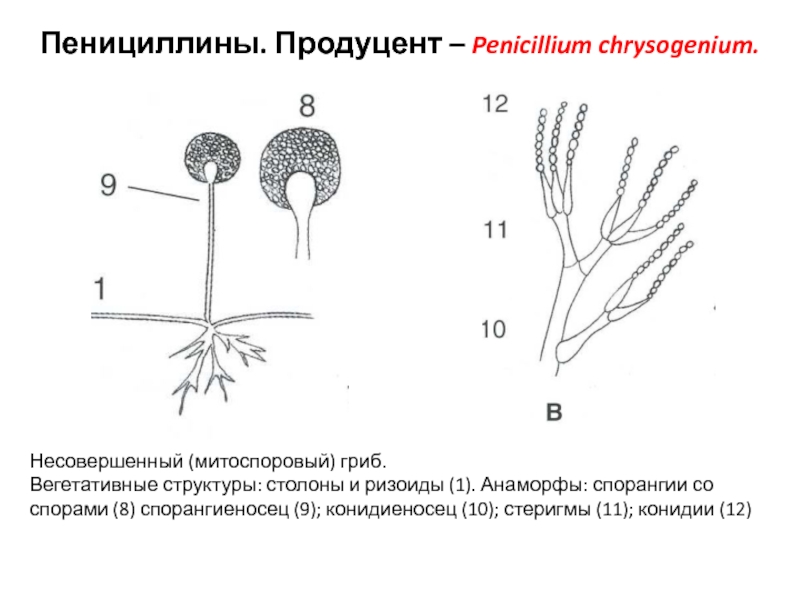
Слайд 41Пенициллины. Продуцент – Penicillium chrysogenium.
Несовершенный (митоспоровый) гриб.
Вегетативные структуры: столоны
и ризоиды (1). Анаморфы: спорангии со спорами (8) спорангиеносец (9);
конидиеносец (10); стеригмы (11); конидии (12)Слайд 42Пенициллины.
Особенности культивирования
Penicillium chrysogenium
Вырабатывает сильные протеолитические ферменты, поэтому способен расти
на грубой ПС, содержащей:
Арахисовую муку
Муку хлопковых семян
Жмых (отходы)
Лактозу, сахарозу (глюкоза
нежелательна)Натрия сульфат, тиосульфат
Фосфаты, фитаты
Трофофаза. Оптимальная температура: +30°;
ИДИОФАЗА: +20°С
Слайд 43Предшественники биосинтеза пенициллина
P. chrysogenium синтезирует различные антибиотики, отличающиеся строением радикала
R, антибиотической активностью и спектром биологического действия. Вид вырабатываемого антибиотика
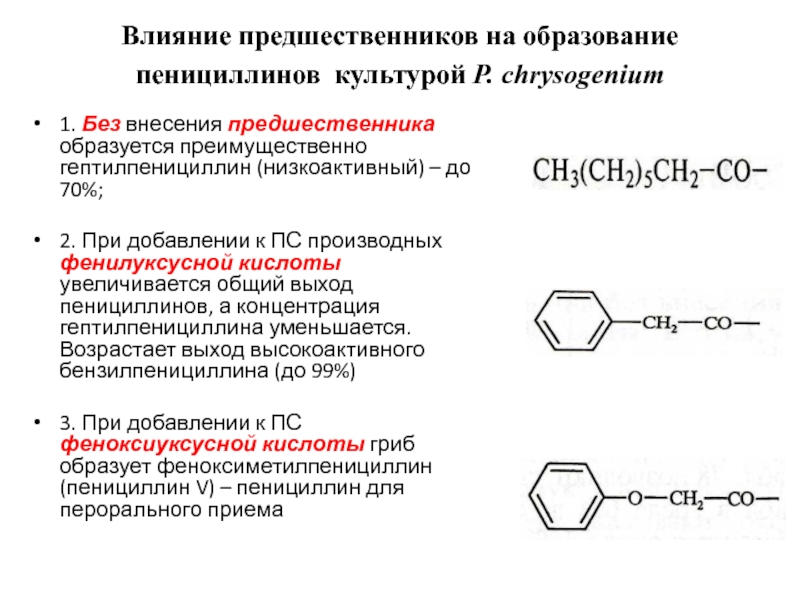
определяется веществом предшественником, содержащимся в ПС – веществом, которое гриб тем или иным путем включает в молекулу 6-АПК.Слайд 45Влияние предшественников на образование пенициллинов культурой Р. сhrysogenium
1. Без
внесения предшественника образуется преимущественно гептилпенициллин (низкоактивный) – до 70%;
2. При
добавлении к ПС производных фенилуксусной кислоты увеличивается общий выход пенициллинов, а концентрация гептилпенициллина уменьшается. Возрастает выход высокоактивного бензилпенициллина (до 99%)3. При добавлении к ПС феноксиуксусной кислоты гриб образует феноксиметилпенициллин (пенициллин V) – пенициллин для перорального приема
Слайд 46Гипотеза
Большинство предшественников токсичны для гриба.
С биологической точки зрения использование
грибом предшественников для синтеза пенициллинов рассматривается как «защитный синтез» =
обезвреживание токсичного предшественника путем связывания с продуктами обмена гриба и экскреция за пределы клеткиСлайд 47Особенности биосинтеза пенициллина
Посторонние микроорганизмы снижают выход пенициллина, т.к. продуцируют пенициллиназу
Все
технологические операции ведут в условиях строгой стерильности
Пенициллин выделяется грибом в
культуральную среду.Из культуральной жидкости пенициллин экстрагируют в кислотной форме неполярным растворителем (хлороформ, бутанол, бутилацетат)
Экстракт обрабатывают водным раствором щелочи для перевода кислотной формы пенициллина в соль
Образовавшаяся соль растворяется в воде. Экстракт обрабатывают водой.
Процедуру повторяют многократно
Слайд 48Полусинтетический способ получения пенициллинов
1. В результате биосинтеза при развитии P.chrysogenium
получают природный пенициллин
2. Далее продукт (чаще всего бензилпенициллин) извлекают из
КЖ и гидролизуют иммобилизированной пенициллинацилазой бактериального происхождения с образованием 6АПК3. Ацилируют амин в молекуле 6-АПК соответствующей кислотой или ее хлорангидридом
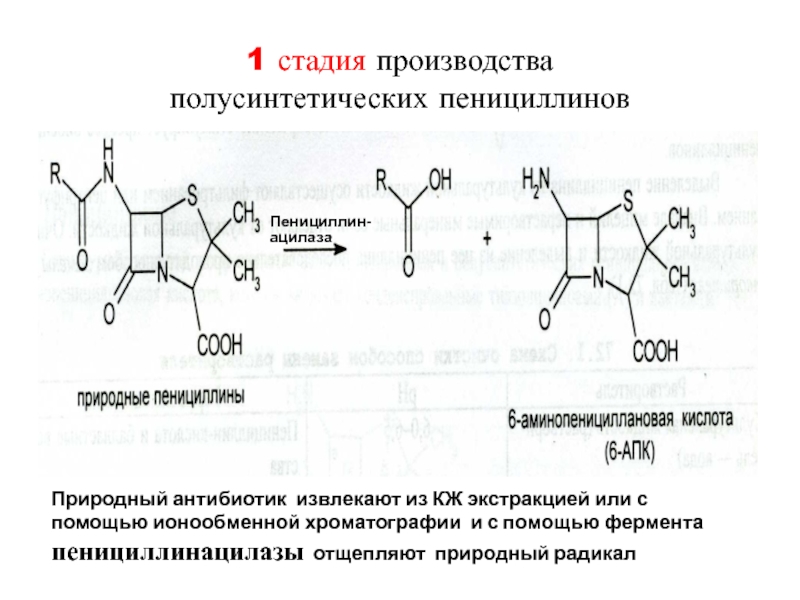
Слайд 491 стадия производства
полусинтетических пенициллинов
Пенициллин-
ацилаза
Природный антибиотик извлекают из КЖ
экстракцией или с помощью ионообменной хроматографии и с помощью фермента
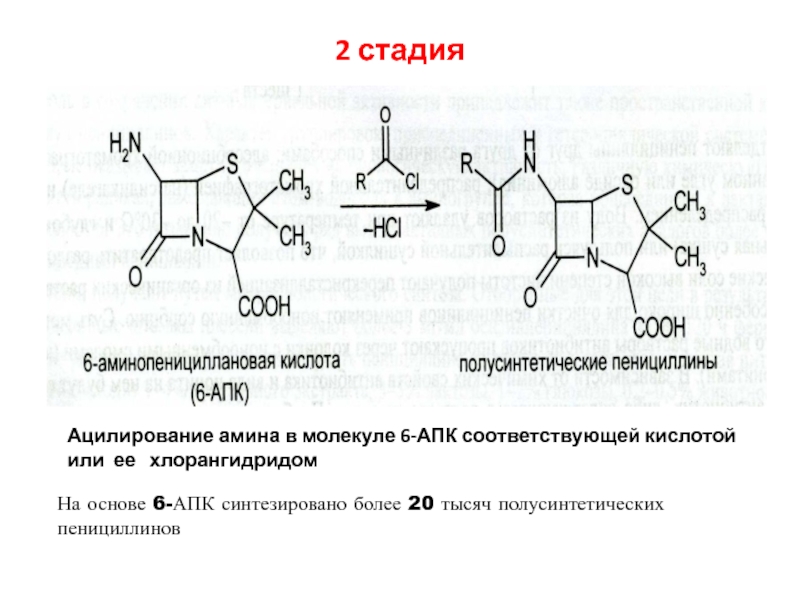
пенициллинацилазы отщепляют природный радикалСлайд 502 стадия
На основе 6-АПК синтезировано более 20 тысяч полусинтетических
пенициллинов
Ацилирование амина в молекуле 6-АПК соответствующей кислотой или ее
хлорангидридом Слайд 52ЦЕФАЛОСПОРИНЫ. ШСД
Продуцент – гриб рода Cephalosporium acremonium (переименован в
Аcremonium chrysogenium), выделен в 1945 г.
Проникают через клеточную оболочку не
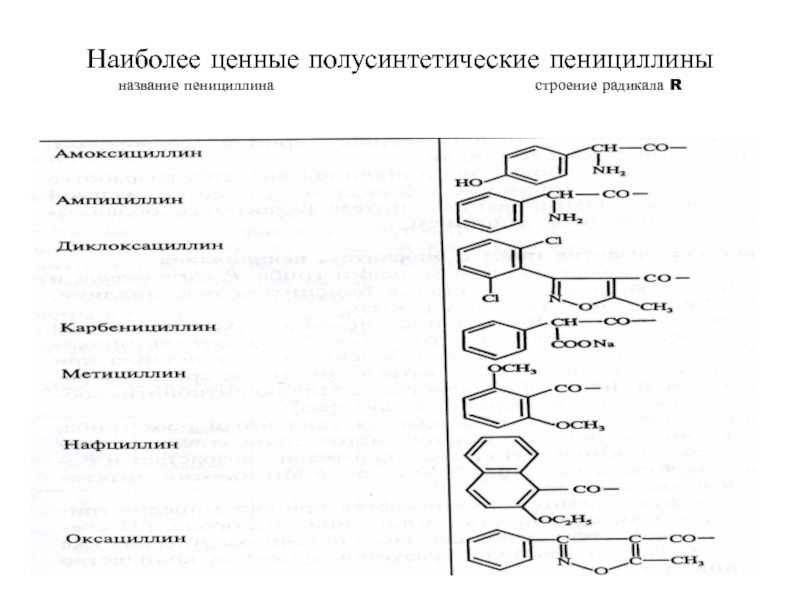
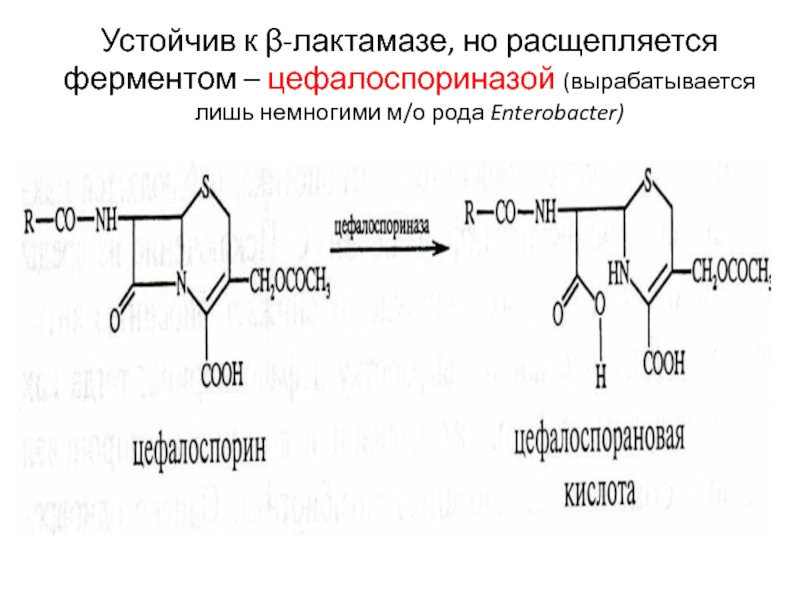
только Gr+ но и Gr- микроорганизмовСлайд 54Устойчив к β-лактамазе, но расщепляется ферментом – цефалоспориназой (вырабатывается лишь
немногими м/о рода Enterobacter)
Слайд 55Механизм действия пенициллинов и цефалоспоринов
Ингибируют синтез клеточной стенки микроорганизмов.
Связываются с пенициллинсвязывающими протеинами (ПСП) – клеточными рецепторами м/о. В
результате возможны различные реакции:- аномальное увеличение микробной клетки;
- нарушение строения поверхности клеточной мембраны;
- останавливается синтез гликопротеина;
- активируется литический фермент в клеточной стенке, что приводит к лизису клетки
Слайд 57Клавамы - (3-лактамные антибиотики, отличающиеся от пенициллинов тем, что в
тиазолидиновом кольце последних сера заменена на кислород (клавемовое оксазолидиновое кольцо)
и в позиции 6 нет боковой цепи. В сочетании с ампициллином и амоксициллином является основой комбинированного препарата аугментин.Слайд 58
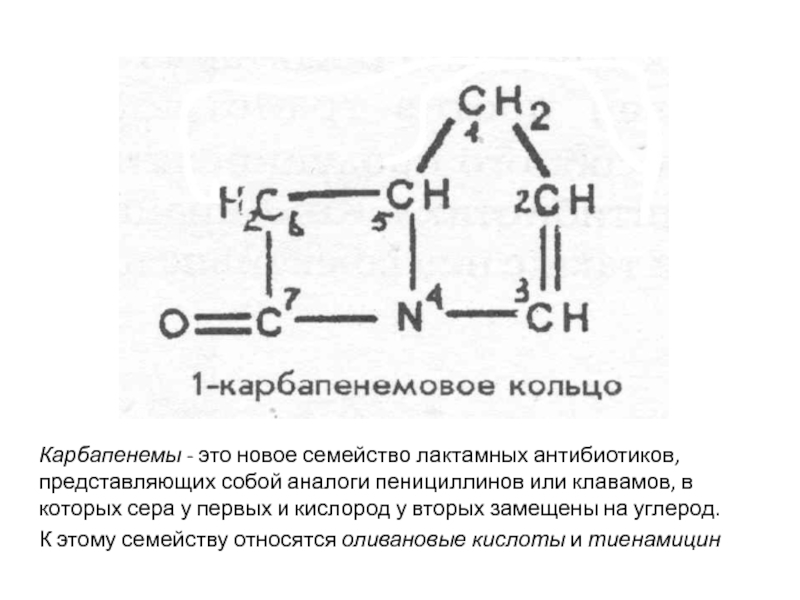
Карбапенемы - это новое семейство лактамных антибиотиков, представляющих собой аналоги
пенициллинов или клавамов, в которых сера у первых и кислород
у вторых замещены на углерод.К этому семейству относятся оливановые кислоты и тиенамицин