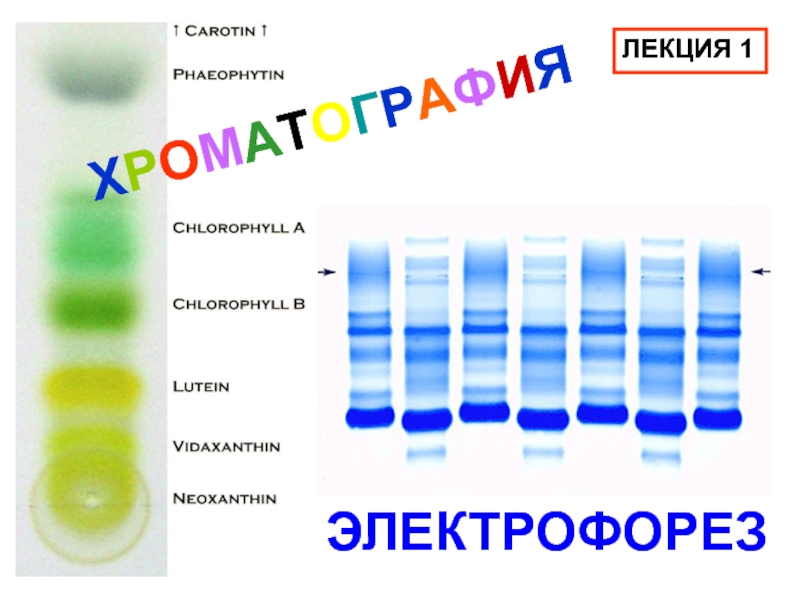
Слайд 1ХРОМАТОГРАФИЯ
ЭЛЕКТРОФОРЕЗ
ЛЕКЦИЯ 1
Слайд 2http://ezproxy.medlib.tomsk.ru:2195/book/ISBN9785996321261.html
Слайд 3Хроматография (от греч. χρώμα - цвет) — метод разделения и
анализа смесей веществ, а также изучения
физико-химических свойств веществ.
Михаил Семенович
Цвет
(1872 – 1919)
М.С. Цвет изобрел метод в 1900 г., решая задачу по разделению раститель-ных пигментов в экстракте.
Первая международная публикация
метода состоялась в 1903 году, в кото-рой автор впервые применил термин
«хроматография».
Слайд 4Принцип метода:
«Разделение компонентов смеси за счет их
неодинакового распределения между дву-
мя
фазами: одна неподвижна (имеет раз-
витую поверхность), другая фаза – поток,
который фильтруется через неподвижную
фазу».
М.С.Цвет
По современной терминологии неподвижную фазу называют матрицей или сорбентом, а подвижную фазу – элюентом.
Слайд 5Хроматография не встретила широкого признания у совре-
менников М.С. Цвета -
многих смущала простота метода, со-
четающаяся с его большими аналитическими возможностями.
В
1918 году М.С. Цвет номинировался на Нобелевскую премию,
но награда не была ему присуждена.
До середины 20-х годов о методе почти забыли.
На рубеже 20 и 30-х годов хроматографию «открыли» во
второй раз.
В 1944 году Дж. Мартин и Р. Синдж получили Нобелевскую
премию по химии за разработку метода распределительной
хроматографии.
По современной классификации хроматографических методов,
вид хроматографии, открытый М.С. Цветом, следует отнести
к адсорбционной хроматографии.
Слайд 6
С 30-х годов хроматография обрела «второе дыхание».
Важнейшие открытия биохимии и
молекулярной биологии
ХХ века всецело обязаны методам хроматографии.
В настоящее время
хроматографические методы широко
используются для качественного и количественного анализа
в органической и неорганической химии, фармакологии и
других науках.
Слайд 7 При хроматографии смесь веществ,
подлежащих разделению, движется
в системе
двух фаз: стационарной и подвижной. Под-
вижная фаза увлекает
компоненты смеси,
которые многократно перераспределяются
между двумя фазами. Сродство компонентов
смеси к фазам не одинаково. Это и опреде-
ляет разницу скоростей движения разных
компонентов смеси вдоль неподвижной фазы.
Благодаря этому компоненты смеси физичес-
ки отделяются друг от друга – происходит
разделение компонентов смеси.
Слайд 8
С учетом существования нескольких видов
хроматографии, следует помнить, что
неподвижная фаза (стационарная,
матри-
ца, сорбент) может быть:
твердой
жидкой
смесь твердой и жидкой
фаз.
подвижная фаза (элюент) может быть:
- жидкой
- газообразной
Слайд 9Важнейшая количественная харак-
теристика распределения компо-
нента смеси между стационарной и
подвижной
фазами – коэффициент
распределения (Kd):
[вещества]
в неподвижной ф.
Kd =
[вещества] в подвижной ф.
Слайд 10 Для эффективного разделения
компонентов смеси подбирают
подвижную
и неподвижную фазы
так, чтобы Kd для компонентов
был максимально
различным.
Kd > 1 – основная часть вещества связана с
неподвижной фазой
Kd ≈ 0 - основная часть вещества связана с
подвижной фазой
Kd = 1 – вещество в одинаковой мере свя-
зано с обеими фазами
Слайд 11 Оптимальные условия для высо-коэффективного разделения смеси, когда:
0
Kd < 1
Слайд 12Классификации видов хроматографии
1. По агрегатному состоянию фаз
Газовая хроматография
Газо-жидкостная хроматография
Газо-твёрдофазная хроматография
Жидкостная хроматография
Жидкостно-жидкостная хроматография
Жидкостно-твёрдофазная хроматография
Жидкостно-гелевая хроматография
Сверхкритическая флюидная хроматография
Слайд 132. По технике выполнения
Колоночная хроматография
Компоненты разделяют на колонке —
трубке, запол-
ненной хроматографическим сорбентом.
Капиллярная хроматография
Разновидность колоночной хроматографии; для
разделения
используют трубку (капилляриспользуют трубку (капилляр), в которой слой сорбента
расположен только на внутренних стенках колонки,
а центральная часть остается свободной.
Плоскостная хроматография
Для разделения используют плоский слой сорбента
небольшой толщины.
Бумажная хроматография
В качестве неподвижной фазы используют специальную
бумагу для хроматографии
Тонкослойная хроматография
Неподвижная фаза представляет собой тонкий слой сорбента
(напр. силикагель), закрепленный на инертной подложке
(напр. из алюминия)
Слайд 143. По цели проведения
Аналитическая хроматография
Препаративная хроматография
Промышленная хроматография
Слайд 154. По принципу фракционирования
Распределительная хроматография
хроматография на бумаге
тонкослойная хроматография
газо-жидкостная хроматография
Проникающая хроматография (гель-хро-матография, гель-фильтрация, молекулярно-ситовая хроматография)
Адсорбционная хроматография
Ионообменная хроматография
Аффинная хроматография
Слайд 161. Распределительная хроматография
1.1. Хроматография на бумаге
Стационарная фаза – целлюлоза-вода (эта
связанная
вода не смешивается с подвижной фазой).
Подвижная фаза – смешивающиеся или не смешивающи-
еся с водой орг. растворители).
Разделение проводится в специальных гермети-
чески закрытых стеклянных камерах, которые
предварительно насыщаются парами подвижной
фазы. Подвижную фазу наливают на дно камеры.
Подвижная фаза движется вдоль матрицы в виде
фронта под действием капиллярных сил от линии
«старт» до линии «финиш».
Слайд 17 Относительная степень миграции компонента
разделяемой смеси характеризуется показателем
Rf (retention
factor):
L, пройденное веществом от старта
Rf =
L, пройденное растворителем от старта
до финиша
В стандартных условиях для конкретного компо-
нента смеси, Rf = consta. Это позволяет использо-
вать его значение для идентификации компонента
смеси на хроматограмме.
Разделение: пептидов, аминокислот, моно- и ди-
сахаридов, растительных пигментов.
Слайд 181.2. Тонкослойная хроматография
Стационарная фаза (адсорбент) – силикагель, крахмал,
окись алюминия,
порошок целлюлозы, нанесенные на сте-
кло или плотную алюминиевую фольгу.
Подвижная фаза
– смесь 2-х и более орг. растворителей,
включая воду.
Техника разделения – сходна с хроматографией
на бумаге.
Аналитические цели – толщина слоя: доли мм.
Препаративный вариант – толщина слоя до 5 мм.
Преимущества перед ХГ на бумаге:
быстрота
шире возможности (большой выбор сорбентов)
высокая разрешающая способность
Разделение: пептиды, аминокислоты, НК, алкалоиды, сте-
роиды, сахара, ЖК, ФЛ, ТАГ, витамины, каротиноиды и др.
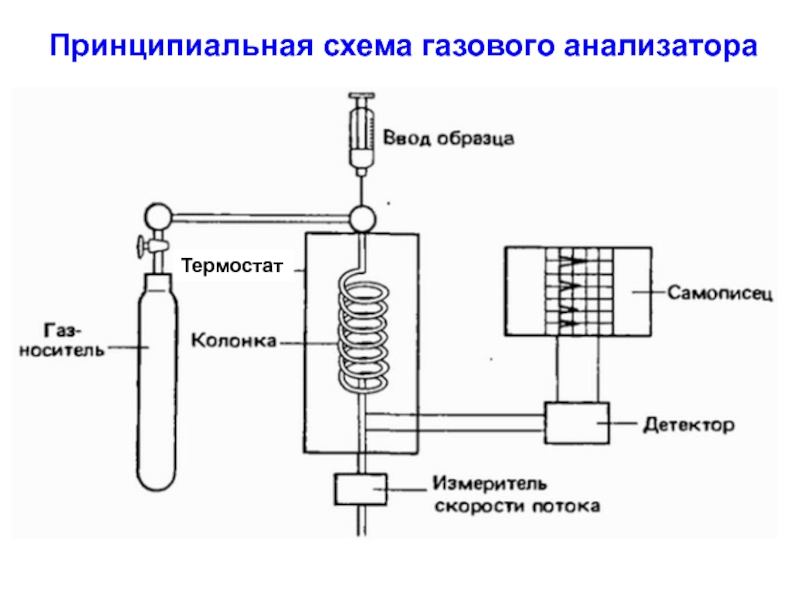
Слайд 191.3. Газо-жидкостная хроматография
Стационарная фаза – жидкость (силиконовая смазка) на
внутренней поверхности
тонкой металлической трубки
(длина 30 – 100 м). Эта фаза должна
быть химически
нейтральна по отношению к разделяемой смеси.
Подвижная фаза – инертные газы-носители (аргон, азот).
Смесь перед подачей в колонку нагревают до парообразно-
го состояния и вдоль колонки идет смесь пары+газ носи-
тель. Нелетучие вещества предварительно превращают в
летучие путем метилирования, ацилирования, алкилирова-
ния и т.д. По всей длине колонки поддерживается темпера-
тура, при которой смесь остается в виде паров. В связи с
этим, анализу могут подвергаться только те вещества,
которые не разрушаются при нагревании и переходе в
парообразное состояние.
Слайд 20Принципиальная схема газового анализатора
Термостат
Слайд 21
Достоинства газо-жидкостной хроматогра-
фии:
высокая разрешающая способность
высокая чувствительность (обнаружение ве-
ществ в концентрации до 10-12 г.)
сравнительно высокая скорость анализа
метод высокоэффективен для решения как
аналитических, так и препаративных задач
(высокая степень очистки).
Разделение: стероиды, барбитураты, ЖК, эфиры, спирты, амины, ароматические соедине-ния, углеводы, стероиды и т.д.
Слайд 222. Проникающая хроматография
синонимы: гель-ХГ, гель-фильтрация (не путать с ультафильтрацией), молекулярно-ситовая
ХГ.
В основе принципа разделения компонентов смеси – эф-
фект «молекулярного сита».
Стационарная фаза пред-
ставляет собой пористый материал: органические поли-
меры с 3D – сетчатой структурой. Обязательное условие –
стационарная и подвижная фазы должны быть химически
и биологически нейтральны по отношению к компонентам
разделямой смеси.
«Молекулярное сито» - компоненты смеси, в зависимости
от своих размеров, либо проникают внутрь 3D–сетчатой
структуры (гранулы) и удерживаются там некоторое вре-
мя, либо свободно двигаются по пространству между гранул, увлекаемые потоком подвижной фазы.
Слайд 23Стационарная фаза – вода, прочно связанная с поверх-
ностью гидрофильных волокон
органических полимеров,
образующих 3D – сетчатую структуру (гранулу). Эта вода
образует гидратную
оболочку на поверхности волокон.
Подвижная фаза – вода или буфер, которые заполняют
пространство вне гранул, эта фаза постоянно движется с
заданной скоростью.
Т.о. вода (буфер) – и стационарная, и подвижная фазы.
Связанная вода (в составе гидратной оболочки волокон),
никогда не перемешивается с водой подвижной фазы.
Фактор, определяющий возможность разделения компо-
нентов смеси – соотношение размеров молекул компонен-
тов смеси и размера пор, через которые внутренний
объем гранул сообщается с внешним пространством.
Слайд 24
Материалы для стационарной фазы:
гель на основе декстрана
(«Sephadex»)
гель на основе агарозы («Sepharose»)
гель полиакриламидный (ПААГ), «Биогель»
и др.
Достоинства гель-хроматографии:
- эффективность разделения смеси белков не зависит от
рН, То, ионной силы буфера, химического состава буфе-
ра и др. условий
отсутствие адсорбции компонентов смеси на волокнах
стационарной фазы и взаимодействия эл. зарядов.
Применение:
высокая степень разделения и очистки белков и нукле-
иновых кислот с сохранением их нативных свойств
- концентрирование растворов белков
точное определение молекулярной массы белков на ос-
нове зависимости элюционного объема и lg мол. массы.
Слайд 253. Адсорбционная хроматография
Стационарная фаза – твердый сорбент (может обладать
пористой поверхностью):
кремневая кислота, окиси К и
Mg, карбонаты Сa и Zn,
силикагель и др.
Подвижная фаза – как правило, различные орг. раство-
рители.
При адсорбции, молекулы из разделяемой смеси
притягиваются к поверхности адсорбента за счет
их химического сродства. Это не случай электро-
статического притяжения к поверхности адсор-
бента молекул, имеющих с ним разноименные
заряды.
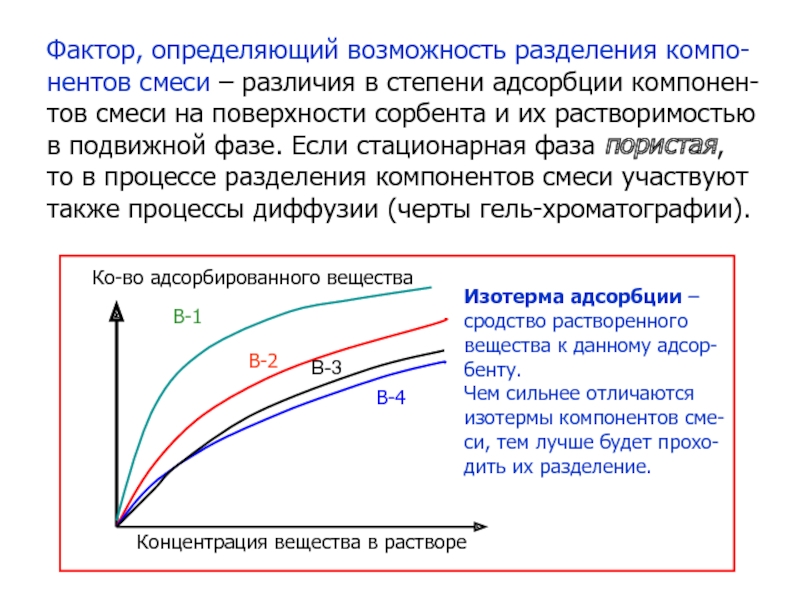
Слайд 26Фактор, определяющий возможность разделения компо-
нентов смеси – различия в степени
адсорбции компонен-
тов смеси на поверхности сорбента и их растворимостью
в
подвижной фазе. Если стационарная фаза пористая,
то в процессе разделения компонентов смеси участвуют
также процессы диффузии (черты гель-хроматографии).
Ко-во адсорбированного вещества
Концентрация вещества в растворе
Изотерма адсорбции –
сродство растворенного
вещества к данному адсор-
бенту.
Чем сильнее отличаются
изотермы компонентов сме-
си, тем лучше будет прохо-
дить их разделение.
В-1
В-2
В-4
В-3
Слайд 27Разделение проводят в стеклянных колонках,
которые, в зависимости от целей,
могут иметь
разное соотношение высоты и внутреннего диа-
метра («геометрия хроматографической ко-
лонки»):
1.
Для очистки белков (макромолекул) от низко-
молекулярных примесей требуется H/D < 10:1
2. Для разделения смеси белков (хроматографи-
ческое фракционирование) требуется
H/D = 100 : 1
Разделение: стерины, белки, аминокислоты,
пептиды, углеводы, нуклеиновые кислоты и др.
Слайд 284. Ионообменная хроматография
Обязательное условие для разделения компонентов смеси
с помощью
данного вида хроматографии – наличие у них
электрического заряда. Удержание отдельных
компонентов
смеси на стационарной фазе идет благодаря электроста-
тическому притяжению разноименных зарядов.
Стационарная фаза – твердый носитель (3D-сетчатая
матрица: декстран, целлюлоза и др.), содержащий на по-
верхности заряженные группы – ионогенные группы.
Если матрица несет –q, то это катионообменник ( R-SO3-);
если имеет +q, то это анионообменник: R-N+(CH3)3.
Подвижная фаза – водная: буферы с изменяемым рН или с добавлениями солей для регулируемого изменения ионной силы.
Слайд 29Примеры ионообменников:
на основе декстрана «сефадекс», которые могут
быть катионо-
и анионоообменниками.
на основе целлюлозы: катионообменник – кар-
боксиметилцеллюлоза (КМ-целлюлоза);
анионо-
обменник – диэтиламиноэтил целлюлоза
(ДЭАЭ-целлюлоза).
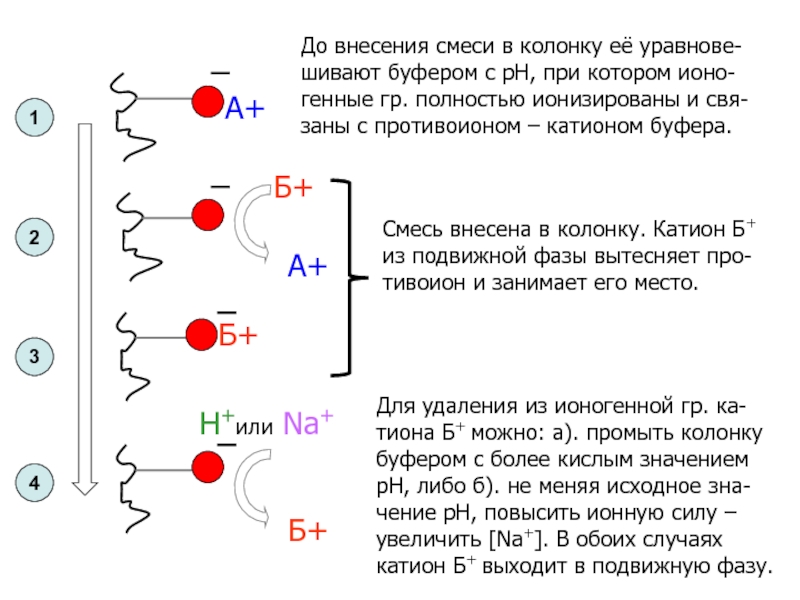
Слайд 30
А+
Б+
А+
Б+
Б+
До внесения смеси в колонку её уравнове-
шивают буфером с рН,
при котором ионо-
генные гр. полностью ионизированы и свя-заны с противоионом
– катионом буфера.
Смесь внесена в колонку. Катион Б+
из подвижной фазы вытесняет про-
тивоион и занимает его место.
Н+или Na+
Для удаления из ионогенной гр. ка-
тиона Б+ можно: а). промыть колонку
буфером с более кислым значением
рН, либо б). не меняя исходное зна-
чение рН, повысить ионную силу –
увеличить [Na+]. В обоих случаях
катион Б+ выходит в подвижную фазу.
1
2
3
4
Слайд 31Разделение проводят в стеклянных колонках.
Разделение: белки, аминокислоты, сахара,
нуклеотиды и
др. молекулы, способные в
водном растворе нести электрические заряды.
Слайд 325. Аффинная хроматография
Разделение смеси БАВ происходит на основе
биоспецифичности: взаимодействие
антиген – антитело, рецептор – гормон, фермент – суб-страт.
Стационарная фаза
(матрица) – агароза, с которой ковалентно связан соответствующий лиганд. Выбор лиганда определяется биологическими свойствами биомолекул, подлежащих очистке.
Подвижная фаза – буфер, рН и ионная сила которого
обеспечивает оптимальные условия для связывания биомолекулы с лигандом.
Слайд 33Разделение проводят в хроматографической
колонке, заполненной матрицей, которая содер-
жит соответствующий лиганд.
Основные
этапы:
Заполнение колонки буфером, содержащим смесь ком-
понентов, в том
числе БАВ, который необходимо очис-
тить от примесей. В результате образуется комплекс:
лиганд-БАВ.
2. Колонку промывают другим буфером, что позволяет
удалить из колонки неспецифически адсорбирован-
ные примеси.
3. Колонку промывают третьим буфером, который содер-
жит хим. компоненты, облегчающие диссоциацию ком-
плекса лиганд-БАВ и выходу очищенного БАВ в под-
вижную фазу и далее – из колонки.
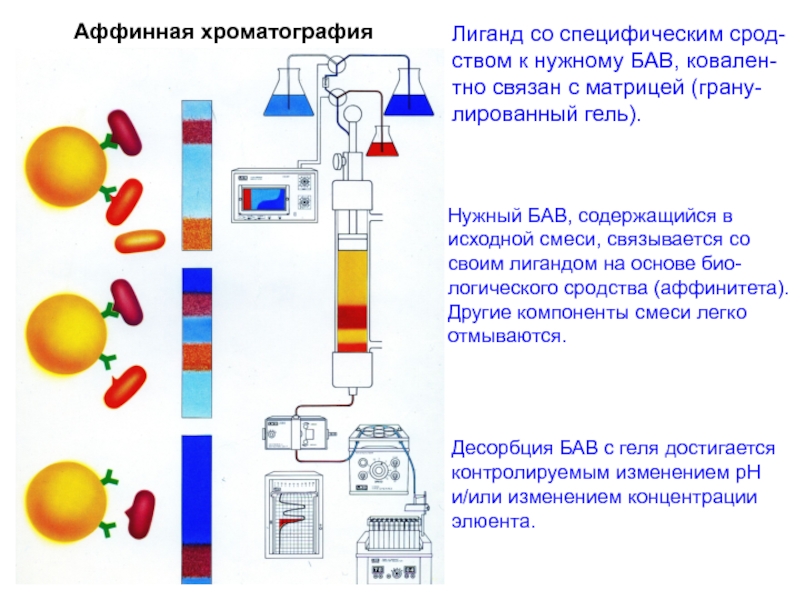
Слайд 34Аффинная хроматография
Лиганд со специфическим срод-
ством к нужному БАВ, ковален-
тно связан
с матрицей (грану-
лированный гель).
Нужный БАВ, содержащийся в
исходной смеси, связывается
со
своим лигандом на основе био-
логического сродства (аффинитета).
Другие компоненты смеси легко
отмываются.
Десорбция БАВ с геля достигается
контролируемым изменением рН
и/или изменением концентрации
элюента.
Слайд 35Применение: высокоэффективная очистка ферментов,
антител, антигенов, нуклеиновых кислот, гормонов и т.д.
В
целом ряде случаев, методу аффинной хроматографии
нет альтернативы. Степень очистки БАВ
с помощью дан-
ного типа хроматографии существенно выше, чем при
гель-хроматографии.
* * *