Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Занятие 6 Классификация простейших неорганических соединений. Свойства оксидов
Содержание
- 1. Занятие 6 Классификация простейших неорганических соединений. Свойства оксидов
- 2. ОКСИДЫ
- 3. Слайд 3
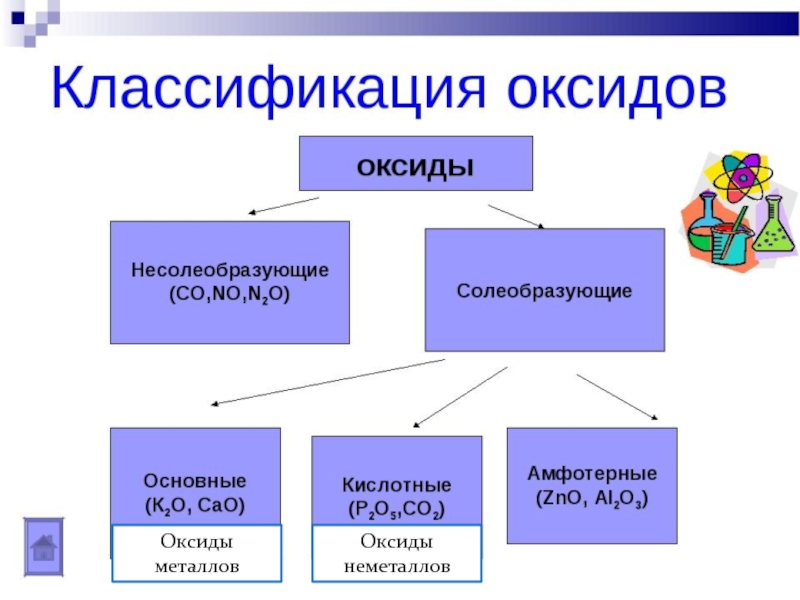
- 4. Классификация оксидовОксиды металловОксиды неметаллов
- 5. Слайд 5
- 6. Слайд 6
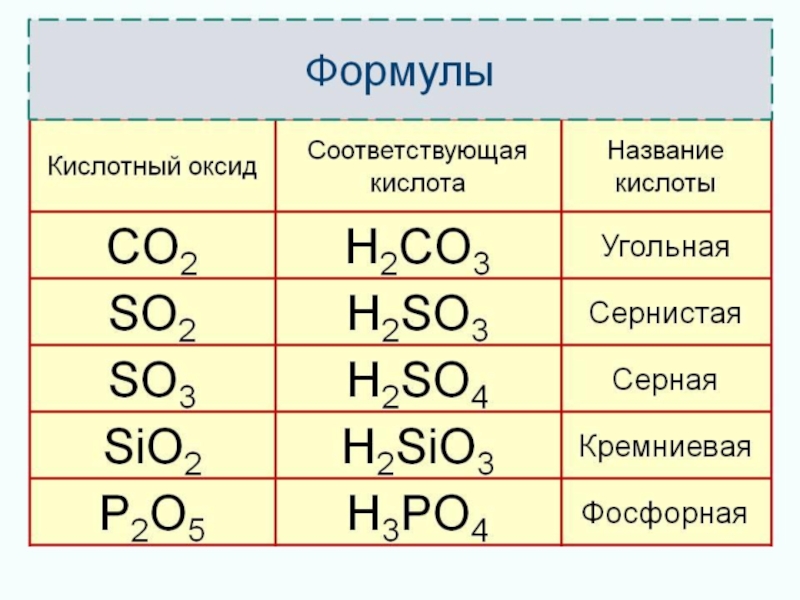
- 7. сернистаясернаяугольнаяфосфорнаякремневаяазотистаяазотнаяхромоваямарганцевая
- 8. Гидроксид натрия
- 9. Реакции оксидов с водой
- 10. Реакции оксидов с водой
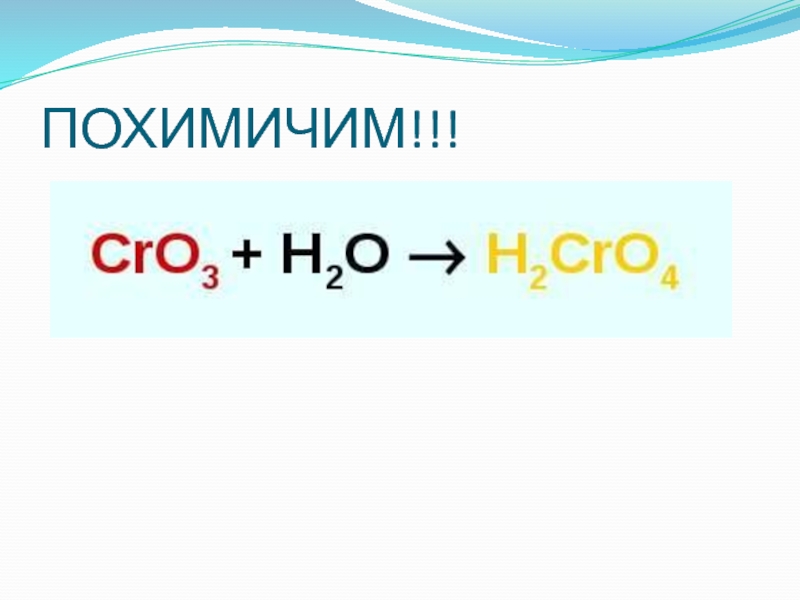
- 11. ПОХИМИЧИМ!!!
- 12. Другие характерные реакции оксидов. (кислотный О. + основный О.)
- 13. Дальнейшее окисление оксидов
- 14. Взаимодействие оксидов с кислотами/щелочами.
- 15. Взаимодействие оксидов с элементами
- 16. Кислоты и щёлочиБолее подробно свойства этих классов
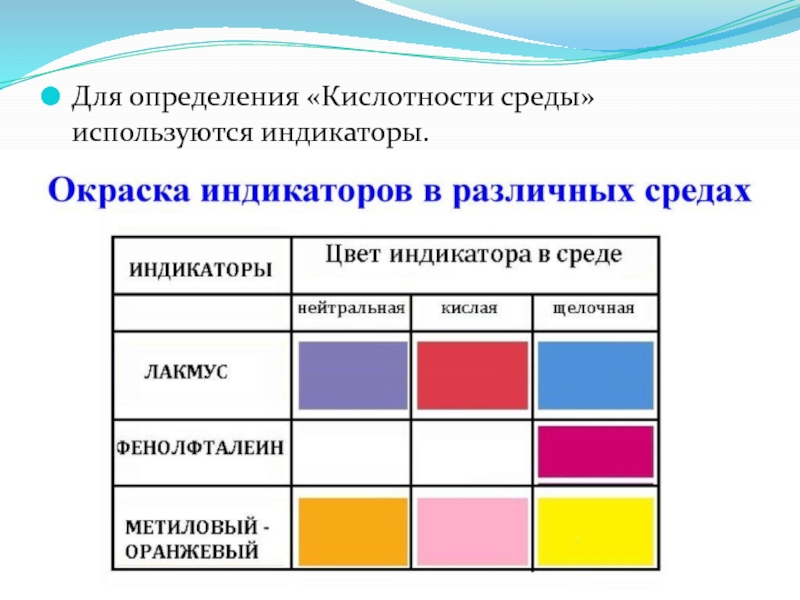
- 17. Для определения «Кислотности среды» используются индикаторы.
- 18. Получение солейРеакция нейтрализацииСоли можно получить, например, при взаимодействии кислот с щелочами (кислотно-основное взаимодействие).(тут будут примеры реакций)
- 19. ПОХИМИЧИМ!!!Посмотрим окраску индикаторов полученного раствора хромовой кислоты,
- 20. ВодаКроме реакций с оксидами с образованием щелочей
- 21. Слайд 21
- 22. ПОХИМИЧИМ!!!Посмотрим взаимодействие металлического натрия с водой, а также будем контролировать щелочность раствора фенолфталеином.
- 23. Пока что на этом всё…Переваривайте информацию, обязательно
- 24. Скачать презентанцию
ОКСИДЫ