Слайд 1ЖЕЛЕЗО
Формы нахождения в природе (по Ковде, 1985).
Железо, по геохимической
классификации, является типичным сидерофильным элементом
(типичным металлом). К числу таких
элементов также относятся и спутники железа в природе:
кобальт, никель, молибден и др. Эти элементы имеют химическое сродство:
к углероду (образуют карбонаты),
к фосфору (многочисленные фосфаты),
а также к сере и кремнию (сульфаты, сульфиды, силикаты).
Это вместе с тем элементы, образующие рудные жилы и месторождения.
Основные и ультраосновные (более тяжелые и более глубоко лежащие) магматические породы – базальты, перидотиты, диабазы – содержат от 5.8-9.8 до 12-16 % Fe.
Кислые изверженные породы – гнейсы, граниты – бедны Fe, его содержание в них 2.7-3.0%.
Остальные породы в среднем содержат также немного Fe – 3-4.5%, но в рудных месторождениях содержание железа достигает 20-40% и выше.
Почва в среднем содержит 3-4% Fe. Однако ожелезненные почвы и почвенные горизонты или конкреции содержат 15-20% и даже 40-60% Fe. В то же время известны песчаные почвы, которые имеют всего 0.8-1.5%железа, и известняки – около 0.5% Fe.
В железосодержащих минералах изверженных и метаморфических пород (силикаты, сидерит, пирит) оно находится в восстановленной двухвалентной форме.
В продуктах выветривания, в осадочных породах и в почвах Fe чаще присутствует в трехвалентной форме.
Общая эволюция растительности и образования кислородной атмосферы на Земле способствовали господству окислительных процессов и преобладанию окисленных форм железа. Но и в осадочных породах, в почвах и водоемах формирование восстановленных форм железа (и марганца) – весьма распространенное явление и, пожалуй, главный механизм мобилизации его геохимически подвижных форм.

Природные и антропогенные
источники железа.
При окислительном выветривании и почвообразовании образуются и накапливаются в
остаточных типах коры выветривания и в автоморфных почвах преимущественно окисные и
гидроокисные минералы трехвалентного железа. Они слаборастворимы и геихимически инертны.
В первичных изверженных породах минералы железа представлены:
силикатами, сидеритом (FeCO3), оливином (MgFeSiO4), биотитом [H4K2(MgFe)6Al2Si6O24], титанатами
(Fe2TiO5, FeTi, FeTiO3), пирротином (FeS), пиритом (FeS2). В основном железо здесь – в
двухвалентной форме.
В осадочных породах и почвах минералы железа унаследованы от исходных изверженных пород.
Но в почвах и осадочных породах всегда присутствуют, а в мелкоземе преобладают, - вторичные
минералы железа двухвалентной и трехвалентной форм. Таковы окислы гематит (Fe2O3), магнетит
(FeO·Fe2O3), меггематит (Fe2O3), гидроокислы (гетит - FeO·OH, лимонит – 2Fe2O3·3Н2О), сульфиды
железа, кислые железистые минералы феронатрит [Na3Fe(SO4)3·3H2O], ромерит и др.,
многочисленные фосфаты и силикаты железа, арсенаты железа. Существуют также органо-
железистые соединения (комплексы, хелаты), аморфные осадки гидроокислов, железо,
поглощенное коллоидами. Из этого перечня видно, что соединения железа чрезвычайно
многообразны и многочисленны.
Именно различные минералы и соединения железа и марганца обусловливают яркие окраски
различных почв: красную, желтоватую, оранжевую, темно-фиолетовую тропических; зеленоватую,
синеватую, сизую глеевых; черную и черно-синюю лечебных сероводородных грязей и
солончаков.

Слайд 3 Благодаря своим свойствам Fe в различных
формах широко вовлекается в индустриально-
хозяйственную деятельность человека и отличается высокой
технофильностью. Сейчас можно
говорить о процессах современного «ожелезнения» окружающей человека среды и почв.
В природную среду в процессе хозяйственной деятельности внесено > 10 млрд. т железо, из
которых > 60% было рассеяно в пространстве. По этим же данным (Сысуев В.В. Железо. В кн.:
Круговорот вещества в природе. М.: Изд-во МГУ, 1980, С. 118-131), ежегодно в окружающую среду
поступает в различной форме около 0.25 млрд. т железа.
Химические свойства Fe (по Глинке, 1978).
Из элементов восьмой группы периодической системы элементов нас интересуют - железо, кобальт и никель (есть еще - рутений, родий, палладий, осмий, иридий и платина).
Большинство элементов рассматриваемой группы имеют два электрона в наружном
электронном слое атома; все эти элементы представляют собой металлы. Кроме наружных
электронов, в образовании химических связей принимают участие также электроны из
Предыдущего недостроенного слоя. Для этих элементов характерны степени окисления 2,3,4.
Более высокие степени окисления проявляются реже.
Сравнение химических и физических свойств элементов восьмой группы показывает, что Fe,
Co, Ni очень сходны между собой и в то же время сильно отличаются от других элементов группы.
Поэтому их обычно выделяют в семейство железа (остальные шесть элементов выделяются в
группу платиновых металлов).
Чистое железо получают различными методами. Чаще всего используют метод разложения
пентакарбонила железа - Fe(CO)5. Во влажном воздухе железо быстро ржавеет, т.е. покрывается
бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не
защищает железо от дальнейшего окисления.

Слайд 4
В воде железо интенсивно корродирует; при
обильном доступе кислорода образуются
гидратные формы оксида железа (III):
2Fe + 3/2O2 + nH2O = Fe2O3nH2O
При недостатке кислорода или при его затрудненном доступе образуется смешанный оксид
Fe3O4 (или - FeOFe2O3):
3Fe + 2O2 + nH2O = Fe3O4nH2O
Железо растворяется в соляной кислоте любой концентрации:
Fe + 2HCl = FeCl2 + H2
Аналогично происходит растворение в разбавленной серной кислоте:
Fe + H2SO4 = FeSO4 + H2
В концентрированных растворах серной кислоты железо окисляется до Fe(III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
В разбавленных и умеренно концентрированных растворах азотной кислоты железо раств-ся:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Для железа характерны два ряда соединений:
соединения железа (II) и
соединения железа (III).
Первые отвечают оксиду железа (II), или закиси железа FeO;
вторые - оксиду железа (III), или окиси железа, Fe2O3.
Кроме того, известны соли железной кислоты H2FeO4, в которой степень окисления железа равна +6.
Слайд 5Соединения железа (II).
Соли железа (II) образуются при растворении железа
в разбавленных кислотах, кроме азотной.
Важнейшая из них - сульфат
железа, или железный купорос FeSO47Н2О, образующий светло-
зеленые кристаллы, хорошо растворимые в воде. На воздухе железный купорос постепенно
выветривается и одновременно окисляется с поверхности, переходя в желто-бурую основную
соль железа (III).
FeSO4 применяется для борьбы с вредителями растений, в производстве чернил и минеральных красок, при крашении тканей.
При нагревании железного купороса выделяется вода и получается белая масса безводной соли
FeSO4. При взаимодействии раствора соли железа (II) со щелочью выпадает белый осадок
гидроксида железа (II) Fe(OH)2, который на воздухе вследствие окисления быстро принимает
зеленоватую, а затем бурую окраску, переходя в гидроксид железа (III) Fe(OH)3:
4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
Карбонаты щелочных металлов осаждают из растворов солей железа (II) белый карбонат железа
(II) FeCO3. При действии воды, содержащей СО2, карбонат железа, подобно карбонату кальция,
частично переходит в более растворимую кислую соль Fe(HCO)3. В виде этой соли
(гидрокарбоната железа) железо содержится в природных железистых водах.
Соли железа (II) легко могут быть переведены в соли железа (III) действием различных
окислителей: азотной кислоты, перманганата калия, хлора, например:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO +4H2O
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Ввиду способности легко окисляться, соли железа (II) часто применяются как восстановители.

Слайд 6Соединения железа (III).
Хлорид железа (III)
FeCl3 представляет собой темно-коричневые с зеленоватым отливом
кристаллы. Это вещество
сильно гигроскопично; поглощая влагу из воздуха, оно превращается в
кристаллогидраты, содержащие различное количество воды и расплывающееся на воздухе. В
разбавленном растворе FeCl3 гидролизуется до основных солей (например, Fe(OH)2Cl).
Сульфат железа (III) Fe2(SO4)3 - очень гигроскопичные, расплывающиеся на воздухе белые
кристаллы. В водных растворах сульфат железа (III) сильно гидролизован. С сульфатами
щелочных металлов и аммония он образует двойные соли - квасцы, например, железоаммонийные
квасцы (NH4)Fe(SO4)212 H2O - хорошо растворимые в воде. Раствор Fe2(SO4)3 способен растворять
Cu2S и CuS с образованием сульфата меди; это используется при гидрометаллургическом
производстве меди.
При действии щелочей на растворы солей железа (III) выпадает красно-бурый гидроксид
железа Fe(OH)3, нерастворимый в избытке щелочи. Гидролизом объясняется цвет растворов солей
железа (III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в
желто-бурый цвет, что объясняется присутствием гидроксионов железа или молекул Fe(OH)3,
которые образуются благодаря гидролизу:
Fe3+ + H2O FeOH2+ + H+
FeOH2+ + H2O Fe(OH)2+ + H+
Fe(OH)2+ + H2O Fe(OH)3 + H+
При прокаливании гидроксид железа (III), теряя воду, переходит в оксид железа (III), или окись
железа, Fe2O3. Оксид железа (III) встречается в природе в виде красного железняка и применяется
как коричневая краска - железный сурик, или мумия.

Слайд 7Соединения железа в почвах и природных водах(по Ковде, 1985).
Педохимическая
судьба соединений железа (а также марганца и алюминия) в значительной
степени зависит от:
условий увлажнения,
реакции среды,
аэрированности почвы и величины Eh,
условий разложения органического вещества и
деятельности микроорганизмов.
Восстановление железа (и марганца) наступает при Eh от +400 до +100 мВ. При отрицательных
величинах Eh происходит восстановление сульфатов, нитратов и образование сульфидов, метана,
водорода (табл.1).
Слайд 8
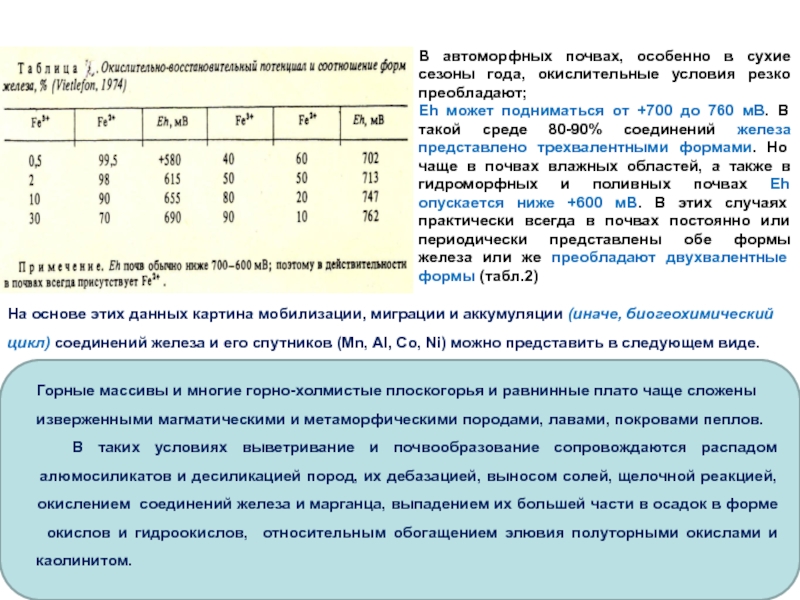
В автоморфных почвах, особенно в сухие сезоны года, окислительные условия
резко преобладают;
Eh может подниматься от +700 до 760 мВ.
В такой среде 80-90% соединений железа представлено трехвалентными формами. Но чаще в почвах влажных областей, а также в гидроморфных и поливных почвах Eh опускается ниже +600 мВ. В этих случаях практически всегда в почвах постоянно или периодически представлены обе формы железа или же преобладают двухвалентные формы (табл.2)
На основе этих данных картина мобилизации, миграции и аккумуляции (иначе, биогеохимический
цикл) соединений железа и его спутников (Mn, Al, Co, Ni) можно представить в следующем виде.
Горные массивы и многие горно-холмистые плоскогорья и равнинные плато чаще сложены
изверженными магматическими и метаморфическими породами, лавами, покровами пеплов.
В таких условиях выветривание и почвообразование сопровождаются распадом
алюмосиликатов и десиликацией пород, их дебазацией, выносом солей, щелочной реакцией,
окислением соединений железа и марганца, выпадением их большей части в осадок в форме
окислов и гидроокислов, относительным обогащением элювия полуторными окислами и
каолинитом.
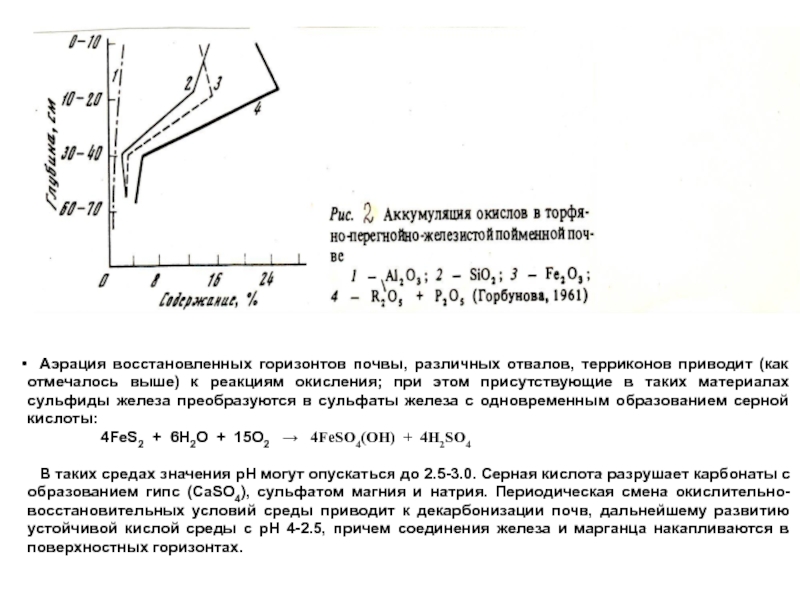
Слайд 9 Во влажных субтропиках и тропиках дебазация и десиликация
горных пород и почв приводит к
образованию кислых остаточных фералитных
и аллитных кор выветривания и почв (красноземы,
бокситы), которые обогащены остаточными формами окисленных соединений железа, марганца,
титана, алюминия.
В холодных лесных областях их аналогом являются кислые бурые почвы. Эрозия и
переотложение смытого ферсиаллитного (содержащего Fe, Si, Al), аллитного и фераллитного
мелкоземного материала приводят к образованию склонового делювия, пролювия, аллювия
речных террас, также обогащенных окислами и гидроокислами Fe, Mn, Al и закрытых покровом
фералитных и аллитных почв (бурых лесных, красноземов, бокситов) с возможными признаками
литологической слоистости.
Но этот сравнительно простой процесс осложнен крайней неустойчивостью окислов железа,
марганца, алюминия, обусловленной растущей кислотностью среды, присутствием в почвах
органических веществ, повышенной влажностью, анаэробностью и деятельностью
микроорганизмов. Известно, что в этих условиях, особенно в теплый сезон, периодически или
постоянно возникают резко восстановительные условия среды; при этом железо (и марганец)
переходит в двухвалентные формы, возникают активные геохимические миграции в виде
хелатных соединений, бикарбонатов (НСО3+) и, возможно даже сульфидов и сульфатов.
С водными потоками делювиальных, внутрипочвенных грунтовых вод геохимически активные
соединения железа (а также Mn и Al) мигрируют в нисходящем и горизонтально-боковом
направлении по склонам, в низменности, поймы, дельты и устья рек, в озера, моря, океан. Смены
теплового и окислительно-восстановительного режимов, доступ кислорода, транспирация и
испарение влаги, минерализация органики, деятельность железобактерий неизбежно ведут к
осаждению значительной части подвижных соединений Fe, Mn, Al в транзитных и особенно в
аккумулятивных ландшафтах.

Слайд 10
Этим путем образуются ожелезненные иллювиальные горизонты почв, ортзанды, горизонты
конкреций полуторных окислов, ортштейны, железисто-гумусовые прослои и хардпены,
железистые погребенные древние горизонты в толще склоновых почв, латеритные горизонты
в низменностях, пойменных и надпойменных отложениях. Этим же путем образуются
болотные луговые железистые руды в депрессиях, низменностях, торфяниках.
Существенная часть геохимических мигрантов уносится подземными водами в океан.
Многими исследованиями показано, что решающая роль в мобилизации и миграции
соединений железа принадлежит фульвокислотам. Fe, Mn, Al образуют с фульвокислотами
подвижные, активно мигрирующие в пространстве комплексные соединения. Так,
фульвокислоты на 1 г углерода могут связывать несколько сот мг железа в виде хелатных
соединений, мигрирующих на значительные расстояния (Лукашев К.И. Краткий очерк состояния четвертичных (антропогеновых) отложений Белоруссии. Минск: Изд-во АН БССР, 1969).
Например, сезонное или постоянное заболачивание в почвах средней тайги сопровождается
образованием комплексных Fe-органических соединений (с дубильными веществами и
низкомолекулярными кислотами), которые могут свободно передвигаться как в нисходящем,
так и в боковом горизонтальном и восходящем направлениях.
Таким образом, общая биогеохимическая направленность истории и миграции железа (и марганца) на поверхности земной коры включает: генерирование подвижных соединений, их транспорт и накопление в транзитных и аккумулятивных ландшафтах.

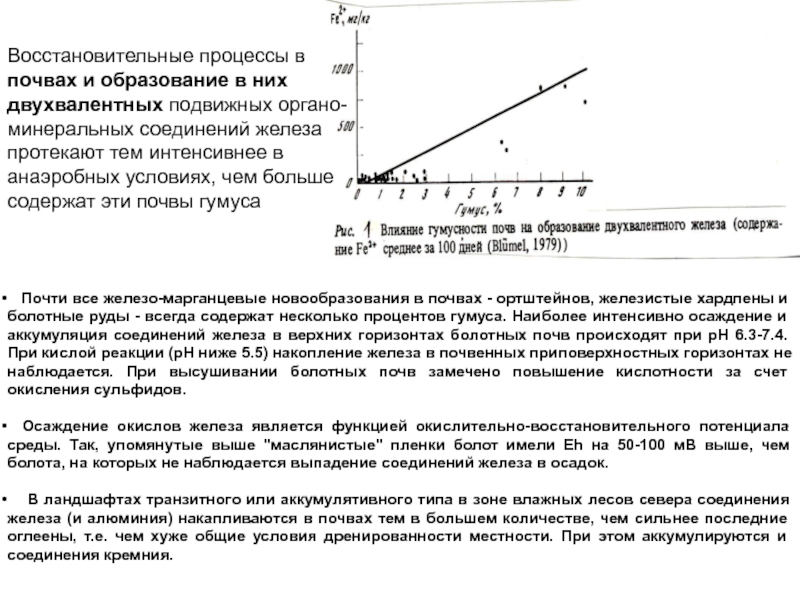
Слайд 11Восстановительные процессы в
почвах и образование в них двухвалентных подвижных
органо-минеральных соединений железа протекают тем интенсивнее в анаэробных условиях, чем
больше содержат эти почвы гумуса
Почти все железо-марганцевые новообразования в почвах - ортштейнов, железистые хардпены и болотные руды - всегда содержат несколько процентов гумуса. Наиболее интенсивно осаждение и аккумуляция соединений железа в верхних горизонтах болотных почв происходят при рН 6.3-7.4. При кислой реакции (рН ниже 5.5) накопление железа в почвенных приповерхностных горизонтах не наблюдается. При высушивании болотных почв замечено повышение кислотности за счет окисления сульфидов.
Осаждение окислов железа является функцией окислительно-восстановительного потенциала среды. Так, упомянутые выше "маслянистые" пленки болот имели Eh на 50-100 мВ выше, чем болота, на которых не наблюдается выпадение соединений железа в осадок.
В ландшафтах транзитного или аккумулятивного типа в зоне влажных лесов севера соединения железа (и алюминия) накапливаются в почвах тем в большем количестве, чем сильнее последние оглеены, т.е. чем хуже общие условия дренированности местности. При этом аккумулируются и соединения кремния.
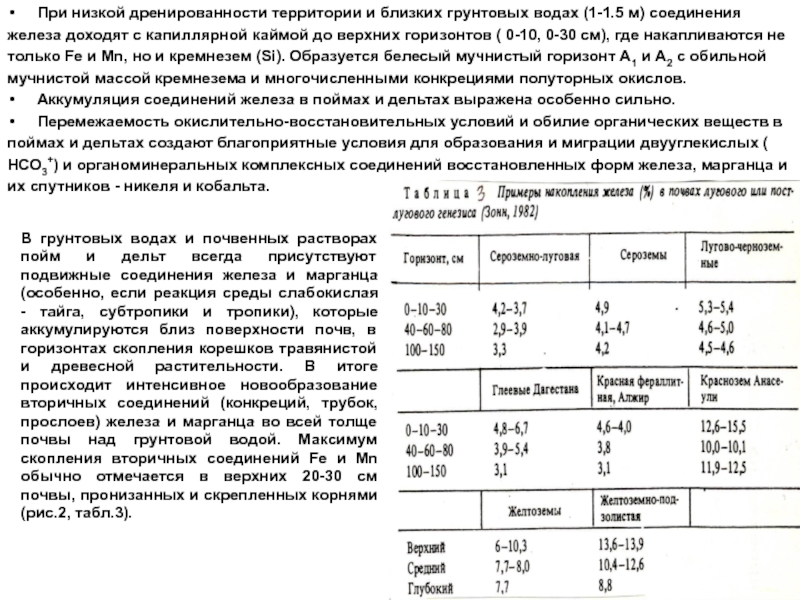
Слайд 12При низкой дренированности территории и близких грунтовых водах (1-1.5 м)
соединения
железа доходят с капиллярной каймой до верхних горизонтов ( 0-10,
0-30 см), где накапливаются не
только Fe и Mn, но и кремнезем (Si). Образуется белесый мучнистый горизонт А1 и А2 с обильной
мучнистой массой кремнезема и многочисленными конкрециями полуторных окислов.
Аккумуляция соединений железа в поймах и дельтах выражена особенно сильно.
Перемежаемость окислительно-восстановительных условий и обилие органических веществ в
поймах и дельтах создают благоприятные условия для образования и миграции двууглекислых (
НСО3+) и органоминеральных комплексных соединений восстановленных форм железа, марганца и
их спутников - никеля и кобальта.
В грунтовых водах и почвенных растворах пойм и дельт всегда присутствуют подвижные соединения железа и марганца (особенно, если реакция среды слабокислая - тайга, субтропики и тропики), которые аккумулируются близ поверхности почв, в горизонтах скопления корешков травянистой и древесной растительности. В итоге происходит интенсивное новообразование вторичных соединений (конкреций, трубок, прослоев) железа и марганца во всей толще почвы над грунтовой водой. Максимум скопления вторичных соединений Fe и Mn обычно отмечается в верхних 20-30 см почвы, пронизанных и скрепленных корнями (рис.2, табл.3).
Слайд 13 Аэрация восстановленных горизонтов почвы, различных отвалов, терриконов приводит (как
отмечалось выше) к реакциям окисления; при этом присутствующие в таких
материалах сульфиды железа преобразуются в сульфаты железа с одновременным образованием серной кислоты:
4FeS2 + 6H2O + 15O2 4FeSO4(OH) + 4H2SO4
В таких средах значения рН могут опускаться до 2.5-3.0. Серная кислота разрушает карбонаты с образованием гипс (CaSO4), сульфатом магния и натрия. Периодическая смена окислительно-восстановительных условий среды приводит к декарбонизации почв, дальнейшему развитию устойчивой кислой среды с рН 4-2.5, причем соединения железа и марганца накапливаются в поверхностных горизонтах.