Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПЕЧЕНИ У ДЕТЕЙ
Содержание
- 1. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПЕЧЕНИ У ДЕТЕЙ
- 2. Опухоли печени у детей редки. Их диагностика может
- 3. Исторически сложилось, что четыре основные исследовательские группы
- 4. Основной целью лечения пациентов с раком печени
- 5. Использование высококачественной поперечной визуализации для оценки детей
- 6. ГАДОЛИНИЙО гадолинии как о материале современной технологии
- 7. Гадолиний (новолат. Gadolinium), Gd — химический элемент III группы периодической системы Менделеева, атомный номер — 64, атомная масса — 157,25. Относится к лантаноидам.
- 8. Гадолиний -153 используется в качестве источника излучения в
- 9. Ежегодная заболеваемость гепатобластомой в Соединенных Штатах, удвоилась:
- 10. По данным японских учёных, риск развития гепатобластомы
- 11. ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПАТОБЛАСТОМЫСиндром Айкарди Синдром Беквита-Видемана
- 12. ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПАТОБЛАСТОМЫМладенцы с низкой массой
- 13. Синдром Беквита — ВидеманаСиндром Беквита — Видемана (англ.
- 14. Синдром АйкардиСиндром Айкарди (Aicardi syndrom) - это
- 15. Синдром Симпсона-Голаби-БемеляСиндром Симпсона-Голаби-Бемеля представляет собой редкий синдром
- 16. Синдром Симпсона-Голаби-БемеляХарактеризуется пре- и постнатальным гигантизмом с
- 17. Синдром Симпсона-Голаби-БемеляВовлечение центральной нервной системы включает в
- 18. Синдром Эдвардса (синдром трисомии 18)) Синдром Эдвардса (синдром трисомии 18) —характеризуется
- 19. Синдром Эдвардса (синдром трисомии 18))Дети с трисомией 18
- 20. Синдром Эдвардса (синдром трисомии 18))Ушные раковины деформированы и
- 21. Синдром Эдвардса (синдром трисомии 18))Из дефектов внутренних органов
- 22. Скрининг детей, предрасположенных к гепатобластоме Скрининг детей,
- 23. ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМАЕжегодная заболеваемость гепатоцеллюлярной карциномой в Соединенных
- 24. В некоторых азиатских странах заболеваемость гепатоцеллюлярной карциномой
- 25. ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫСиндром Алагилля
- 26. ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПАТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫПрогрессирующий семейный
- 27. ДИАГНОСТИКААналогичная диагностике гепатобластомы
- 28. ПРОГНОЗ И ПРОНОСТИЧЕСКИЕ ФАКТОРЫ Общая 5-летняя выживаемость
- 29. ПРИНЦИПЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПЕЧЕНИ У ДЕТЕЙХирургияИсторически
- 30. Ортотопическая пересадка печени Ортотопическая пересадка печениПересадки печени
- 31. ХимиотерапияХимиотерапия гораздо более успешна в лечении гепатобластомы,
- 32. Радиационная терапияЛучевая терапия, даже в сочетании с
- 33. Конформная лучевая терапия ─ радиационное воздействие на
- 34. Современные технологии радиотерапии используют большие суммарные дозы
- 35. Одними из основных методов комформной терапии является
- 36. RapidArc – технология для проведения лучевой терапии
- 37. Технологии IMRT или IGRT требуют как минимум
- 38. Сокращение при использовании RapidArc – технологии времени
- 39. Другие подходы к лечению Другие подходы к
- 40. Трансартериальная химиоэмболизацияКлассическая методика лечения больного со злокачественным
- 41. Трансартериальная химиоэмболизацияЭффективность системной химиотерапии при неоперабельном поражении
- 42. Трансартериальная химиоэмболизацияВ последнее время в лечении больных
- 43. Трансартериальная химиоэмболизацияВ ряде случаев регионарная внутриартериальная химиотерапия
- 44. Трансартериальная химиоэмболизацияРазвитие химиоэмболизации можно разделить на три
- 45. Трансартериальная химиоэмболизацияII. В 80-е годы прошлого столетия
- 46. Трансартериальная химиоэмболизацияIII. Новым этапом развития метода химиоэмболизации
- 47. Трансартериальная химиоэмболизацияМикросферы DC Bead являются первыми пренасыщенными
- 48. Трансартериальная химиоэмболизацияПри использовании микросфер в опухоли достигается
- 49. Трансартериальная химиоэмболизацияЧрезкатетерная артериальная химиоэмболизация позволяет использовать широкий
- 50. Трансартериальная химиоэмболизацияТаким образом, при химиоэмболизации решается несколько
- 51. Трансартериальная химиоэмболизацияПроцедура химиоэмболизации ветвей печеночной артерии включает
- 52. Трансартериальная химиоэмболизацияДля выполнения, так называемой масляной химиоэмболизации
- 53. Трансартериальная химиоэмболизация Масляную химиоэмболизацию дополняют механической окклюзией
- 54. Трансартериальная химиоэмболизацияВ качестве химиопрепарата используют Доксорубицин 50–100
- 55. Трансартериальная химиоэмболизацияЭффективность процедуры оценивают по критериям RECIST
- 56. Трансартериальная химиоэмболизацияНаиболее часто (у 60 — 80%
- 57. Трансартериальная химиоэмболизацияОпасные осложнения TACE включают поражение здоровых тканей печени
- 58. Трансартериальная химиоэмболизацияХимиоэмболизация: противопоказанияСуществует множество относительных противопоказаний для проведения процедуры
- 59. Трансартериальная химиоэмболизацияХотя TACE повсеместно используется в качестве
- 60. А). Состояние печени через 1 месяц после
- 61. А). Состояние печени до лечения. В обеих
- 62. РАДИОЭМБОЛИЗАЦИЯ — регионарная внутриартериальная радиотерапияприменение дистанционной лучевой
- 63. Радиоэмболизация липиодолом, содержащим иод-131 (131I)Имеется незначительное число
- 64. Радиоэмболизация микросферами, содержащими иттрий-90 (90Y) Радиоэмболизация, использующая
- 65. Радиоэмболизация микросферами, содержащими иттрий-90 (90Y) Считается, что
- 66. Применение радиоэмболизации Если при нерезектабельном первичном раке
- 67. Применение радиоэмболизации В то же время селективная
- 68. Применение радиоэмболизации Относительные противопоказания включают ограниченный объём
- 69. Радиоэмболизация: осложненияОсложнения, встречающиеся после радиоэмболизации, включают умеренные
- 70. Благодарю за внимание!
- 71. Скачать презентанцию
Опухоли печени у детей редки. Их диагностика может быть весьма сложной, отчасти из-за отсутствия консенсуса в отношении системы классификации данного вида ЗНО в детской и подростковой популяциях.
Слайды и текст этой презентации
Слайд 3Исторически сложилось, что четыре основные исследовательские группы (Международная стратегическая группа
по детским опухолям печени [ранее известная как Société Internationale d'Oncologie
Pédiatrique – Исследовательская группа по эпителиальным опухолям печени (SIOPEL)], Детская онкологическая группа [COG], Gesellschaft für Pädiatrische Onkologie und Hämat для детской онкологии и гематологии] и Японская исследовательская группа по опухолям печени у детей) имели различные категории классификации, что затрудняло сравнение результатов на разных континентах. Все группы в настоящее время используют системы группирования PRE-Treatment EXTent of disease (PRETEXT) и POST-Treatment EXTent of disease (POSTTEXT) как cоставных частей классификации.Слайд 4Основной целью лечения пациентов с раком печени является хирургическое удаление
первичной опухоли. Планирование объема операции в значительной степени зависит от факторов,
определяемых данными визуализации опухоли, а также а также с признаками опухоли по PRETEXT. Эти результаты визуализации называются ещё факторами аннотации .Слайд 5Использование высококачественной поперечной визуализации для оценки детей с гепатобластомой имеет
первостепенное значение, поскольку стратификация риска, определяющая лечение, во многом зависит
от визуального анализа. Для визуализации используются трехфазная компьютерная томография (неконтрастная, артериальная и венозная) иили магнитно-резонансная томография (МРТ) с контрастными веществами. МРТ с гадоксетатом динатрием, контрастным веществом на основе гадолиния, который преимущественно поглощается и выделяется гепатоцитами, используется с большей частотой и может улучшить обнаружение многоочагового заболеванияСлайд 6ГАДОЛИНИЙ
О гадолинии как о материале современной технологии рассказывать можно довольно
долго, ибо этот элемент постоянно открывает все новые и новые
области своего применения, и в немалой степени это обусловлено не только особыми ядерно-физическими свойствами, но и технологичностью. Основными областями применения гадолиния являются медицина, электроника и ядерная энергетика.Слайд 7Гадолиний (новолат. Gadolinium), Gd — химический элемент III группы периодической системы Менделеева, атомный номер — 64, атомная масса — 157,25. Относится к лантаноидам.
Слайд 8Гадолиний -153 используется в качестве источника излучения в медицине для диагностики
остеопороза. Хлорид гадолиния применяется для блокады клеток Купфера при лечении
печени.Контрастный препарат гадодиамид (торговая марка «Омнискан») также содержит гадолиний. Контрастный препарат представляет раствор его водорастворимой соли, который вводится внутривенно и накапливается в областях с повышенным кровоснабжением (например, злокачественных опухолях). Из-за содержания редкоземельных элементов контрастное вещество относительно дорогое. Ряд МРТ-исследований неинформативен без контрастного усиления. Первое парамагнитное контрастное вещество было создано фирмой «Байер» в 1988 году
Слайд 9Ежегодная заболеваемость гепатобластомой в Соединенных Штатах, удвоилась: с 0,8 (1975–1983)
до 1,6 (2002–2009) случаев на 1 миллион детей в возрасте
19 лет и младше. Причина этого увеличения неизвестна, но этому может способствовать увеличение выживаемости недоношенных детей с очень низкой массой тела при рождении, которое, как известно, связано с гепатобластомой.Слайд 10По данным японских учёных, риск развития гепатобластомы у детей, которые
весили менее 1000 г при рождении, в 15 раз выше
риска для детей с нормальной массой тела при рождении. Другие данные так же подтверждают высокий уровень заболеваемости гепатобластомой у недоношенных детей с очень низкой массой тела при рождении. Причина данного феномена, к сожалению, пока не объяснима.Возраст возникновения рака печени у детей связан с гистологией опухоли. Гепатобластомы обычно возникают в возрасте до 3 лет, и примерно 90% злокачественных опухолей печени у детей в возрасте 4 лет и младше являются гепатобластомами .
Слайд 11ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПАТОБЛАСТОМЫ
Синдром Айкарди
Синдром Беквита-Видемана
Гемигиперплазия (гемигипертрофия)
Семейный аденоматозный
полипоз
Болезни накопления гликогена I – IV типов
Слайд 12ФАКТОРЫ РИСКА РАЗВИТИЯ ГЕПАТОБЛАСТОМЫ
Младенцы с низкой массой тела при рождении
Синдром Симпсона-Голаби-Бемеля
Трисомия 18, а также другие трисомии
Слайд 13Синдром Беквита — Видемана
Синдром Беквита — Видемана (англ. BWS — Beckwith-Wiedemann-Syndrom, EMG
— Exomphalos-Makroglossie-Gigantismus, также синдром «гигантизма с пуповинной грыжей») — одна из
редких генетических аномалий, связана с превышением норм роста плода при беременности и с несогласованным развитием различных отделов организма.Типичными признаками синдрома являются увеличенные размер и вес плода (новорождённого ребёнка), причем происходят не только асимметричный рост организма и внешние отклонения в размерах тела, но и непропорционально большой размер некоторых внутренних органов: печени, селезёнки, почек и языка
Слайд 14Синдром Айкарди
Синдром Айкарди (Aicardi syndrom) - это редкое генетическое заболевание,
характеризующееся агенезией мозолистого тела, эпилептическими приступами по типу инфантильных спазмов
с ранним дебютом, специфическими лакунарными изменениями на глазном дне, типичными изменениями на ЭЭГ (паттерн "расщепленного мозга"), задержкой психомоторного развития, а также лицевым дизморфизмом.Слайд 15Синдром Симпсона-Голаби-Бемеля
Синдром Симпсона-Голаби-Бемеля представляет собой редкий синдром X-сцепленных множественных врожденных
аномалий, характеризующийся пре- и постнатальным гигантизмом, характерными черепно-лицевыми особенностями, разнообразными
врожденными аномалиями, органомегалией и повышенным риском развития опухолей.Синдром Симпсона-Голаби-Бемеля имеет широкую клиническую картину с различной степенью тяжести.Слайд 16Синдром Симпсона-Голаби-Бемеля
Характеризуется пре- и постнатальным гигантизмом с макросомией, характерными черепно-лицевыми
особенностями (макроцефалия с грубыми чертами лица, макроглоссия, гипертелоризм, зубочелюстная недостаточность,
небные аномалии), добавочные соски, врожденные пороки сердца и аритмия, сегментные дефекты позвонков, висцеромегалия (почечная дисплазия/нефромегалия, спленомегалия и гепатомегалия), диафрагмальная грыжа, диастаз прямой мышцы живота/пупочная грыжа, аномалии конечностей (полидактилия/брахидактилия, кожная синдактилия, гипоплазия ногтей) и участие крипторхизм, гипоспадия.Слайд 17Синдром Симпсона-Голаби-Бемеля
Вовлечение центральной нервной системы включает в себя различную степень
умственной неполноценности, задержки двигательного и речевого развития. Пациенты с синдромом
Симпсона-Голаби-Бемеля подвергаются повышенному риску возникновения эмбриональных опухолей (нефробластома, гепатобластома, надпочечниковая нейробластома, гонадобластома, гепатоцеллюлярная карцинома). Также была описана летальная форма синдрома, известная как синдром Симпсона-Голаби-Бемеля второго типа, характеризующаяся развитием водянки плода.Слайд 18Синдром Эдвардса (синдром трисомии 18))
Синдром Эдвардса (синдром трисомии 18) —характеризуется комплексом множественных пороков
развития и трисомией 18 хромосомы Описан в 1960 году Джоном Эдвардсом
(John H. Edwards). Популяционная частота примерно 1:3000 в США, и 1:5000 в мире на 2016 год. Дети с трисомией в 18 хромосоме чаще рождаются у пожилых матерей, взаимосвязь с возрастом матери менее выражена, чем в случаях трисомии хромосомы 21 и 13.Слайд 19Синдром Эдвардса (синдром трисомии 18))
Дети с трисомией 18 рождаются с низким
весом, в среднем около 2200 грамм, при этом длительность беременности —
нормальная или даже превышает норму. Фенотипические проявления синдрома Эдвардса многообразны. Чаще всего возникают аномалии мозгового и лицевого черепа, мозговой череп имеет долихоцефалическую форму. Нижняя челюсть и ротовое отверстие маленькие. Глазные щели узкие и короткие.Слайд 20Синдром Эдвардса (синдром трисомии 18))
Ушные раковины деформированы и в подавляющем большинстве
случаев расположены низко, несколько вытянуты в горизонтальной плоскости. Мочка, а
часто и козелок отсутствуют. Наружный слуховой проход сужен, иногда отсутствует. Грудина короткая, из-за чего межреберные промежутки уменьшены и грудная клетка шире и короче нормальной. В 80 % случаев наблюдается аномальное развитие стопы: пятка резко выступает, свод провисает (стопа-качалка), большой палец утолщён и укорочен.Слайд 21Синдром Эдвардса (синдром трисомии 18))
Из дефектов внутренних органов наиболее часто отмечаются пороки
сердца и крупных сосудов: дефект межжелуудочковой прегородки, аплазии одной створки клапанов
аорты и лёгочной артерии. У всех больных наблюдаются гипоплазия мозжечка и мозолистого тела, изменения структур олив, выраженная умственная отсталость, снижение мышечного тонуса, переходящее в повышение со спастикой.Слайд 22Скрининг детей, предрасположенных к гепатобластоме
Скрининг детей, предрасположенных к гепатобластоме
Американская ассоциация
исследований рака предложила проводить скрининг всех детей с риском развития
гепатобластомы более 1%. Скринингу подлежат пациенты с синдромами Беквита-Видемана, гемигиперплазии, Симпсона-Голаби-Бемеля и трисомии 18. Скрининг проводится с помощью УЗИ брюшной полости и определения альфа-фетопротеина каждые 3 месяца от рождения до четырёх лет жизни, что позволяет выявить от 90% до 95% гепатобластом, которые развиваются у этих детейСлайд 23ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМА
Ежегодная заболеваемость гепатоцеллюлярной карциномой в Соединенных Штатах составляет 0,8
случая на 1 миллион детей в возрасте от 0 до
14 лет и 1,5 случая на 1 миллион подростков в возрасте от 15 до 19 лет. Хотя заболеваемость гепатоцеллюлярной карциномой у взрослых в США неуклонно росли с 1970-х годов, возможно, из-за увеличения частоты хронических инфекций гепатита С, заболеваемость у детей не увеличилась.Слайд 24В некоторых азиатских странах заболеваемость гепатоцеллюлярной карциномой у детей в
10 раз выше, чем у детей в Северной Америке. Высокая заболеваемость,
по-видимому, связана с заболеваемостью перинатально приобретенным гепатитом B, который в большинстве случаев можно предотвратить путем вакцинации и введения иммуноглобулина против гепатита B новорожденному ребенку.Фиброламеллярная гепатоцеллюлярная карцинома, подтип гепатоцеллюлярной карциномы, который не связан с циррозом, вирусом гепатита B (HBV) или вирусом гепатита C (HCV), обычно встречается у подростков и молодых людей, но отмечается также у детей младшего возраста.
Слайд 25ФАКТОРЫ РИСКА РАЗВИТИЯ
ГЕПТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫ
Синдром Алагилля (Широкий лоб, глубоко посаженные
глаза и маленький выступающий подбородок. Нарушение желчных протоков приводит к внутрипеченочному
рубцеванию)Болезни накопления гликогена I – IV типов.
Гепатиты В и С.
Слайд 26ФАКТОРЫ РИСКА РАЗВИТИЯ
ГЕПАТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫ
Прогрессирующий семейный внутрипеченочный холестаз (Симптомы желтухи,
зуда и задержки развития начинаются в период новорожденности и переходят
в портальную гипертензию и печеночную недостаточность).Тирозинемия (В первые несколько месяцев жизни жизни отмечаются задержка развития, рвота, желтуха).
Слайд 28ПРОГНОЗ И ПРОНОСТИЧЕСКИЕ ФАКТОРЫ
Общая 5-летняя выживаемость (составляет 42% для
детей и подростков с гепатоцеллюлярной карциномой. 5-летняя выживаемость для гепатоцеллюлярной
карциномы может зависеть от стадии; В исследовании межгрупповой химиотерапии, проведенном в 1990-х годах, выжили семь из восьми пациентов со стадией I и менее 10% пациентов со стадиями III и IV Анализ данных эпиднадзора, эпидемиологии и конечных результатов (SEER) показал, что 5-летний показатель выживаемости составляет 24%, 10-летний показатель составляет 23%, а 20-летний показатель составляет 8% у пациентов в возрасте 19 лет и моложе. В многомерном анализе данных SEER хирургическая резекция, локализованная опухоль и неиспаноязычная этническая принадлежность были связаны с улучшенным исходом. У пациентов с полной хирургической резекцией частота выживаемости составляла 60%, а у пациентов с неполной резекцией - 0% .Слайд 29ПРИНЦИПЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПЕЧЕНИ У ДЕТЕЙ
Хирургия
Исторически полная хирургическая резекция
первичной опухоли требовалась для лечения злокачественных опухолей печени у детей.
Такой подход продолжает оставаться в силе и в настояшее время. Часто хирургические операции часто сочетаются с химиотерапией.Существует три способа хирургического лечения первичного рака печени у детей:
Первичная хирургическая резекция (моно или после химиотерапии).
Отсроченная хирургическая резекция (предшествует химиотерапия).
Ортотопическая трансплантация печени (трупного иили живого донора) (чаще всего предшествует химиотерапия).
Слайд 30Ортотопическая пересадка печени
Ортотопическая пересадка печени
Пересадки печени были связаны со значительным
успехом в лечении детей с неоперабельными опухолями печени. Обзор мирового
опыта задокументировал уровень выживаемости после трансплатации от 70% до 80% для детей с гепатобластомами. Инвазия в сосуды, метастазы в лимфатические узлы, и смежное внепеченочное распространение не оказало существенного неблагоприятного влияния на исход. Было высказано предположение, что адъювантная химиотерапия после трансплантации может снизить риск рецидива опухолиПациенты с гепатоцеллюлярной карциномой были старше, и чаще получали трупный орган, чем пациенты с гепатобластомой.
Пятилетняя выживаемость пациентов составляла 73%, а выживаемость трансплантата составляла 74% для всей когорты, при этом большинство случаев смерти происходило в результате злокачественных новообразований
Слайд 31Химиотерапия
Химиотерапия гораздо более успешна в лечении гепатобластомы, чем при гепатоцеллюлярной
карциноме .
Стандартом медицинской помощи в Соединенных Штатах Америки и ряде развитых
стран является предоперационная химиотерапия, когда опухоль неоперабельна, и послеоперационная химиотерапия после полной резекции, даже если предоперационная химиотерапия уже была проведена. Было показано, что лечение предоперационной химиотерапией приносит пользу детям с гепатобластомой.Слайд 32Радиационная терапия
Лучевая терапия, даже в сочетании с химиотерапией, не вылечила
детей с неоперабельными опухолями печени. Хотя стандартных показаний нет, лучевая терапия
может играть роль в лечении не полностью резецированной гепатобластомы. Стереотаксическая лучевая терапия организма является безопасным и эффективным альтернативным лечением, которое успешно применяется при гепатоцеллюлярной карциноме у взрослых, которые не могут подвергнуться абляции / резекции печени. Конформная радиотерапевтическая методика, если таковая имеется, может рассматриваться индивидуально у детей с гепатоцеллюлярной карциномой.Слайд 33Конформная лучевая терапия ─ радиационное воздействие на опухоль, при котором
для создания требуемой формы радиационного поля необходимо применение трехмерного планирования
облучения.При традиционной лучевой терапии планирование радиационного поля облучения строится на основе рентгенограмм, и план строится в одной плоскости. Перед конформной терапией построение плана радиационного лечения идет на основе данных компьютерной томографии. Сеансы конформной лучевой терапии проводят на линейных ускорителях. Формирование пучка частиц в линейном ускорителе происходит таким образом, чтобы быть направленным на зону опухоли, избегая воздействия на здоровые ткани.
Слайд 34Современные технологии радиотерапии используют большие суммарные дозы (СОД), ввиду чего
ключевую роль играет корректность подведения дозы к облучаемому объекту. Эффективность
3D конформной терапии прежде всего обусловлена возможностью подведения к опухолям адекватных доз излучения (в среднем не менее 76Гр), что существенно увеличивает вероятность излечения.Однако, в процессе проведения радиотерапии (направленного по плану излучения на опухоль) объект (раковая опухоль) зачастую смещается, что резко меняет суммарную дозу, получаемую опухолью. Для исключения возможности выхода опухоли из облучаемой зоны предложены различные приспособления. В частности, аппаратура для активного контроля за дыханием (Real-Time Position Management – RPM respiratory gating), система задержки дыхания (Active Breathing Coordinator) и другие.
Слайд 35Одними из основных методов комформной терапии является интенсивно модулированная терапия
(IMRT intensity-– modulated radiation therapy) и радиотерапия, корректируемая по изображениям
(IGRT – image guided radiation therapy), облучение с активным контролем дыхания. В данных технологиях для фиксирования положения опухоли с целью стабилизации значения СОД применяется технология RapidArc и аналогичные ей системы.Слайд 36RapidArc – технология для проведения лучевой терапии под визуальным контролем
с модуляцией интенсивности (технологии IMRT intensity-– modulated radiation therapy и
IGRT - image guided radiation therapy) с возможностью одновременного изменения формы, интенсивности пучка, а также угловой скорости вращения линейного ускорителя.Основными достоинствами технологии являются точность и вариативность подведения радиации, а также значительное ускорение лечения в сравнении со стандартной реализацией облучения с модуляцией интенсивности.
Слайд 37Технологии IMRT или IGRT требуют как минимум 4-8 минут для
проведения сеанса, что не слишком много, но RapidArc® превосходит эти
показатели в разы. Другие методики применяют более длительное облучение. Так, томотерапия может занять до 20 минут, а лечение посредством кибер-ножа – до 40 минут.Слайд 38Сокращение при использовании RapidArc – технологии времени облучения от 10-15
минут до двух минут, то есть почти в восемь раз,
позволяет предоставить больному более комфортную терапию. Это имеет очень большое значение особенно у детей младшего возраста, так как уменьшается время наркоза.Слайд 39Другие подходы к лечению
Другие подходы к лечению включают следующее:
Трансартериальная химиоэмболизация
(ТАСЕ) . TACE используется для пациентов с неоперабельной гепатобластомой.
Трансартериальная радиоэмболизация ( Как
один из вариатов - трансартериальная радиоэмболизация микрогранулами с иттрием Y-90) используется для облегчения лечения детей с гепатоцеллюлярной карциномой.Слайд 40Трансартериальная химиоэмболизация
Классическая методика лечения больного со злокачественным поражением печени включает
два основных этапа: хирургическое удаление первичного опухолевого очага и системное
химиотерапевтическое лечение. Однако к моменту диагностики радикальная операция на печени, как при первичном, так при метастатическом поражении, возможна только у 5-15% больных. У 60-80% пациентов, перенесших резекцию печени в отдаленном периоде наблюдается рецидив и прогрессирование метастатического поражения.Таким образом, паллиативная химиотерапия требуется более чем 70% больных со злокачественным поражением печени. При внутривенном введении терапевтическая концентрация достигается лишь на короткое время и в ряде случаев не оказывает необходимого воздействия на опухолевые клетки.
Слайд 41Трансартериальная химиоэмболизация
Эффективность системной химиотерапии при неоперабельном поражении не превышает 20%
при выживаемости 3–4 месяца. Даже при использовании комбинаций нескольких препаратов
частота объективного ответа составляет не более 30%. Выраженные нарушения детоксикационной функции печени определяют высокую опасность системного применения химиопрепаратов из-за возможного быстрого прогрессирования печеночной недостаточности.Большой объем поражения, трудности достижения терапевтической концентрации химиопрепарата в зонах поражения, высокая токсичность противоопухолевых препаратов ставят под сомнение успех традиционной системной лекарственной химиотерапии.
Слайд 42Трансартериальная химиоэмболизация
В последнее время в лечении больных нерезектабельным первичным и
метастатическим раком печени стали применяться методы интервенционной радиологии. Они обладают
рядом преимуществ по сравнению с системной химиотерапией. Введение препарата непосредственно в артериальное русло печени и метастатических узлов позволяет достигнуть локально терапевтической концентрации при значительно меньшем общем объеме лекарственного средства. Дополнительная окклюзия артерий печени увеличивает время нахождения препарата непосредственно в метастатических узлах, усиливая лечебный эффект.В ряде случаев регионарная внутриартериальная химиотерапия с применением цитостатиков позволяет перевести неоперабельных пациентов в разряд операбельных.
Слайд 43Трансартериальная химиоэмболизация
В ряде случаев регионарная внутриартериальная химиотерапия с применением современных
цитостатиков позволяет перевести неоперабельных пациентов в разряд операбельных.
Техника чрезкатетерной артериальной
химиоэмболизации была впервые предложена в 70-ые годы ХХ столетия доктором Ямада (Yamada) и соавт.Метод основан на особенности кровоснабжения опухолей печени. Нормальная паренхима имеет двойное кровоснабжение: из воротной вены – до 70%, из печеночной артерии – 30%, в то время как кровоснабжение опухолевого узла до 95% осуществляется из ветвей печеночной артерии. Такая сосудистая архитектоника позволяет селективно вводить высокие дозы химиопрепарата непосредственно к опухоли, предотвращая или значительно уменьшая воздействие химиопрепарата на здоровые клетки печени, а также, исключая ишемическое и токсическое повреждение паренхимы.
Слайд 44Трансартериальная химиоэмболизация
Развитие химиоэмболизации можно разделить на три этапа.
I.Метод начинался
с введения селективно в печеночную артерию измельченной желатиновой губки, насыщенной
противоопухолевыми препаратами: 10 мг митомицина С или 20 мг адриамицина. Недостатком методики была низкая абсорбирующая способность желатиновой губки и быстрое ее растворение, что снижало время воздействия химиотерапевтического препарата на опухоль.Слайд 45Трансартериальная химиоэмболизация
II. В 80-е годы прошлого столетия было сделано наблюдение,
что инъекция масляного йодированного сложного эфира, выделенного из масла маковых
зёрен, (липиодол), способна проникать и задерживаться в опухолях, таких как первичная гепатоцеллюлярная карцинома и метастазы кишечного и нейроэндокринного рака в печень. Было обнаружено, что липиодол способен на длительное время накапливать химиопрепараты, что позволяло достигнуть двойного эффекта – эмболизации артерий с прекращением кровотока в опухоли и ее некроза, а также увеличение времени нахождения химиопрепарата в области поражения.Слайд 46Трансартериальная химиоэмболизация
III. Новым этапом развития метода химиоэмболизации было открытие и
внедрение в клиническую практику микросфер.
В настоящий момент существуют 2 типа
микросфер, предусматривающих возможность лекарственного насыщения: микросферы Hepasphere (Biosphere Medical Inc., Франция) и DC Bead (Biocompatibles, Великобритания). Сверхабсорбирующие Hepasphere - это биосовместимые, гидрофильные (абсорбирующие) нерезорбируемые микросферы, изготовленные из акрилового сополимера и предназначенные для эмболизации печёночной артерии, с возможностью впитывать жидкости в объёмах в 64 раза превышающих объём микросфер в сухом виде. Степень увеличения размера микросфер зависит от концентрации ионов в окружающей среде. Размер частиц в сухом виде варьируется от 50 до 200 мкм, и в насыщенном виде от 200 до 800 мкм соответственно. Сверхабсорбирующие микросферы насыщаются доксорубицином непосредственно перед их введением. Слайд 47Трансартериальная химиоэмболизация
Микросферы DC Bead являются первыми пренасыщенными микросферами. Они изготавливаются
из полимерного гидрогеля, модифицированного добавлением сульфокислоты, что позволяет полимеризировать их
для получения сферических частиц различного размера и насыщаются доксорубицином непосредственно при производстве.Слайд 48Трансартериальная химиоэмболизация
При использовании микросфер в опухоли достигается тройной эффект, а
именно: 1. доставка химиопрепарата, 2.механическая эмболизация за счет слипания микросфер в
прекапиллярном русле и 3. продолжительное контролируемое высвобождение препарата.Слайд 49Трансартериальная химиоэмболизация
Чрезкатетерная артериальная химиоэмболизация позволяет использовать широкий спектр лекарственных препаратов,
таких как доксорубицин, цисплатин и митомицин С и др. До
настоящего времени нет достоверной информации о том, какие из химиопрепаратов наиболее эффективны. Наиболее часто используемый в монотерапии препарат – это Доксорубицин, а также комбинация цисплатина, доксорубицина и митомицина С. Однако, несмотря на высокие внутриопухолевые концентрации, ни одно рандомизированное исследование не показало преимуществ одного препарата над другими. Есть предположение, что эмболизация питающего опухоль сосуда увеличивает эффективность вводимых химиопрепаратов только после того, как химиотерапия проведена в полном объёме.Слайд 50Трансартериальная химиоэмболизация
Таким образом, при химиоэмболизации решается несколько задач: доставка химиопрепарата
непосредственно к опухолевому узлу, предотвращение вымывания лекарственного препарата из опухоли
и провокация ишемического некроза опухоли печени.Согласно критериям Gates et al.,предложенным в 1999 г., показаниями для химиоэмболизации были: достаточные функциональные резервы печени (билирубин не более 70 ммоль/л), отсутствие внепеченочного распространения опухоли, морфологические формы опухоли, при которых химиоэмболизация эффективна (метастазы колоректального рака, рака молочной железы, гепатоцеллюлярный рак), гемоглобин более 80 г/л.
Слайд 51Трансартериальная химиоэмболизация
Процедура химиоэмболизации ветвей печеночной артерии включает два этапа: диагностический
и лечебный.
Под наркозом (у детей) или местной анестезией проводят чрескожную
пункцию и катетеризацию бедренной артерии, в которой устанавливаливается интродъюссер. В печеночную артерию вводят специальный катетер и выполняют селективную ангиографию с контрастированием артериального русла печени с целью оценки ангиографической морфологии внутрипеченочных опухолевых узлов, локализации и количества питающих их сосудов, наличия артериальных анастомозов при повторных вмешательствах.Слайд 52Трансартериальная химиоэмболизация
Для выполнения, так называемой масляной химиоэмболизации в качестве эмболизата
применяют эмульсию, состоящую из химиопрепарата и липиодола. Средний объем вводимой
эмульсии составляет 20 мл. Применяют следующие химиопрепараты: Доксорубицин (от 50 до 100 мг), Митомицин С (от 5 до 10 мг), Гемзар (от 600 до 1000 мг). Дозу препарата выбирают в зависимости от размеров поражения, биохимических показателей крови, характеризующих печеночный цитолиз, объема дистального артериального русла, питающего опухолевый узелСлайд 53Трансартериальная химиоэмболизация
Масляную химиоэмболизацию дополняют механической окклюзией ветвей печеночной артерии
мелконарезанной гемостатической губкой, в том числе у пациентов с частичным
тромбозом ствола воротной вены и с ранее перевязанной правой ветвью воротной вены.При использовании Hepasphere окклюзии проводят только сферами без применения гемостатической губки.
Слайд 54Трансартериальная химиоэмболизация
В качестве химиопрепарата используют Доксорубицин 50–100 мг, Оксаллиплатин 100
мг, Гемзар 500–1000 мг , Митомицин С 10 мг .
После процедуры осуществляли механическую окклюзию ветвей печеночной артерии гемостатической губкой (1 см2), в том числе у пациентов с частичным тромбозом ствола воротной вены и с ранее перевязанной правой ветвью воротной вены.Курсы масляной химиоэмболизации повторяют первые полгода – 1 раз в 2 месяца, вторые полгода – 1 раз в 3 месяца, далее – один раз в шесть месяцев.
При эмболизации Hepasphere первым этапом выполняют эмболизацию правой печеночной артерии, вторым этапом (через 3-4 недели) – эмболизацию левой печеночной артерии. Далее через 1 месяц проводят повторную компьютерную томографию для оценки эффективности вмешательства.
Слайд 55Трансартериальная химиоэмболизация
Эффективность процедуры оценивают по критериям RECIST (Response Evaluation Criteria
in Solid Tumors 1.1 (2009 г.): Полный или частичныйэффект – уменьшение
объема опухоли более чем на 25 %. Стабилизация – уменьшение объема опухоли менее чем на 25 % или отсутствие увеличения образования и появления новых очагов в печени. Прогрессирование – увеличение размеров опухоли или появления новых очагов в печени.Слайд 56Трансартериальная химиоэмболизация
Наиболее часто (у 60 — 80% пациентов) встречается постэмболизационный синдром.
Он проявляется переменчивыми болями в правом верхнем квадранте живота, тошнотой,
умеренно выраженной непроходимостью кишечника, утомлением, лихорадкой, временным повышением уровня печёночных ферментов. Как правило, эти симптомы проявляются в течение трёх-четырёх дней и проходят сами по себе, без лечения; в типичном случае полное восстановление наступает через 7 — 10 дней. Полагают, что главной причиной постэмболизационного синдрома является некроз опухоли, между тем, более поздние публикации связывают это явление с и с повреждением здоровых участков печени.Слайд 57Трансартериальная химиоэмболизация
Опасные осложнения TACE включают поражение здоровых тканей печени из-за недостаточного кровоснабжения,
печёночную недостаточность, абсцесс печени, острый холецистит, повреждение желчевыводящих путей, язвенную
болезнь желудка и двенадцатиперстной кишки, нарушение функции почек, эмболию (закупорку) сосудов лёгких или головного мозга (последнее встречается крайне редко, но может приводить к летальному исходу). Смертность, обусловленная лечением, составляет приблизительно 2-3%.Трансартериальная химиоэмболизация увеличивает риск реактивации инфекции у пациентов с хроническим гепатитом B; таким больным необходима предварительная противовирусная профилактика.
Слайд 58Трансартериальная химиоэмболизация
Химиоэмболизация: противопоказания
Существует множество относительных противопоказаний для проведения процедуры TACE, в том
числе, сердечная или почечная недостаточность, асцит, наличие кровотечения из варикозно
расширенных вен, повышенная концентрация в сыворотке крови билирубина, высокий уровень в крови некоторых ферментов (лактатдегидрогеназа, аспартатаминотрансфераза) и тромбоцитопения. Трансартериальная химиоэмболизация не показана, если опухолью поражено более половины объёма печени.Не рекомендуется проведение трансартериальной химиоэмболизации (TACE) перед операцией резекции печени.
Слайд 59Трансартериальная химиоэмболизация
Хотя TACE повсеместно используется в качестве вспомогательной процедуры для пациентов,
ожидающих трансплантации печени, достоверных данных о пользе подобных манипуляций пока
крайне мало.TACE наиболее подходит пациентам с большой или многоочаговой опухолью, не подлежащей резекции или локальной деструкции, у которых неплохо сохранилась функция печени, опухоль не затрагивает сосуды и не распространена вне тканей печени, нет тромбоза основного ствола воротной вены, непроходимости желчных путей, тяжёлого цирроза или энцефалопатии).
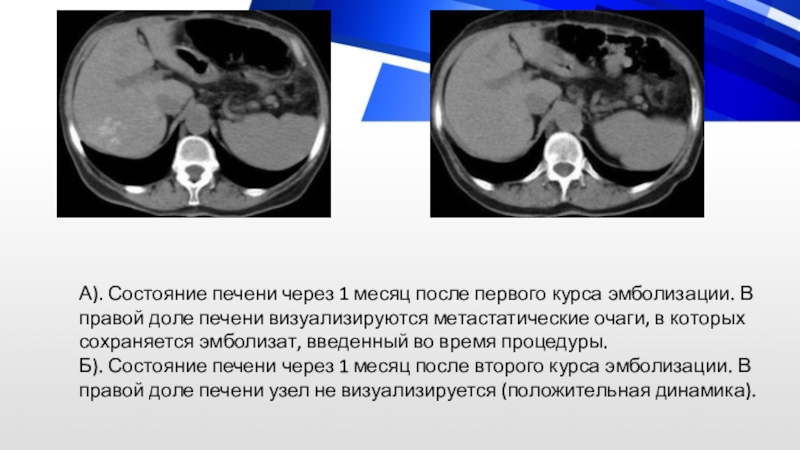
Слайд 60А). Состояние печени через 1 месяц после первого курса эмболизации.
В правой доле печени визуализируются метастатические очаги, в которых сохраняется
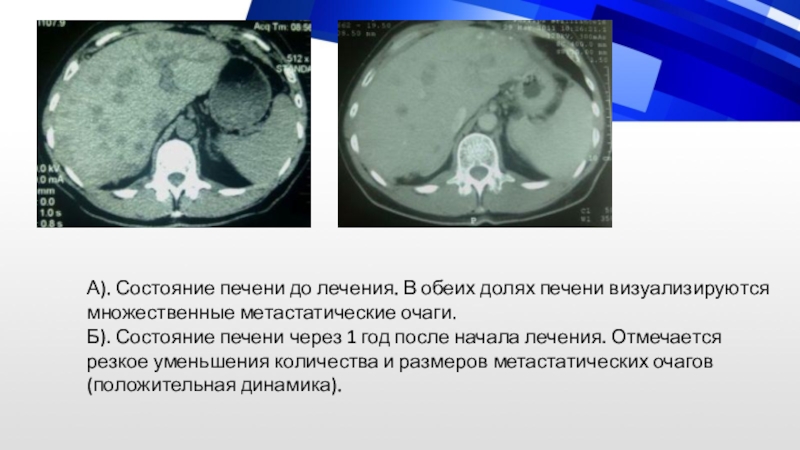
эмболизат, введенный во время процедуры. Б). Состояние печени через 1 месяц после второго курса эмболизации. В правой доле печени узел не визуализируется (положительная динамика).Слайд 61А). Состояние печени до лечения. В обеих долях печени визуализируются
множественные метастатические очаги. Б). Состояние печени через 1 год после начала
лечения. Отмечается резкое уменьшения количества и размеров метастатических очагов (положительная динамика).Слайд 62РАДИОЭМБОЛИЗАЦИЯ — регионарная внутриартериальная радиотерапия
применение дистанционной лучевой терапии для лечения
злокачественных новообразований печени сдерживается высокой чувствительностью здоровых тканей к облучению.
Одним из альтернативных способов локального лучевого воздействия на опухоль является радиоэмболизация. Это терапия радиоактивными изотопами, носителями которых, к примеру, могут быть микросферы, выполненные из стекла или полимеров, либо масляное рентгеноконтрастное вещество липиодол. Носители изотопов избирательно доставляются к опухоли путём введения через катетер в печёночную артерию, то есть, таким же способом, как это происходит при химиоэмболизации.Слайд 63Радиоэмболизация липиодолом, содержащим иод-131 (131I)
Имеется незначительное число публикаций, касающихся использования
липиодола, меченого иодом-131, при лечении рака печени. Известны результаты единичного
клинического исследования, проведённого методом случайной выборки на 142 пациентах с нерезектабельным первичным раком печени. Сравнивались две технологии лечения: радиоэмболизация 131I липиодолом и трансартериальная химиоэмболизация (TACE) с использованием противоопухолевого препарата цисплатина. Сокращение размеров опухолей было сходным при том и другом методе. Но пациенты гораздо лучше переносили применение 131I липиодола: количество случаев тяжёлых побочных реакций – 3 против 29. Липиодол, меченый иодом-131, может использоваться и для адъювантной (то есть вспомогательной) терапии после резекции опухоли печениСлайд 64Радиоэмболизация микросферами, содержащими иттрий-90 (90Y)
Радиоэмболизация, использующая внутриартериальное введение микросфер с
иттрием – 90, приводит к обширному некрозу опухоли с приемлемыми
показателями безопасности лечения. Однако отсутствуют исследования, показывающие влияние метода на выживаемость, и пока что нет единого мнения по поводу оптимального использования такого лечения. Если радиоэмболизация микросферами иттрия-90 применяется перед трансплантацией печени, она сдерживает прогрессирование заболевания, предоставляя пациентам больше времени для ожидания донорского органа. Больные, не отвечающие обычным критериям трансплантации, могут стать кандидатами на проведение радиоэмболизации с целью достижения соответствия этим критериям. Но при этом у них не должно быть тромбоза воротной вены и распространение опухоли должно ограничиваться пределами печени.Слайд 65Радиоэмболизация микросферами, содержащими иттрий-90 (90Y)
Считается, что радиоэмболизация с использованием стеклянных
(TheraSphere) или полимерных (SIR-Spheres) микросфер, маркированных иттрием-90, безопасна и эффективна
для пациентов с нерезектабельной гепатоцеллюлярной карциномой (первичным печёночно-клеточным раком). При таком лечении наблюдались клинические симптомы лучевой интоксикации: тошнота, боль в области живота, появление и/или усиление слабости и временное повышенное содержание билирубина в крови.Слайд 66Применение радиоэмболизации
Если при нерезектабельном первичном раке печени слишком имеются большие
размеры или множественность очагов опухоли не позволяют проведение процедур локальной
деструкции (таких как RFA), то радиоэмболизация не может быть рекомендована как предпочтительное лечение (из-за высокой стоимости).Слайд 67Применение радиоэмболизации
В то же время селективная радиоэмболизация может рассматриваться как
альтернатива TACE для пациентов с прогрессирующей гепатоцеллюлярной карциномой, которые имеют
сосудистые инвазии опухоли или тромбоз воротной вены.Даже сторонники радиоэмболизации полагают, что она должна применяться лишь у пациентов с нерезектабельным первичным раком, не распространённым вне печени.