Слайд 1Современная схема кроветворения
Регуляция гемопоэза
Лабораторная гемоцитология
Слайд 2Современная теория кроветворения
Современная теория кроветворения базируется на унитарной теории А.А.
Максимова (1918), согласно которой все клетки крови происходят из единой
родоначальной клетки, морфологически напоминающей лимфоцит.
Подтверждение этой гипотезы было получено лишь в 60-е годы при введении смертельно облученным мышам донорского костного мозга. Клетки, способные восстанавливать гемопоэз после облучения или токсических воздействий, носят название «стволовых клеток»
Слайд 4Современная теория кроветворения
Нормальное кроветворение поликлональное, т. е. осуществляется одновременно многими
клонами.
Размер индивидуального клона - 0,5-1 млн зрелых клеток
Продолжительность жизни клона
- не превышает 1 месяц, около 10% клонов существуют до полугода.
Клональный состав кроветворной ткани полностью меняется в течение 1-4 месяцев.
Постоянная замена клонов объясняется истощением пролиферативного потенциала стволовой кроветворной клетки, поэтому исчезнувшие клоны никогда не появляются вновь.
Различные гемопоэтические органы заселены разными клонами и только некоторые из них достигают такой величины, что оккупируют более чем одну кроветворную территорию.
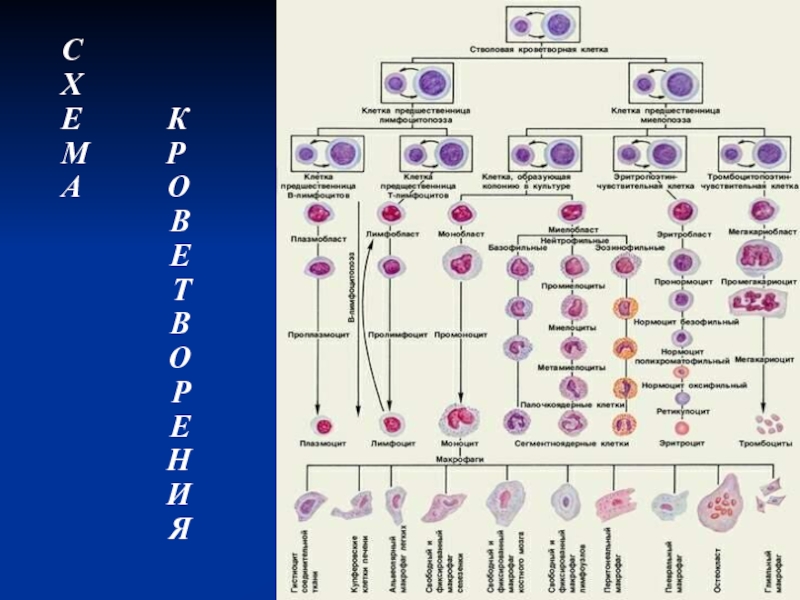
Слайд 5Дифференцировка клеток гемопоэза
Клетки гемопоэза условно подразделены на 5-6 отделов, границы
между которыми весьма размыты, а между отделами содержится много переходных,
промежуточных форм.
В процессе дифференцировки происходит постепенное снижение пролиферативной активности клеток и способности развиваться сначала во все кроветворные линии, а затем во все более ограниченное количество линий.
Слайд 6Дифференцировка клеток гемопоэза
I отдел – тотипотентная эмбриональная стволовая клетка (ЭСК),
находится на самом верху иерархической лестницы
II отдел - пул
поли - или мультипотентных стволовых кроветворных клеток (СКК)
СКК обладают уникальным свойством - полипотентностью, т. е. способностью к дифференцировке во все без исключения линии гемопоэза.
В клеточной культуре можно создать условия, когда возникающая из одной клетки колония содержит до 6 различных клеточных линий дифференцировки.
Слайд 7Стволовые кроветворные клетки
СКК закладываются в период эмбриогенеза и расходуются последовательно,
образуя сменяющие друг друга клоны более зрелых кроветворных клеток.
90% клонов
являются короткоживущими, 10% клонов может функционировать в течение длительного времени.
СКК обладают высоким, но ограниченным пролиферативным потенциалом, способны к ограниченному самоподдержанию, т. е. не бессмертны.
СКК могут проделать приблизительно 50 клеточных делений, поддерживают продукцию кроветворных клеток в течение всей жизни человека.
Слайд 8Стволовые кроветворные клетки
Отдел СКК гетерогенен, представлен 2 категориями предшественников, обладающих
различным пролиферативным потенциалом.
Основная масса СКК находится в фазе покоя
G0 клеточного цикла, обладает огромным пролиферативным потенциалом. При выходе из покоя СКК вступает на путь дифференцировки, снижая пролиферативный потенциал и ограничивая набор дифференцировочных программ.
После нескольких циклов деления (1-5) СКК может вернуться вновь в состояние покоя, при этом их состояние покоя менее глубоко и при наличии запроса они отвечают быстрее, приобретая маркеры определенных линий дифференцировок в культуре клеток за 1-2 дня, тогда как исходным СКК требуется 10-14 дней.
Длительное поддержание кроветворения обеспечивается резервными СКК. Необходимость срочного ответа на запрос удовлетворяется за счет СКК, прошедших дифференцировку и находящихся в состоянии быстро мобилизуемого резерва.
Слайд 9Стволовые кроветворные клетки
Гетерогенность пула СКК и степень их дифференцировки устанавливается
на основе экспрессии ряда дифференцировочных мембранных антигенов.
Среди СКК выделены:
примитивные мультипотентные предшественники (CD34+Thyl+)
более дифференцированные предшественники, характеризующиеся экспрессией антигена гистосовместимости II класса (HLA-DR), CD38.
Истинные СКК не экспрессируют линейно специфические маркеры и дают рост всем линиям гемопоэтических клеток. Количество СКК в костном мозге - около 0,01%, а вместе с клетками-предшественниками - 0,05%.
Слайд 10Стволовые кроветворные клетки
Одним из основных методов изучения СКК является метод
колониеобразования in vivo или in vitro, поэтому иначе СКК называют
“колониеобразующими единицами” (КОЕ).
Истинные СКК способны к формированию колоний из бластных клеток (КОЕ-бластные). Сюда же относят клетки, формирующие селезеночные колонии (КОЕс).
Эти клетки способны полностью восстанавливать гемопоэз.
Слайд 11Дифференцировка клеток гемопоэза
III отдел - По мере снижения пролиферативного потенциала
СКК дифференцируются в полиолигопотентные коммитированные клетки-предшественники, имеющие ограниченную потентность, так
как коммитированы (commit - принятие на себя обязательств) к дифференцировке в направлении 2-5 гемопоэтических клеточных линий.
Полиолигопотентные коммитированные предшественники КОЕ-ГЭММ (гранулоцитарно-эритроцитарно-макрофагально-мегакариоцитарные) дают начало 4 росткам гемопоэза, КОЕ-ГМ - двум росткам.
КОЕ-ГЭММ являются общим предшественником миелопоэза. Они имеют маркер CD34, маркер миелоидной линии CD33, детерминанты гистосовместимости HLA-A, HLA-B, HLA-C, HLA-DR.
Слайд 12Дифференцировка клеток гемопоэза
Клетки IV отдела - монопотентные коммитированные предшественники являются
родоначальными для одного ростка гемопоэза:
КОЕ-Г для гранулоцитарного,
КОЕ-М -
для моноцитарно-макрофагального,
КОЕ-Э и БОЕ-Э (бурстобразующая единица) - предшественники эритроидных клеток,
КОЕ-Мгкц - предшественники мегакариоцитов
Все коммитированные клетки-предшественники имеют ограниченный жизненный цикл и не способны к возвращению в состояние клеточного покоя.
Монопотентные коммитированные предшественники экспрессируют маркеры соответствующей клеточной линии дифференцировки.
Слайд 13СКК и клетки-предшественники обладают способностью к миграции - выходу в
кровь и возвращению в костный мозг, что получило название “homing-effect”
(инстинкт дома). Именно это их свойство обеспечивает обмен кроветворных клеток между разобщенными кроветворными территориями, позволяет использовать их для трансплантации в клинике.
Слайд 14Дифференцировка клеток гемопоэза
V отдел морфологически распознаваемых клеток включает:
дифференцирующиеся,
созревающие
зрелые клетки всех 8 клеточных линий, начиная с бластов, большинство
из которых имеют характерные морфоцитохимические особенности.
Слайд 15Регуляция гемопоэза
Кроветворная ткань - динамичная, постоянно обновляющаяся клеточная система организма.
В минуту в кроветворных органах образуется более 30 млн клеток.
В течение жизни человека - около 7 тонн.
По мере созревания, образующиеся в костном мозге клетки, равномерно поступают в кровеносное русло.
Эритроциты циркулируют в крови - 110-130 суток, тромбоциты - около 10 суток, нейтрофилы - менее 10 ч.
Ежедневно теряется 1х10¹¹ клеток крови, что восполняется «клеточной фабрикой» - костным мозгом. При повышении запроса на зрелые клетки (кровопотеря, острый гемолиз, воспаление), производство может быть увеличено в течение нескольких часов в 10-12 раз.
Увеличение клеточной продукции обеспечивается гемопоэтическими факторами роста
Слайд 16Регуляция гемопоэза
Гемопоэз инициируется ростовыми факторами, цитокинами и непрерывно поддерживается благодаря
пулу СКК.
Стволовые кроветворные клетки стромозависимы и воспринимают короткодистантные стимулы,
получаемые ими при межклеточном контакте с клетками стромального микроокружения.
По мере дифференцировки клетка начинает реагировать на дальнедействующие гуморальные факторы.
Эндогенная регуляция всех этапов гемопоэза осуществляется цитокинами через рецепторы на клеточной мембране, посредством которых про водится сигнал в ядро клетки, где происходит активация соответствующих генов.
Основными продуцентами цитокинов являются моноциты, макрофаги, активированные Т -лимфоциты, стромальные элементы - фибробласты, эндотелиальные клетки и др.
Слайд 17Регуляция гемопоэза
Обновление СКК происходит медленно и при готовности к дифференцировке
(процесс коммитирования), они выходят из состояния покоя (Go - фаза
клеточного цикла) и становятся коммитированными.
Это означает, что процесс стал необратимым и такие клетки, управляемые цитокинами, пройдут все стадии развития вплоть до конечных зрелых элементов крови.
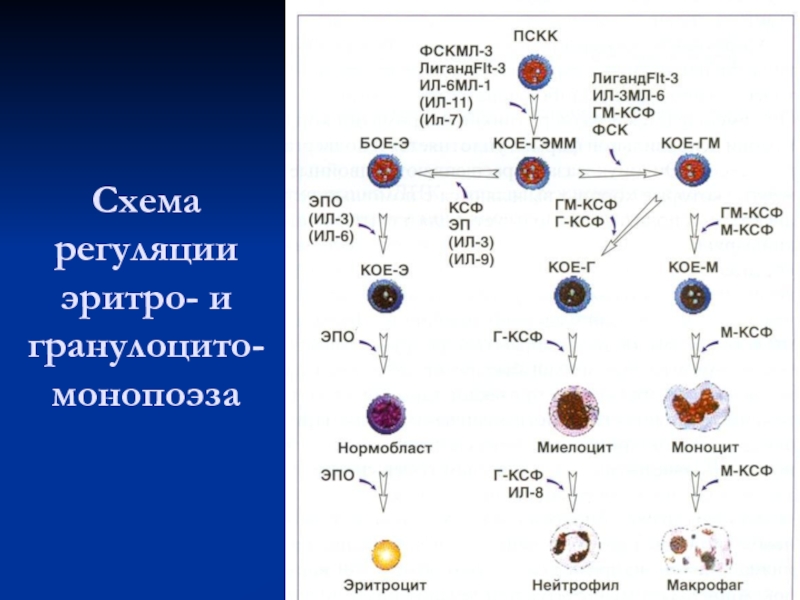
Слайд 18Схема регуляции эритро- и гранулоцито-монопоэза
Слайд 19Регуляторы гемопоэза
Выделяют позитивные и негативные регуляторы гемопоэза.
Позитивные регуляторы необходимы:
для выживания СКК и их пролиферации,
для дифференцировки и
созревания более поздних стадий гемопоэтических клеток.
К ингибиторам (негативные регуляторы) пролиферативной активности СКК и всех видов ранних гемопоэтических предшественников относят :
трансформирующий ростовой фактор β (TGF-β),
макрофагальный воспалительный белок (MIP-1α),
фактор некроза опухоли а (ФНО-α),
интерферон -а
интерферон -у,
кислые изоферритины,
лактоферрин
другие факторы.
Слайд 20Факторы регуляции гемопоэза
Факторы регуляции гемопоэза подразделяются на короткодистантные (для СКК)
и дальнодействующие для коммитированных предшественников и созревающих клеток.
В зависимости
от уровня дифференцировки клетки факторы регуляции делят на 3 основных класса:
1. Факторы, влияющие на ранние СКК:
фактор стволовых клеток (ФСК),
гранулоцитарный колониестимулирующий фактор (Г - КСФ),
интерлейкины (ИЛ-6, ИЛ-11, ИЛ-12),
ингибиторы, которые тормозят выход СКК в клеточный цикл из состояния покоя (MIP-1α, TGF-β, ФНО-α, кислые изоферритины и др.).
Эта фаза регуляции СКК не зависит от запросов организма.
Слайд 21Факторы регуляции гемопоэза
2. Линейно-неспецифические факторы:
ИЛ-3,
ИЛ-4,
ГМ-КСФ (для гранулоцитомонопоэза).
3. Позднедействующие
линейно-специфические факторы, которые поддерживают пролиферацию и созревание коммитированных предшественников и
их потомков:
эритропоэтин,
тромбопоэтин,
колониестимулирующие факторы (Г-КСФ, М-КСФ, ГМ-КСФ),
ИЛ-5.
Один и тот же ростовой фактор может действовать на разнообразные клетки-мишени на различных этапах дифференцировки, что обеспечивает взаимозаменяемость молекул, регулирующих гемопоэз.
Слайд 22Регуляция гемопоэза
Активация и функционирование клеток зависит от многих цитокинов. Клетка
начинает дифференцировку только после взаимодействия с факторами роста, но в
выборе направления дифференцировки они не участвуют.
Содержание цитокинов определяет количество продуцируемых клеток, число проделываемых клеткой митозов.
Так, после кровопотери снижение рО2 в почках приводит к усилению продукции эритропоэтина, под действием которого эритропоэтинчувствительные эритроидные клетки - предшественники костного мозга (БОЕ-Э), увеличивают на 3-5 число митозов, что повышает образование эритроцитов в 10-30 раз.
Число тромбоцитов в крови регулирует выработку фактора роста и развитие клеточных элементов мегакариоцитопоэза.
Еще одним регулятором гемопоэза является апоптоз - запрограммированная клеточная смерть